Макрофаги захищають від атрофії м’язів та сприяють відновленню м’язів у природних та природних середовищах
Ніколас Дюмон
Від Centre Hospitalier Universitaire de Québec – Centre de Recherche du Center Hospitalier de l’Université Laval, * та Département de Réadaptation, † Faculté de Médecine, Université Laval, City of Quebec, Quebec, Canada
Жером Френет
Від Centre Hospitalier Universitaire de Québec – Center of Recherche du Center Hospitalier de l’Université Laval, * та Département de Réadaptation, † Faculté de Médecine, Université Laval, City of Quebec, Canada, Canada
Анотація
Моноцити - це великі одноядерні клітини, які циркулюють у крові та диференціюються в макрофаги у вторгнених тканинах у відповідь на різні подразники. 1 Макрофаги мають сильну фагоцитарну здатність і можуть організувати запальний процес шляхом вивільнення широкого спектру цитокінів та хемокінів, таких як інтерлейкін (ІЛ) -1, фактор некрозу пухлини-α та запальний білок-2 макрофагів. 2, 3 Численні дослідження також продемонстрували, що макрофаги відіграють безпосередню роль у відновленні тканин завдяки вивільненню протизапальних молекул та анаболічних факторів росту IL-10, основного фактора росту фібробластів та інсуліноподібного фактора росту (IGF- 1). 4, 5, 6
У цьому дослідженні мишей, виснажених у макрофагах, піддавали розвантаженню та перевантаженню задніх кінцівок, щоб оцінити роль макрофагів у атрофії та відростанні м'язів. Наші результати показали, що макрофаги ні запобігають втраті м’язової сили, ні сприяють відновленню під час ранньої запальної фази (через 1 і 3 дні після перезавантаження). Однак вони відіграють ключову роль у зростанні та відновленні м’язів пізніше (через 7 та 14 днів після перезавантаження). Крім того, модель кокультури in vitro, в якій атрофовані міотрубки поєднували з макрофагами, що виражають протизапальний фенотип, показала, що наявність макрофагів захищає міотрубки від атрофії і що цей захисний ефект частково опосередкований вивільненням IGF-1.
Матеріали і методи
Тварини
Самці мишей C57BL/6 (22-24 г) з річки Чарльз (Сент-Констант, QC, Канада) отримували воду та їжу ad libitum і утримували 12-годинний цикл світло/темрява. Експериментальних мишей піддавали розвантаженню задніх кінцівок протягом 10 днів, використовуючи модифікацію методики, розробленої Морі-Холтоном та Глобусом. 17 Задні кінцівки потім перевантажували протягом 0, 3, 7 або 14 днів. В якості контролів використовували амбулаторних мишей. Мишей евтаназували вивихом шийки матки під наркозом. Усі процедури були затверджені Комітетом з догляду та використання тварин Університету Лаваль на основі рекомендацій Канадської ради з догляду за тваринами.
Виснаження моноцитів/макрофагів
Для визначення специфічної ролі моноцитів/макрофагів у відновленні м’язів від атрофії етопозид (VP-16, Sigma, St. Louis, MO), розведений у диметилсульфоксиді (15 мг/кг маси миші), вводили щодня протягом 3 днів перед перезавантаженням до кінця експериментального протоколу. Етопозид діє як інгібітор топоізомерази II і застосовується при лікуванні деяких злоякісних пухлин, таких як нелімфоцитарний лейкоз, для пригнічення проліферації білих кров’яних тілець. 18 мишам плацебо отримували щоденні ін'єкції диметилсульфоксиду. Вплив етопозиду на кількість лейкоцитів підтверджено проточною цитометрією, як описано раніше. 14 Коротше кажучи, кров відбирали шляхом серцевої пункції, інкубували блокуючий щурячий IgG (Sigma) та мітили 0,2 мг кон’югованих антитіл Ly-6G R-фікоеритрин щурів проти 0,4 миші F4/80 Кон'юговане з R-фікоеритрином антитіло (первинні антитіла, BD Pharmingen, Franklin Lakes, NJ) для виявлення нейтрофілів та макрофагів відповідно. Кон'югований з R-фікоеритрином щурячий анти-мишачий IgG використовували як антитіло до ізотипу при тих же концентраціях (BD Pharmingen). Проточну цитометрію проводили за допомогою проточного цитометра EPICS XL (Beckman-Coulter, Fullerton, CA).
Ізометричні властивості скорочення
Мишам вводили i.p. з бупренорфіном (0,1 мг/кг) як знеболюючим засобом та знеболювали пентобарбіталом натрієм (50 мг/кг) через 15 хвилин. 19 М'язи правої підошви ретельно розтинали, прикріплювали до електрода та інкубували в забуференному фізіологічному розчині солі (Кребса-Рінгера) з додаванням глюкози (2 мг/мл) для абсолютного та специфічного вимірювання сили м'язів, як описано раніше. 14, 20 Абсолютна сила м’язів являє собою загальну силу, що генерується м’язом, тоді як питома сила м’язів також враховує м’язову масу та довжину волокна. Після цього вимірювали довжину м’язів, видаляли сухожилля та зважували м’язи. Потім м’язи вбудовували в середовище для заморожування тканин (Triangle Biomedical Sciences, Дарем, Північна Кароліна), заморожували в ізопентані (2-метилбутан, Sigma), охолоджували в рідкому азоті і зберігали при -80 ° C до використання.
Імуногістохімія та підрахунок клітин
Поперечні зрізи (10 мкм) м’язів підошви вирізали (кріостат CM1850, Leica Microsystems, Nussloch, Німеччина) при -20 ° C і прикріпили до предметних стекол Snowcoat X-tra (Surgipath, Richmond, IL). Через 1 годину в блокувальному буфері зрізи інкубували протягом 2 годин з антитілом F4/80 щурячого миші (Serotec, Оксфорд, Великобританія) для ідентифікації макрофагів або антитіл Ly-6G/Ly-6C щурячих (RB6- 8C5, BD Pharmingen) для ідентифікації нейтрофілів. Потім зрізи інкубували з кролячим анти-щурячим біотинільованим IgG (вторинне антитіло, Vector Laboratories, Burlingame, CA) протягом 1 години. Нарешті, зрізи інкубували протягом 30 хвилин з пероксидазою хрону авидином D (Vector Laboratories) та виявляли за допомогою діамінобензидинового хромогену (DakoCytomation, Carpinteria, CA). Кожен зріз досліджували за допомогою світлової мікроскопії зі збільшенням × 400, і кількість мічених клітин у всьому зрізі визначали і виражали на мм 2. Кількість запальних клітин вимірювали в двох примірниках на двох відділах живота середнього та нижнього відділів м’язів підошви. Для статистичного аналізу використовували середні значення чотирьох зрізів на мишу на антитіло.
Культура клітин та атрофія міотрубок
Культури макрофагів/міотрубок
Аналіз діаметра міотрубки
Діаметри міотрубок вимірювали за допомогою світлової мікроскопії при × 100 (Nikon, Токіо, Японія). Три різні ділянки в кожній лунці були сліпо ідентифіковані та спостерігалися протягом експерименту. Діаметри міотрубок визначали кількісно за допомогою цифрової системи візуалізації ImageJ (Національний інститут охорони здоров’я, Бетесда, Меріленд). Для кожної міотрубки було проведено перше вимірювання ширини на відстані 50 мкм від краю міотрубки та кожні 200 мкм згодом. Цей метод зазвичай дозволяв реєструвати два-три вимірювання для кожної міотрубки, а середнє значення розглядалося як одне значення. Вимірювали діаметри від 150 до 200 міотрубок на лунку.
Вміст білка та Вестерн-блот
Статистичний аналіз
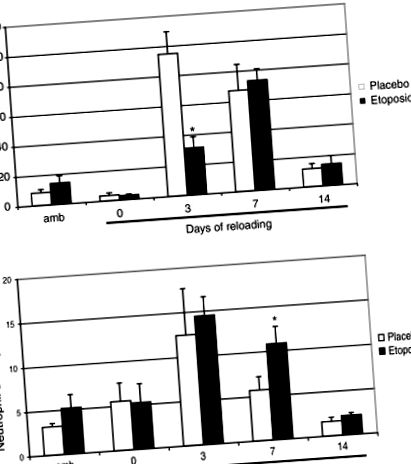
Усі значення подаються як середні значення ± SEM. Дані аналізували за допомогою одностороннього дисперсійного аналізу, щоб визначити, чи були варіації між експериментальними групами достовірними (JMP). Коли було отримано значне співвідношення F, було проведено багаторазове порівняння з використанням захищеного тесту найменших значущих відмінностей Тукі, щоб визначити, чи мали місце певні відмінності. Рівень значущості був встановлений на рівні Р (рис. 1А). Однак кількість макрофагів у м’язах підошви була порівнянна з такою у мишей-плацебо на 7 день після перезавантаження. Хоча етопозид незначно зменшив кількість циркулюючих нейтрофілів, кількість інфільтрованих нейтрофілів не змінювалася протягом різних періодів перезавантаження, за винятком 7-го дня, коли спостерігалося 2-кратне збільшення в групі перезавантажених етопозидів порівняно з групою плацебо, що перевантажувалась ) .
Ідентифікація фенотипу макрофагів за допомогою експресії білка ЦОГ-2. Рівень білка ЦОГ-2 визначали вестерн-блоттингом білків, вилучених лише з макрофагів (негативний контроль), макрофагів, що містять апоптотичні нейтрофіли, та макрофагів, інкубованих з ліпополісахаридом (LPS; 200 нг/мл) (позитивний контроль). Смуга COX-2 має молекулярну масу приблизно 72 кДа. Гліцеральдегід-3-фосфатдегідрогеназа (GAPDH) була використана як маркер завантаження білка і має молекулярну масу приблизно 37 кДа.
A: Діаметри та довжина міотрубок у моно- та кокультурах після низької сироваткової атрофії міотрубок середнього ступеня та нейтралізації IGF-1. Діаметри міотрубки (A) та довжина (B) вимірювали в монокультурах міотрубок, міотрубки, культивованих макрофагами, міотрубки, інкубовані з анти-IGF-1, і міотрубки, культивовані з макрофагами та анти-IGF-1. Значення виражаються як середні значення ± SEM (n = 12 на 1 день і n = 6 на 2 день). Значно відрізняється від монокультур міотрубок, * P 27, 28, 29 Велика кількість макрофагів у місцях пошкодження під час розв'язання запальної реакції та початку фази відновлення та їх здатність переходити від провоспалювального до протизапального фенотипу зробити їх чудовим кандидатом для сприяння відновленню та зростанню м’язів. 30, 31 У цій статті ми продемонстрували, що макрофаги відіграють вирішальну роль у відновленні м’язової сили після атрофії м’язів. Ми також показали, використовуючи систему культивування макрофагів/міотрубок, що IGF-1, що виділяється макрофагами, захищає від атрофії міотрубок та зменшення вмісту важких ланцюгів міозину.
Ці результати додають до зростаючої кількості досліджень, які демонструють, що макрофаги благотворно впливають на відновлення м'язів при різних травмах та порушеннях. 27, 51, 57, 58, 59 Вперше ми показали, що макрофаги відіграють найважливішу роль на функціональному рівні для відновлення м’язів після атрофії. Ми також продемонстрували, використовуючи систему кокультури, що IGF-1 частково відповідає за здатність макрофагів захищати міотрубки від атрофії. Буде цікаво визначити роль інших факторів, що беруть участь у цьому позитивному ефекті. Нарешті, нинішні результати також непрямо свідчать про те, що протизапальні препарати слід застосовувати з обережністю через позитивні ефекти різних субпопуляцій макрофагів під час відновлення та росту м’язів.
Виноски
Адресати запити на передрук до Джерема Френет, доктора філософії, доктора філософії, CHUQ-CRCHUL, 2705 Boulevard Laurier, T-R-93, місто Квебек, QC, Канада G1V 4G2. Електронна пошта: [email protected].
За підтримки грантів Канадських інститутів досліджень здоров’я та Ради природничих та технічних досліджень Канади.
- Функціональне значення полімеризації бензодіазепінових рецепторів периферичного типу in vivo та in vitro
- Аналіз in vivo клітин γH2AX у скелетних м’язах у людей похилого та ожиріння - Дунган - 2020 -
- Склад ліпідів у м’язах та печінці симпатричних риб-корегонідів з Байкалу (Coregonus spp
- Запобіжні заходи та кроки до одужання при зціленні після викидня
- Як яловичина корисна здоров’ю серця, м’язовій масі та функції мозку Журнал про яловичину