Ліпокортин 1
ANXA1 може виступати супресором пухлини на ранніх стадіях раку через можливість того, що втрата ANXA1 може зробити нормальну клітину генетично нестабільною, збільшуючи її шанс отримати підступну перевагу необмеженої проліферативної здатності [32].
Пов’язані терміни:
- Волохатоклітинний лейкоз
- Новоутворення
- Серозит
- Пептид
- Білок
- Мутація
- Анексин
- Нейтрофіл
Завантажити у форматі PDF
Про цю сторінку
Додаток А1
Анотація
Анексин А1 - це мономерний білок 37 кДа з широким, але селективним розподілом у тканинах. Це багато в деяких ключових типах клітин вродженої та адаптивної імунної системи та нейроендокринної системи. Значення цього білка для реакції на стрес полягає в тому, що його синтез та вивільнення регулюється глюкокортикоїдами (ГК). Після вивільнення з клітин-мішеней позаклітинний білок може діяти автокринно або паракринно, використовуючи рецептори клітинної поверхні сімейства формилпептидів для здійснення своїх біологічних дій. Багато гострих наслідків ГК в імунній та нейроендокринній системах можна пояснити функціонуванням цього шляху.
Прогрес у терапії ревматоїдного артриту
Флавіо А. Амарал,. Мауро М. Тейшейра, в Імунному ребалансі, 2016
2.5.2 Додаток А1
Анексин А1, індукований глюкокортикоїдами білок 37 кДа, та його активний пептид Ac2-26 мають однакові рецептори LXA4, FPR2/ALX. 62 Активація цього рецептора викликає цілий ряд прорезолютивних дій, включаючи зменшення взаємодії лейкоцитів з ендотеліальними клітинами, 63 збільшення апоптозу нейтрофілів, 64 та посилення ефероцитозу. 65,66 Крім того, використовуючи гуманізовану модель артриту, надмірна експресія Анексину А1 в моноцитарній клітинній лінії U937 зменшила їх здатність мігрувати до синовіальної тканини RA, імплантованої важким комбінованим імунодефіцитним мишам. 40 Таким чином, анексин А1 є молекулою, яка активно впливає на біологію лейкоцитів і може бути мішенню для контролю запалення в клінічних умовах.
Повідомлялося про наявність антитіл проти анексину А1 у сироватці крові хворих на РА, які отримували гідрокортизон. 67 Також синовіоцити, подібні до фібробластів RA, мали зменшені сайти зв'язування з анексином А1. 68 Ці дослідження можуть надати пояснення деяких випадків резистентності до глюкокортикоїдів у хворих на РА. Кілька доклінічних досліджень показали, що анексин А1 відіграє дуже важливу роль у контролі запалення в контексті експериментального артриту. У щурів введення антитіл проти анексину А1 скасувало сприятливий вплив дексаметазону на антиген-індукований артрит, включаючи збільшення продукції TNF та PGE2 у синовіальній тканині. 69 Ці дані були підтверджені за допомогою мишей з дефіцитом анексину А1 (AnxA1 -/-). Хоча різниці в інтенсивності артриту між мишами AnxA1 -/- та мишей дикого типу не було, лікування мишей AnxA1 -/- дексаметазоном було порушено. 70 Отже, як видно для LXA4 та Додатку А1, використання агоністів для FPR2/ALX може бути альтернативною терапією РА та інших хронічних запальних захворювань.
Пептид Анексин-А1 Ac2–26
Рецептори для Anx-A1 та N-ацетилу 2–26
Рідний Anx-A1 та його біоактивні N-кінцеві пептиди здійснюють позаклітинні дії на клітини, щоб імітувати деякі ефекти глюкокортикоїдів як in vivo, так і in vitro. Тому було обгрунтованим припущенням, що існує рецептор клітинної поверхні для білків.
Перші експериментальні докази такого рецептора виникли завдяки спостереженню, що на поверхні моноцитів периферичної крові людини та нейтрофілів людини, які зникли під час запальної реакції та копреципітували з Anx-, існували дискретні, насичувані місця зв'язування людського рекомбінантного Anx-A1. А1 з мембранних екстрактів. Пізніше рецептор-подібні білки були описані в ендокринних клітинах гіпофіза. 5
Ключова стаття від Walther et al. 33 привів поле в іншому напрямку, впливаючи на формульований пептид (f-Met-Leu-Phe; FMLP) рецептор (FPR) у трансдукції сигналу Anx-A1 у лейкоцитах. FPR є членом сімейства рецепторів, пов'язаних з G-білками, експресованих у мігруючих клітинах та багатьох інших тканинах. У людини відомі три види: сам FPR (нині відомий як FPR1), FPRL-1 (FPR-подібний-1, який також називають FPR2 або ALXR) і FPRL-2 (нині відомий як FPR3). Хоча FPR1, ймовірно, опосередковує прозапальну дію бактеріального три-пептиду FMLP, FPR2/ALX є більш розгалуженим зв'язуючим ліпоксином А4, протизапальним медіатором, що генерується з арахідонової кислоти, а також амілоїдом А в сироватці крові, білком гострої фази печінки. 4
Anx-A1 та пептид Ацетил 2–26 індукують перехідні процеси кальцію в нейтрофілах людини, припускаючи, що їх ефекти опосередковуються через сам FPR1. 33 Однак, на відміну від FMLP, пов'язані з Anx-A1 пептиди не стимулюють генерацію супероксиду в концентраціях, що провокують потоки кальцію та випадання L-селектину, і FMLP не конкурує з зв'язуванням Anx-A1 у клітинах, трансфікованих FPR1 людини.
Антагоністи «Boc» (Boc-Met-Leu-Phe та Boc-Phe-D-Leu-Phe-D-Leu-Phe) із сімейства рецепторів FPR інгібують індуковані Anx-A1 потоки кальцію та виділення L-селектину за допомогою ПМН а також запобігати індукованому ацетилом 2–26 інгібуванню адгезії та еміграції лейкоцитів на мишачих моделях запалення та інших місцях. 17 Однак цим антагоністам не вистачає специфіки між членами сім'ї FPR, що ускладнює визначення того, який підтип використовується. Ацетил 2–26 також зберігає протизапальну активність у нульових мишей FPR1 14, припускаючи, що хоча сімейство FPR опосередковує деякі ефекти Anx-A1, відповідальним рецептором навряд чи буде сам FPR1.
З трьох продуктів кластеру генів FPR у людини лише FPR2/ALXR пов'язує протизапальний ліпоксин А4. Це зв'язування може бути витіснене SAA і високими концентраціями FMLP або синтетичного пептиду MMK1. 4 Як Anx-A1, так і ацетил 2-26 також зв'язують FPR2/ALX у людській ПМН і конкурують конкретно з ліпоксином A4. Ендогенні Anx-A1 та FPR2 ко-імунопреципітати з людської та мишачої ПМН. 25 Як і ліпоксин А4, ацетил 2–26 зберігає здатність сприяти відшаруванню прикріплених лейкоцитів у нульових мишей FPR1, ще раз припускаючи, що рецептор для Anx-A1 є не FPR1, а подальшим підтипом. 14
У миші кластер генів fpr зазнав диференціального розширення, і було виявлено шість генів. 11 Два не виражені, а інший виявляється лише в скелетних м’язах. Решта три гени (тепер їх називають Fpr1, Fpr2 та Fpr3) експресуються в лейкоцитах, селезінці та легенях і тому є потенційними мишачими рецепторами для Anx-A1. Однак у миші функції людського FPR2/ALX, здається, розділені між Fpr2 та Fpr3. Ймовірно, що мРНК для Fpr2 та Fpr3 утворюється шляхом диференціальної транскрипції того самого гена.
Дафтон та ін. 11 генерував нульовий штам Fpr2/3 нуля і використовував його для оцінки ролі цих рецепторів у дії Anx-A1 та ацетилу 2–26. Ці трансгенні миші не реагують на N-кінцевий пептид ацетил 2-26 та інші агоністи цих рецепторів і виявляють посилену запальну реакцію у порівнянні з реакцією на контрольних тваринах WT. Ці результати нагадують поведінку нульової миші Anx-A1 і взяті разом з іншими результатами 2 вказують на існування протизапальної петлі з центром на цьому рецепторі.
Анексин *
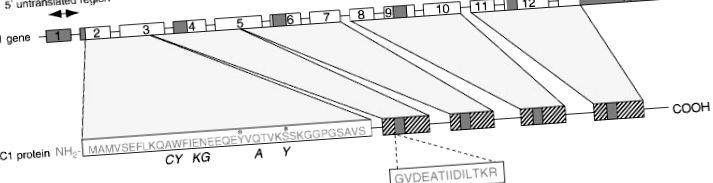
Структура ліпокортину 1
Фігура 1 . Принципова схема будови людського ліпокортину 1 та його кодуючого гена. *, потенційні місця фосфорилювання; ▨, повторювані одиниці з 25–35% гомологією послідовності; ▪ послідовність консенсусу в повторюваній одиниці. Курсив представляє відповідну послідовність у щурів.
Нейтрофіли
Інші молекули, що розсмоктують запалення
Після активації нейтрофілів анексин А1 (ліпокортин) вивільняється у відповідь на хемоаттрактанти, знижуючи регуляцію трансміграції та сприяючи апоптозу та кліренсу нейтрофілів. 82 Подібні дії відносять до пептидів, отриманих з хемерину. 83 Активовані нейтрофіли також продукують антагоніст рецептора IL-1 (IL-1ra). 84 Ефективність терапії рекомбінантним ІЛ-1ра (анакінра) при аутозапальних захворюваннях підкреслює його клінічне значення для придушення запалення. Також виявлено опосередкований MMP механізм розсмоктування запалення. Отримані макрофагами ММР, такі як ММР-1, ММР-3 та ММР-12, розщеплюють CXC-хемокіни, провокують втрату активності рекрутингу нейтрофілів та зменшують приплив клітин. 85
Лімфома крайової зони селезінки
| Анексин-А1 | Негативні | Якщо позитивне, розгляньте HCL |
| Bcl-2 | Позитивні | Негативний у залишкових клітинах GC |
| Bcl-6 | Негативні | Позитивний у залишкових клітинах GC; може бути позитивним у трансформованому SMZL |
| CD5 | Негативні | Зазвичай негативний; тьмяний позитив у малій підмножині |
| CD20 | Позитивні | Яскравий вираз |
| CD21 | Негативні | Виділяє клітини FDC у центрах вузликів білої пульпи |
| CD23 | Негативні | Позитив у FDC meshworks; якщо клітини лімфоми позитивні, розгляньте ХЛЛ |
| CD43 | Негативні | Якщо позитивні, розгляньте CLL або MCL |
| Циклін-D1 | Негативні | Якщо позитивне, розгляньте MCL |
| Циклін-D3 | Негативні | Якщо позитивне, розгляньте SDRPSBCL |
| DBA44 | Позитивні | Позитивний у 20% випадків |
| Кі-67 | Не застосовується | Лімфома зазвичай має низький рівень проліферації; залишковий ГК високий Кі-67 |
| pax-5 | Позитивні |
HCL = лейкоз волохатих клітин; GC = зародковий центр; SMZL = лімфома крайової зони селезінки; FDC = фолікулярні дендритні клітини; ХЛЛ = хронічний лімфолейкоз; MCL = лімфома мантійних клітин; SDRPSBCL = дифузна червона пульпа селезінки, дрібна В-клітинна лімфома.
| CD3 | Негативні | |
| CD5 | Зазвичай негативний | Приглушений позитив у ∼ 20% випадків |
| CD10 | Негативні | Якщо позитивне, розгляньте фолікулярну лімфому |
| CD11c | Позитивні в ∼ 50% | |
| CD20 | Позитивні | Яскравий |
| CD22 | Позитивні | Яскравий |
| CD23 | Зазвичай негативний | Позитивний у 30% випадків |
| CD25 | Зазвичай негативний | Позитивний у ∼ 25% випадків |
| CD79b | Зазвичай позитивний | |
| CD103 | Негативні | Позитивний у 10% випадків |
| CD123 | Негативні | |
| FMC7 | Позитивні | Позитивні в більшості випадків |
| IgM | Позитивні | Більшість випадків |
| IgD | Позитивні | ∼ 60% випадків |
Анексини (ліпокортини)
Різноманітність у родині анексінів
Таблиця 1. Сімейство анексинів (ліпокортин)
| Додаток I | Кальпактин II, Хромбіндин 9, GIF, с35 | Субстрат кінази рецептора EGF |
| Додаток II | Кальпактин I, Хромбіндин 8, р36, PAP-IV, Білок I | Субстрат Src-кінази |
| Додаток III | Кальцимедин 35-α, Кальфобіндин III, PAP-III | |
| Додаток IV | Кальцимедин 35-β, Калелектрин 32,5K, Хромобіндин 4, Ендонексин I, PAP-II, PP4-X, Білок II | F-актин-зв’язуючий білок |
| Анексин V | Anchorin CII, Calelectrin 35K, Calphobindin I, Calcimedin 35-γ, Endonexin II, IBC, VAC-α, PAP-I, PP4 | Антикоагулянтний білок |
| Додаток VI | Кальцимедін 67K, Калелектрін 67K, Кальфобіндин II, Хромбіндин 20, p68, p70, 73K, Білок III, Синбібін | |
| Додаток VII | Синексин | |
| Додаток VIII | Судинний антикоагулянт (VAC-β) | |
| Додаток IX | Drosophila melanogaster annexin | |
| Додаток X | Drosophila melanogaster annexin | |
| Додаток XI | Анексин, асоційований з кальцикліном (CAP) -50 | |
| Додаток XII | Hydra vulgaris annexin | |
| Додаток XIII | Кишковоспецифічний анексин (ISA) |
Результати геномного аналізу дозволяють припустити, що гени анексину можуть бути отримані із загального гена-предка, і що еволюція та диверсифікація сімейства виникла шляхом двох послідовних дублювань послідовності ДНК, що кодує білок, схожий на один повтор. Структура всіх генів анексину добре збережена. 5'-фланкуюча область генів анексину містить послідовності для місць зв'язування кількох факторів транскрипції, що вказує на регуляцію транскрипції мітогенною стимуляцією, стероїдами та металами, тоді як 5'-фланкуюча область демонструє алюмоподібні повтори. Наявність потенційних місць сплайсингу та структури Z-ДНК у ділянці С-кінцевого ядра утворює різні ізоформи анексинів.
Запалення та зцілення1
Протизапальні посередники
- Метаболізм людини - огляд тем ScienceDirect
- Мальва парвіфлора - огляд тем ScienceDirect
- Мальтітол - огляд тем ScienceDirect
- Їжа з льону - огляд тем ScienceDirect
- Нарінгін - огляд тем ScienceDirect