Ліпаза підшлункової залози
Ліпаза підшлункової залози, що виділяється в навколишні тканинні рідини під час гострого панкреатиту, може збільшувати кількість вільних жирних кислот, які можуть омилювати кальцій у крові під час протікання через підшлункову залозу, що призводить до значного зниження рівня кальцію в сироватці крові.
Пов’язані терміни:
- Фосфопротеїн
- Коліпаза
- Тригліцериди
- Шлункова ліпаза
- Ферментативний гідроліз
- Ліпаза
- Вкладений ген
- Травлення
- Втрата маси тіла
Завантажити у форматі PDF
Про цю сторінку
Функція підшлункової залози
2 Ліпази
Ліпаза підшлункової залози виділяється в активній формі, але її активність посилюється жовчними солями. Жовчні солі підвищують ефективність ліполізу, збільшуючи площу поверхні масляно-водної поверхні, на якій ефективна водорозчинна ліпаза. Коліпаза - це невеликий білок, що синтезується в підшлунковій залозі, що дозволяє ліпазі підшлункової залози функціонувати, незважаючи на концентрацію міцелярних кон'югованих солей жовчі. Жовчні солі самі по собі заважають адсорбції ліпази на тригліцеридах, покриваючи всю поверхню розділу вода-субстрат. Коліпаза, як правило, запобігає цьому і діє як якір для адсорбції ліпази, дозволяючи ліпазі гідролізувати субстрат (Vandermeers-Piret et al., 1977). Для активації ліпази може знадобитися кальцій (Janowitz and Banks, 1976).
Ліпаза підшлункової залози проявляє оптимальну активність у лужних умовах і гідролізує тригліцериди до жирних кислот та гліцерину, але моно- та дигліцериди також є кінцевими продуктами. Ліпаза підшлункової залози має більшу активність щодо коротколанцюгових, ніж довголанцюгові тригліцериди (Cohen et al., 1971).
Фосфоліпази А і В також присутні в підшлунковому соку. Фосфоліпаза А відщеплює жирну кислоту від лецитину або цефаліну з утворенням лізолектину та лізоцефаліну. Фосфоліпаза В здатна розщеплювати жирну кислоту та лізолектин, утворюючи гліцерилфосфорил-холін.
Гідролаза ефіру холестерину підшлункової залози каталізує гідроліз харчових ефірів холестерину в просвіті кишечника. Виробляється вільний холестерин разом із вільним холестерином у раціоні та у жовчі поглинається кишковими абсорбційними клітинами. Тут він реестерифікується до складних ефірів холестерину, і вони транспортуються в лімфу в хіломікронах (Gallo et al., 1977). Усунення секреції підшлункової залози з кишечника собак знижувало рівень ефіру холестерину в їх лімфі (Hernandez et al., 1955).
Ензимологія на мембранному інтерфейсі: інтерфаційна ензимологія та білково-мембранне зв’язування
Е. Матеос-Діас,. Ф. Каррієр, у Методи в ензимології, 2017
3.2 Побудова моделі орієнтації ліпази на межі розділу ліпід-вода
Хоча ліпаза підшлункової залози є ліпазою відомої тривимірної структури з найскладнішою архітектурою (два домени; один білковий кофактор), вона особливо корисна для спроби визначити загальну міжфазну орієнтацію всіх ліпаз за відсутності експериментальних даних, що підтверджують орієнтацію ферменту/проникнення на поверхню ліпідних агрегатів і без запуску моделювання молекулярної динаміки. Загальну модель орієнтації ліпаз на межі розділу ліпід-вода можна отримати з комбінованих структурних гомологій HPL з іншими ліпазами (загальна складка α/β-гідролази), з одного боку, та ліпідозв'язуючими доменами, з іншого боку.
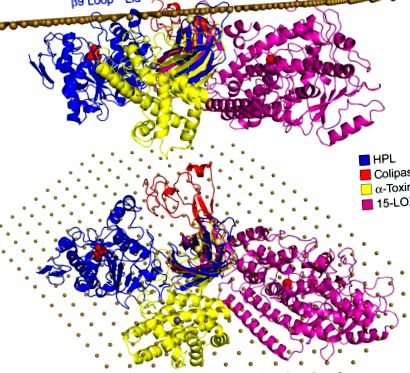
Рис.4. Тривимірні структури ферментів з доменами PLAT/C2, вирівняними на передбачуваному інтерфейсі. 3D-структура HPL (трасування Cα блакитної стрічки, відкрита конформація) була орієнтована таким чином, що петля β9, кришка та петля β5 ′ контактували з площиною межі поділу, матеріалізованою масивом атомів вуглецю на відстані 6 Å (коричневі сфери). У цій орієнтації гідрофобний фрагмент коліпази (червоний Cα-трасування) також тісно контактує з площиною. Кролича 15-ліпоксигеназа (15-LOX; відстеження Cα фіолетової стрічки) та α-токсин/фосфоліпаза C Clostridium perfringens (відстеження Cα жовтої стрічки) були вирівняні до β-сендвіч-домену HPL на основі гомології їх N-кінця і С-кінцеві домени відповідно.
Молекулярна модель комплексу HPL/коліпази на передбачуваній межі поділу може бути побудована на основі структурної гомології з ліпидозв'язуючим доменом cPLA2 C2 та орієнтації цього домену на поверхні ліпосом, виведених із флуоресцентної спектроскопії триптофану (Perisic, Paterson, Mosedale, Lara-Gonzalez, & Williams, 1999) та дослідження SDSL – EPR (Ball, Nielsen, Gelb, & Robinson, 1999) (рис. 4). Петля β5 ′ та гідрофобні петлі з N-кінцевого домену (кришка та β9-петля) вирівнюються з площиною розділу, а також N-кінцева частина та гідрофобні залишки коліпази (рис. 4). Коли 3D-структури 15-ліпоксигенази кролика та α-токсину C. perfringens накладаються на HPL на основі їх гомологічного домену C2/PLAT, можна побачити, що їх відповідні каталітичні домени знаходяться поблизу площини межі розділу (рис. 4 A), а доступ до їх каталітичного майданчика повернутий у бік площини (рис. 4 Б).
Модель для орієнтації HPL на передбачуваній межі розділу ліпід-вода дозволяє додатково орієнтувати інші ліпази на основі їх збереженої складки α/β гідролази. Накладання 3D-структур HPL, DGL, RML, TLL та TrCut показує, як кришка у відкритій конформації тісно контактує з площиною межі поділу, незалежно від ліпази (рис. 3 A та B), і відкриває гідрофобні залишки, що оточують активний вхід на сайт і звернений до інтерфейсу (рис. 5). Ця модель орієнтації може бути надалі використана для аналізу вкладу гідрофобних залишків у ІРС кожної ліпази на основі кристалічних структур, отриманих у присутності поверхнево-активних речовин та інгібіторів.
Рис.5. 3D-структури ліпаз у комплексі з інгібіторами та поверхнево-активними речовинами на передбачуваній межі розділу. Орієнтація ліпази така ж, як на рис. 3, з боковими видами в (A) - (F) та видом зверху в (A ′) - (F ′). Усі ліпази показані у вигляді трасування Cα синьої стрічки, за винятком активних серинових атомів, які відображаються як червоні сфери. Гідрофобні залишки, що потрапляють при відкритті кришки, поверхнево-активні речовини та ковалентно зв’язані інгібітори відображаються відповідно як сіра, зелена та блакитна сфери. (A) A ′: відкрита HPL, кокристалізована C11 алкілфосфонатом та BOG. (B) B ′: відкрита свиняча панкреатична ліпаза (PPL), кокристалізована TGME. (C) C ′: відкритий RML. (D) D ′: відкритий DGL, кокристалізований C11Y4 алкілфосфонатом та BOG. (E) E ′: відкритий TLL, кокристалізований олеїновою кислотою. (F) F ′: відкритий TrCut, кокристалізований алкилфосфонатом C11 та BOG.
Застосування імунологічного аналізу у ветеринарній діагностиці
Томас П. О’Коннор-молодший,. Ервін Варкмен, у «Довіднику з імунологічного аналізу» (четверте видання), 2013 р
Технологія аналізу
Аналізи ліпази підшлункової залози собак та котів доступні у двох імунометричних (сендвіч) форматах ІФА, кількісному тесті мікропланшету та якісному тестуванні пристрою SNAP в клініці. Ці тести призначені для визначення рівня імунореактивної панкреатичної ліпази у зразках сироватки. У тестах використовуються моноклональні антитіла, які реагують на різні епітопи собачих та котячих панкреатичних ліпаз. Захоплююче антитіло іммобілізується на твердій фазі (мікротитрувальні лунки або частинки), і антитіло для виявлення або кон'югату проводиться за допомогою пероксидази хрону (HRPO). Кон'юговане антитіло змішують із зразком і наносять на пристрій SNAP або лунку для мікротитрування. Якщо присутні в зразку, cPL або fPL з'єднує кон'юговане антитіло для виявлення HRPO і антитіло для захоплення, яке фіксується на поверхні пристрою. Після промивання та додавання субстрату утворюється продукт реакції синього кольору, пропорційний кількості cPL або fPL, присутній у зразку.
Аналізи формату мікропланшетів використовують набір з 5 калібраторів, які запускаються з кожним аналізом для побудови калібрувальної кривої. Рівні cPL або fPL визначаються шляхом вимірювання значень поглинання, отриманих зразками, та їх співвідношення зі стандартною кривою. Окремі набори виготовляються для собак (Spec cPL ® Test) та котів (Spec fPL ® Test), оскільки імунореактивність та контрольні діапазони різні для кожного виду.
Аналізи SNAP (SNAP ® cPL ™ та SNAP ® fPL ™) включають контрольну пляму, яка прилягає до діагностичної плями (пляма ліпази, специфічна для підшлункової залози), і використовується для визначення рівня ліпази підшлункової залози у зразку пацієнта (рис. 3). Якщо діагностична пляма має менш інтенсивний синій колір, ніж контрольна пляма, рівень ліпази підшлункової залози вважається нормальним. Якщо діагностичне пляма має подібний або більш інтенсивний синій колір, швидше за все, рівень ліпази підшлункової залози підвищений.
РИСУНОК 3. Пристрій для аналізу ліпази підшлункової залози SNAP.
- Співвідношення білкової енергії - огляд тем ScienceDirect
- Значення білка - огляд тем ScienceDirect
- Pentatrichomonas hominis - огляд тем ScienceDirect
- Снек-бар - огляд тем ScienceDirect
- Перитонеальна рідина - огляд тем ScienceDirect