Злоякісні шлункові перешкоди на виході: лікування саморозширювальними металевими стентами
Джин Хен Кім
Департамент радіології та Науково-дослідний інститут радіології, Медичний центр Асана, Університет Ульсанського медичного коледжу, Сеул, Корея.
Пісня Хо-Янга
Департамент радіології та Науково-дослідний інститут радіології, Медичний центр Асана, Університет Ульсанського медичного коледжу, Сеул, Корея.
Джи Хун Шін
Департамент радіології та Науково-дослідний інститут радіології, Медичний центр Асана, Університет Ульсанського медичного коледжу, Сеул, Корея.
Анотація
Нерезектабельна злоякісна обструкція шлункового виходу (ГОО) серйозно впливає на якість життя з ускладненнями, що включають нудоту, блювоту, аспірацію, біль та недоїдання. Хоча паліативні хірургічні процедури традиційно виконуються, вони пов'язані з високим рівнем захворюваності та смертності. Розміщення саморозширюваних металевих стентів асоціюється з вищими показниками клінічного успіху, меншою захворюваністю, меншим часом від процедури до початку прийому всередину, меншою частотою затримки спорожнення шлунка та меншим терміном перебування в лікарні, ніж паліативна хірургія. Флюороскопічне або ендоскопічне розміщення оголених або покритих саморозширюваних металевих стентів є безпечним, нехірургічним, паліативним методом лікування нерезектабельних злоякісних ГО з високим рівнем клінічного успіху та низьким рівнем серйозних ускладнень. Непрохідність стента та міграція є найпоширенішими ускладненнями, але більшість з них можна впоратись за допомогою інтервенційного лікування. Незважаючи на те, що за останнє десятиліття відбулися значні зрушення у розробці стента, необхідні великі проспективні, рандомізовані дослідження для визначення ідеального стента для злоякісних ГОО.
ВСТУП
Нерезектабельні злоякісні перешкоди на виході із шлунку (ГОО), найчастіше спричинені раком шлунка або підшлункової залози, мають серйозний негативний вплив на якість життя пацієнта з ускладненнями, що включають нудоту, блювоту, аспірацію, біль та недоїдання. 1 - 3 Основною метою лікування у цих пацієнтів є зменшення обструктивних симптомів, тим самим покращуючи якість життя. 4 Хоча традиційно проводяться паліативні хірургічні процедури, вони пов’язані з високим рівнем захворюваності та смертності через перенесене захворювання та поганий загальний стан. 1, 2, 5
Зовсім недавно флуороскопічне або ендоскопічне керування розміщенням оголених або покритих саморозширюваних металевих стентів все частіше застосовується як безпечний, нехірургічний, паліативний варіант лікування для пацієнтів з нерезектабельними злоякісними ГОО. 1 - 12 Розміщення саморозширюваних металевих стентів асоціюється з вищими показниками клінічного успіху, меншою захворюваністю, меншими термінами від процедури до початку прийому всередину, меншими показниками затримки спорожнення шлунка та меншим терміном перебування в лікарні, ніж паліативна хірургія. 13, 14 У цій статті розглядається використання цього малоінвазивного терапевтичного варіанту при паліативному лікуванні нерезектабельних злоякісних ГОО.
ВИДИ СТЕНДІВ
Для покриття розширюваних металевих стентів використовуються різні типи покривних матеріалів, включаючи поліуретан, силіконовий каучук та нейлон. 2, 6, 16, 20, 21 Порушення покривної мембрани може призвести до вростання пухлини, 20 при цьому поліуретанові мембрани в області шлунково-дванадцятипалої кишки особливо схильні до хімічної деградації після впливу кислої шлункової рідини, жовчних солей та деяких гідролітичних ферментів у підшлунковій залозі виділень. 22
ПОРЯДОК РОЗМІЩЕННЯ СТАНТІВ
За кілька днів до встановлення стента проводять комп’ютерну томографію, ендоскопію або серію барію для оцінки місця, тяжкості та довжини стриктури. Назогастральний зонд вводять принаймні за 24 години до процедури, щоб забезпечити належне спорожнення шлунка. Порожній шлунок стає циліндричним і дозволяє легше маніпулювати катетером та просувати пристрій для доставки стента.
Процедура проводиться в умовах свідомої седації та знеболення (наприклад, внутрішньовенне введення мідазоламу та фентанілу). 23, 24 Зів знеболюють 1% спреєм лідокаїну. Стенти можуть бути введені ендоскопічно за допомогою флюороскопічної допомоги гастроентерологами або лише за допомогою флюороскопії інтервенційними рентгенологами. Пацієнтів розміщують у правому боковому пролежні, і стриктура спочатку проходить за допомогою направляючої дроту. Під комбінацією ендоскопічного та флюороскопічного наведення система доставки стента просувається через робочий канал ендоскопа через жорстку направляючу дріт, розташовується поперек стриктури і розгортається. В якості альтернативи, лише під флюороскопічним керівництвом, провід і катетер (100 см, 5 або 6 Fr) вводять через рот через стриктуру в дистальну частину шлунка або дванадцятипалої кишки. Циклічність системи провідника-катетера може бути зменшена за допомогою направляючої оболонки 12 Fr або 18 Fr. 25 Після того, як катетер вийшов за межі стриктури, для розмежування стриктури вводять розчинну у воді контрастну речовину. Потім система доставки стента просувається по жорсткій направляючій проводці, і стент розгортається під флюороскопічним керівництвом.
Дуже щільні стенози можна попередньо розширити за допомогою 10-міліметрового балона, щоб полегшити проходження системи доставки стента. 6, 12, 26 Стент повинен бути на 2-4 см довший за стриктуру, щоб зменшити ризик переростання пухлини. 3, 27 У пацієнтів з технічною неспроможністю узгодити напрямний провід, хоча стриктура під флюороскопічним керівництвом, направляючий провід може узгоджуватись через стриктуру під комбінованим ендоскопічним та флюороскопічним керівництвом під час того самого засідання. У пацієнтів зі стриктурами довжиною більше 10 см можна встановити два або три стента в режимі стента всередині стента, щоб досягти повного охоплення стриктури. 6 Після встановлення стента розширення балонів зазвичай не потрібно, оскільки більшість саморозширювальних стентів поступово розширюватимуться і досягатимуть свого повного діаметра. Однак стенти, які розширюються менше половини діаметра стриктури, можуть бути розширені. 6, 12
Пацієнтам рекомендується відновити пероральний прийом рідини протягом 24 годин після встановлення стента та перейти до нормальної дієти, як тільки вони зможуть її переносити. 12 Пацієнтів піддають дослідженню барію через один день після встановлення стента, щоб перевірити положення та прохідність стента. Пацієнтам забороняється м’яка або тверда дієта, поки спостереження не покаже повного розширення стента. 12 Пацієнтам рекомендується добре пережовувати їжу та уникати їжі з високим вмістом клітковини, щоб зменшити ризик болюсної закупорки. 27
ТЕХНІЧНО-КЛІНІЧНИЙ УСПІХ
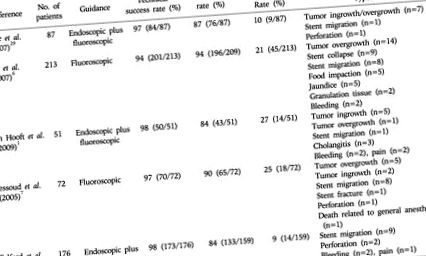
Технічний успіх визначається як успішне розміщення та розгортання стента по всій стриктурі. 28 Клінічний успіх визначається як полегшення симптомів та/або поліпшення прийому всередину, 28 позбавлення від необхідності паліативної хірургії. 15 Систематичний огляд 32 публікацій 28, що описують в цілому 606 пацієнтів із злоякісним ГОО, яким проводили стентування під металом під флюороскопічним або ендоскопічним керівництвом, показав, що рівень технічного та клінічного успіху становив 97% та 89% відповідно. Результати великих або багатоцентрових досліджень показали подібні показники успішності ендоскопічного та флюороскопічного встановлення стентів (табл. 1). 1, 6, 7, 29, 30
Таблиця 1
Розширювані металеві стенти при злоякісній непрохідності шлунку
Ускладнена анатомія, важкий стеноз або гострий кут нахилу кишкової петлі можуть призвести до технічного збою. 27 Показники технічного успіху залежать від місця ураження. 6 Наприклад, розміщення стента на місці дуоденальної обструкції технічно складніше, ніж у перипілоричній області, не тільки через формування петлі системи доставки стента в розтягнутий шлунок, але і через вигнуту конфігурацію дуоденального C- петля. 6, 31 Через анатомічні труднощі після операції, стриктура в місці анастомозу (особливо на місці гастроеюностомії) є найскладнішим для встановлення стента. 6, 32 Після встановлення стента у деяких пацієнтів можуть не спостерігатися покращення симптомів через нерозпізнані дистальні стриктури тонкої кишки, 6, 7, 12 відсутність пропульсивної перистальтики у хронічно закупореному шлунку, 7 або функціональна обструкція шлункового відділу через нервову участь в пухлина. 33
ПАТЕНЦІЯ СТАНДАРТІВ
Повідомляється, що середня прохідність стента коливається від 146 до 385 днів, 1, 2, 6, 9, 20, 32, а металеві стенти демонструють адекватну роздільну здатність ГОО у більшості пацієнтів до смерті. Повідомляється, що середня прохідність стента 1, 2, 6, 9 була однаковою у пацієнтів із раком шлунка (350 днів) та підшлунковою залозою (385 днів). 2 Вростання/переростання пухлини та міграція стентів розглядаються як основні причини втрати прохідності непокритих або покритих стентів. 2, 6 Хіміотерапія після встановлення стента, яка зменшує навантаження на пухлину, зменшуючи, таким чином, ймовірність вростання та переростання пухлини, була пов’язана зі збільшенням тривалості прохідності стента. 6, 30 Крім того, хіміотерапія може запобігти або затримати прогресування захворювання, тим самим продовжуючи виживання пацієнта. 6
УСКЛАДНЕННЯ
1. Обструкція стента
Обструкція є найпоширенішим ускладненням 1, 6, 28 (12-17%), яке спостерігається після встановлення стента і може бути спричинене харчовим матеріалом, вростанням чи надмірним зростанням пухлини (рис. 1) або колапсом стента. Вражена їжа може бути успішно видалена ендоскопічно, 6 тоді як вростання або заростання пухлини або колапс стенту можна успішно лікувати шляхом коаксіального розміщення іншого стента (рис. 1). 27, 34
48-річний чоловік із періодичною обструкцією, спричиненою дистальним розростанням пухлини. (А) Рентгенограма, зроблена через 2 місяці після встановлення стента, що показує надмірне зростання пухлини (стрілка) в дистальній ділянці стента. (B) Управління цим ускладненням шляхом розміщення другого стента (стрілки), який перекривав початковий стент.
2. Міграція стентів
Швидкість міграції вища для покритих (21-26%) 16, 35, ніж для непокритих (0-11%) стентів. 21, 36, 37 Міграція стента пов’язана з хіміотерапією після встановлення стента (рис. 2), але не з дилатацією балонів до або після встановлення стента. 6 Міграцією стента можна керувати, вставляючи інший стент. 6, 27, 28 Перенесений стент може вийти через пряму кишку або потрапити в кишечник і призвести до непрохідності, що вимагає хірургічного втручання. 6, 27, 28
57-річний чоловік із повною міграцією стента вниз. (А) Рентгенограма, зроблена відразу після встановлення стента, показує правильне розміщення стента. (B) Рентгенограма, зроблена через 24 дні після встановлення стента, показує повну міграцію стента вниз (стрілка). Цей пацієнт отримував хіміотерапію після встановлення стента.
3. Обструкція жовчних шляхів
Встановлено, що швидкість обструкції жовчовивідних шляхів після встановлення гастродуоденального стента коливається від 1,3% до 6% (рис. 3). 6, 28, 30 Взаємозв'язок між встановленням стента, що перекриває ампулу Ватера, та обструкцією жовчних шляхів незрозумілий. Деякі дослідники припускають, що ризики такої біліарної обструкції можуть обмежити використання критих стентів у пацієнтів з дуоденальною непрохідністю, 38 припускаючи використання непокритих стентів або обов’язкову жовчну декомпресію перед розміщенням критого стента у другій частині дванадцятипалої кишки . 35 На відміну від цього, інші дослідники виявили, що швидкість обструкції жовчних шляхів після встановлення покритого стента була не такою високою, як очікувалось, оскільки наближення покривної мембрани стента до стінки дванадцятипалої кишки не завершено навіть тоді, коли стент повністю розширений, що дозволяє жовч стікати через простір між покривною мембраною стента та стінкою дванадцятипалої кишки. 12, 31, 39
77-річний чоловік із жовчною непрохідністю через 1 день після встановлення стента. (A) Осьове комп’ютерно-томографічне зображення, зроблене через 1 день після встановлення стента, що показує розширення жовчної протоки (стрілки). (B) Зображення корональної комп’ютерної томографії, що показує зіткнення стентів дванадцятипалої кишки (стрілка) та жовчних шляхів (стрілка).
4. Перфорація
Перфорація - це ускладнення, що загрожує життю, і вимагає термінового хірургічного лікування. Однак перфорація трапляється дуже рідко, зустрічається менш ніж у 1% пацієнтів. 6, 28 Перфорація зазвичай спричинена ерозією оголених кінців стента через стінку кишечника. Хоча і не ясно, але може існувати взаємозв'язок між перфорацією та променевою терапією після стентування на злоякісний ГОО. 40
5. Кровотеча
Кровотеча після встановлення стента - ще одне рідкісне ускладнення, яке зустрічається менш ніж у 1% пацієнтів. 6, 28 Незважаючи на те, що кровотечами зазвичай можна керувати лише за допомогою консервативного лікування, значні кровотечі можуть вимагати емболізації судин. 15
6. Біль
Біль у животі триває протягом 24-72 годин після встановлення стента і зазвичай зникає спонтанно. 19 Постійний біль можна вилікувати за допомогою анальгетиків. 12, 28, 41
ЯКІСТЬ ЖИТТЯ
У кількох дослідженнях із використанням шкали Карнофскі спостерігалося збільшення показників Карнофського після встановлення стента. 42 - 45, однак, шкала Карнофського охоплює лише один аспект якості життя (фізична функція) і в даний час вважається неадекватною для оцінки загальної якості життя. 8 Одне рандомізоване дослідження з використанням оцінок фізичного здоров’я SF-36, чутливого показника якості життя, 46 показало, що ці показники були значно вищими через 1 місяць після встановлення стента, ніж після лапароскопічного шунтування при паліативному лікуванні злоякісного ГОО. 46 Однак це дослідження включало невелику кількість пацієнтів (10 на групу). Інше дослідження показало, що показник діяльності Всесвітньої організації охорони здоров’я покращився, тоді як глобальна якість життя ні, після встановлення стента у 51 пацієнта зі злоякісним ГОО. 1 Ця невідповідність свідчить про те, що паліативне лікування пацієнтів із злоякісним ГОО не повинно зосереджуватись лише на прийомі їжі, а на інших факторах, які можуть знизити якість життя, включаючи біль, погіршення фізичного стану та психічну підтримку. 1
ПОКРИТИЙ ВІД ПРОТИХ СТАНІВ
Оскільки як критий, так і голий стент мають переваги та недоліки, незрозуміло, що краще при паліативному лікуванні злоякісного ГОО. Два останніх дослідження порівнювали клінічні результати покритих та голих стентів при паліативному лікуванні злоякісних ГОО. 40, 47 Проспективне нерандомізоване дослідження 47 виявило, що показники технічного та клінічного успіху були однаковими у пацієнтів, які отримували стенти з покритим (n = 70) та голим металом (n = 84). Міграція стентів була значно частішою у охоплених, ніж у групі голих стентів (17,1% проти 0%; p 47 У другому дослідженні ретроспективна конструкція, 40 технічних/клінічних показників успіху, час прохідності стента та період виживання пацієнтів не мали відрізняються між покритою (n = 29) та голою (n = 32) групами стентів. Більше того, частота ускладнень (включаючи реконструкцію, міграцію, кровотечу та перелом стента) суттєво не відрізнялася між цими двома групами., були пов’язані з більш частою потребою у повторному втручанні. 40 Різниця в результатах дослідження могла бути пов’язана з різницею у демографічних показниках пацієнтів, типі стента та/або періоді виживання пацієнта. 40, 47 Для пошуку потрібне велике, перспективне, рандомізоване дослідження ідеальний стент для пацієнтів зі злоякісним ГОО. 40, 47
- Злоякісна трансформація шлункового гіперпластичного поліпа в контексті хелікобактер пілорі
- Вплив маси тіла на хірургічне лікування неврогенного синдрому торакального відділення -
- Опанування та боротьба з ожирінням - лікування; Хірургія Удеми
- Мастит - симптоми - лікування
- Посібник із отруєння свинцем Причини, симптоми та варіанти лікування