Злоякісна трансформація шлункового гіперпластичного поліпа в контексті хелікобактер пілорі-негативний аутоімунний гастрит: випадок захворювання
Анотація
Передумови
Шлункові фовеолярні гіперпластичні поліпи (GFHP) - загальні результати в клінічній практиці. GFHP зазвичай виникають на тлі хронічного атрофічного гастриту, включаючи аутоімунний гастрит (гастрит типу А), і мають потенційний ризик злоякісної трансформації.
Презентація справи
У 2005 році 55-річній японці було проведено верхню ендоскопію в іншій лікарні, і було встановлено, що він мав педикульований поліп (діаметром 10 мм) на більшій кривизні нижньої частини шлунка. Під час біопсії поліп діагностували як GFHP. Через дев'ять років поліп виріс до 20 мм у діаметрі, і зразки біопсії, взяті в цей час, показали трубчасту аденокарциному. При надходженні до нашої лікарні сироватка Хелікобактер пілорі (H. pylori) антитіло до імуноглобуліну G та стілець H. pylori антиген були негативними. Антитіла шлункових тім'яних клітин були позитивними, як і антитіло проти внутрішнього фактора, і рівень гастрину в сироватці крові натще був помітно підвищений. У 2014 році ендоскопічну підслизову дисекцію виконали за допомогою блокової резекції педикульованого поліпа. Остаточним гістологічним діагнозом була аденокарцинома шлунка з підслизовою та лімфатичною інвазією. Згодом була проведена додаткова радикальна дистальна резекція шлунка. На останньому спостереженні (12 місяців після операції) рецидивів не зафіксовано.
Висновки
Ми тут повідомляли про рідкісний випадок злоякісної трансформації GFHP, що виникає в контексті гастриту типу А. Наскільки нам відомо, в англійській літературі немає попередніх повідомлень про злоякісну трансформацію GFHP із підслизовою та лімфатичною інвазією, що виникає на тлі гастриту типу А. Крім того, в даний час для таких випадків не існує ефективного лікування, крім ендоскопічного або хірургічного. Враховуючи потенційний ризик злоякісної трансформації внаслідок гіпергастрінемії, ми вважаємо, що ендоскопічне лікування слід розглядати як терапію першої лінії при підозрі на злоякісне зростання.
Передумови
Презентація справи
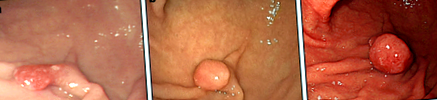
У листопаді 2005 року 55-річній японці було проведено верхню ендоскопію в іншій лікарні, і було встановлено, що він мав поліпед, діаметром 10 мм, на більшій кривизні нижньої частини шлунка (рис. 1а). Під час біопсії діагностували як GFHP. На момент першого діагнозу був лише ендоскопічний звіт, і ендоскопічний вигляд міг бути сумісним із атрофічною слизовою. У січні 2013 року була повторена верхня ендоскопія, яка виявила, що поліп виріс до діаметру 12 мм зі злегка закругленою головкою (рис. 1б). Тоді біопсія не проводилася.
Висновки ендоскопії. a. У 2005 році на більшій кривизні нижньої частини шлунка спостерігали гострий поліп діаметром приблизно 10 мм. Поверхня поліпа була злегка червонувата. Під час біопсії ураження діагностували як гіперпластичний фовеолярний поліп. b. У 2013 році гострий поліп на більшій кривизні нижньої частини шлунка виріс до 12 мм у діаметрі. Голова поліпа була більш округлою у порівнянні зі знімком, зробленим у 2005 році. c. У 2014 році гострий поліп на більшій кривизні нижньої частини шлунка виріс до 20 мм у діаметрі. Голова поліпа була злегка червонувата, більш округла і напружена
У червні 2014 року пацієнтці була проведена позитронно-емісійна томографія для оцінки лікувального ефекту від раку правої молочної залози, для якого вона перенесла операцію та отримала хіміо- та променеву терапію у віці 53 років. У нижній частині шлунка спостерігалось ненормальне накопичення (рис. 2). Подальша верхня ендоскопія показала, що поліп виріс до 20 мм у діаметрі, а поверхня голови була трохи червонуватою та напруженою (рис. 1в). Зразок біопсії, отриманий з голівки поліпа, був гістологічно діагностований як канальцева аденокарцинома і визначено не пов’язаним з раком молочної залози. Було припущено, що поліп став злоякісним протягом дев'яти років спостереження, і пацієнт був направлений до нашого закладу для подальшої оцінки та лікування.
Результати позитронно-емісійної томографії - комп’ютерна томографія. У нижній частині шлунка спостерігали добре обмежену масу, при цьому максимальне стандартизоване значення поглинання становило 2,7
Медичний огляд
Під час фізикального огляду були відзначені рубці від мастектомії правої молочної залози з двосторонньою дисекцією пахвових лімфатичних вузлів. Інших чудових знахідок не спостерігалося.
Лабораторні дані (Таблиця 1)
Не було виявлено відхилень у показниках крові або тестах функції печінки та нирок. Сироватка H. pylori антитіло до імуноглобуліну G та стілець H. pylori антиген були негативними. Антитіло шлункових тім'яних клітин було позитивним (збільшення у 80 разів), як і антитіло до антигенного фактора. Рівень гастрину в сироватці крові натще був помітно підвищений при> 3000 пг/мл (нормальний показник, рис. 3
Ендоскопічна підслизова дисекація. Ендоскопічну ендоскопічну підслизову дисекцію виконували для гострого поліпа діаметром 20 мм на більшій кривизні нижньої частини шлунка
Гістопатологічне дослідження показало пухлинні ураження, які мали чітко визначені межі з гіперпластичними залозами (рис. 4а, б). Ураження пухлини були сильно позитивними для p53 та Ki-67, тоді як гіперпластичні ураження - ні (рис. 4в). Підслизова інвазія спостерігалась у стеблі з глибиною інвазії 300 мкм (рис. 4г). У D2-40-позитивних та скупченні диференціації 34-негативних лімфатичних проток спостерігали клітини з ацидофільною цитоплазмою та великими ядрами. Клітини мали позитивний вплив на кератин, що свідчить про лімфоваскулярну інвазію (рис. 4д). В результаті остаточним гістологічним діагнозом була аденокарцинома шлунка, канальцева аденокарцинома> папілярна аденокарцинома, розмір резектованого вогнища розміром 20 мм, підслизова інвазія 0,3 мм, венозна інвазія (-), лімфатична інвазія (+).
Гістологічні знахідки. a. Фарбування гематоксиліном та еозином (ВІН). b. Зображення з великим збільшенням в зоні з коробочкою. c. ВІН, p53 та Ki-67, фарбування межі між гіперпластичними залозами та пухлинними залозами. Ураження пухлини були сильно позитивними щодо p53 та Ki-67. d. Підслизова інвазія в стеблі з глибиною інвазії 300 мкм (MM, muscularis mucosae; SM, підслизовий шар). e. ВІН, кластер диференціації 34 (CD34), D2-40 та кератинове фарбування. У CD34-негативних та D2-40-позитивних лімфатичних протоках спостерігали кератин-позитивні клітини з ацидофільною цитоплазмою та великими ядрами, що вказує на лімфатичну інвазію (стрілки)
Отже, була проведена додаткова радикальна дистальна резекція шлунка. Дослідження хірургічних зразків показало шрам, що виник внаслідок ендоскопічної підслизової дисекції на передній стінці шлункового тіла. Залишкових пухлинних клітин та метастазів у лімфатичні вузли не було. Дослідження фонової слизової показало, що належні шлункові залози в пілоричній ділянці збереглися, тоді як слизові шлункового тіла були атрофічними і показали метаплазію кишечника та псевдопілоричну метаплазію (рис. 5). У стадійній системі OLGA тіло та антральний відділ оцінювали як 2 та 0 відповідно, вказуючи на гастрит ІІ стадії на момент операції [10, 11]. Хромогранін Під час фарбування виявлена ентерохромаффіноподібна клітинна гіперплазія (лінійна гіперплазія та мікронодулярна гіперплазія) (рис. 5б, стрілки вказують на мікронодулярну гіперплазію). H. pylori інфекція була негативною (рис. 5).
Дослідження слизової фону. a. Належні шлункові залози в пілоричній області були збережені. Атрофічних змін не відбулося. b. Правильні шлункові залози в шлунковому тілі. Слизова була атрофічною і виявляла кишкову метаплазію та псевдопілоричну метаплазію. Muc6 - це секреторний муцин типу пілоричної залози шлунка. Ентерохромаффіноподібна клітинна гіперплазія (лінійна гіперплазія та мікровузлова гіперплазія (стрілки)) виявлено за допомогою фарбування хромограніном А.
Висновки
Зафіксована частота злоякісних трансформацій GFHP коливається від 0,6 до 4,5% [1–5], і Fujino et al. повідомили, що середній діаметр GFHP із злоякісною трансформацією становив 23,4 ± 10,2 мм [24]. Що стосується гістологічного типу, то більшість повідомлень, про які раніше повідомлялося, були диференційованими аденокарциномами, тоді як деякі з них були низькодиференційованими аденокарциномами або карциномами кільцевих клітин [25–28]. GFHP у цього пацієнта мав діаметр 20 мм і гістологічно діагностувався як диференційована аденокарцинома (рис. 4).
Діагностичні критерії злоякісного GFHP, запропоновані Nakamura et al. у 1985 р. наступні [29]: 1) співіснування доброякісної та злоякісної частин в одному поліпі; 2) наявність достатніх доказів того, що доброякісна ділянка раніше була доброякісним поліпом; та 3) наявність достатньої кількості клітинної та структурної атипії у злоякісній зоні для діагностики як рак. У цьому дослідженні пацієнт відповідав цим критеріям, і тому протягом дев’яти років діагностували злоякісну трансформацію GFHP. Повідомляється, що GFHP з карциномою мають такі макроскопічні характеристики: педикульована форма, більший розмір (> 20 мм), червонуватий колір, неправильна або вузлова поверхня, біле покриття та тенденція до кровотеч [2, 23, 25, 30, 31] . У нашого пацієнта виявилося чотири з цих макроскопічних ознак, включаючи гостру форму, діаметр> 20 мм, тенденцію до зростання та ураження білим покриттям.
Повідомлялося, що збільшувальна ендоскопія із вузькосмуговою візуалізацією корисна для діагностики раку [32–34]; однак він недостатньо корисний для діагностики злоякісної трансформації шлункових гіперпластичних поліпів [23]. Ан та ін. повідомляли, що GFHP діаметром 10 мм або більше повинні бути ендоскопічно резековані [35], тоді як Tanabe et al. повідомили про зникнення 20 мм гіперпластичного поліпа зі злоякісною трансформацією після H. pylori ерадикаційна терапія [36]. Ураження цього пацієнта було діагностовано як канальцева аденокарцинома під час біопсії. Ендоскопічна оцінка глибини інвазії карциноми була складною; отже, проводили ендоскопічну підслизову дисекцію - малоінвазивну процедуру. Результати показали глибину підслизової інвазії 0,3 мм та інвазію лімфатичних проток. Згодом ми провели додаткову дистальну резекцію шлунка та дисекцію лімфатичних вузлів. Віддалених метастазів не було, і ми вважали, що було досягнуто повного видалення пухлини. На момент складання цього звіту пацієнт спостерігався протягом 12 місяців після операції без рецидивів.
Наскільки нам відомо, є лише декілька попередніх випадків, обмежених Японією, злоякісного GFHP із підслизовою інвазією, що вимагає хірургічного лікування [37, 38], і попередніх повідомлень про злоякісну трансформацію GFHP з підслизовою інвазією та лімфатичною інвазією, що виникали в передумови гастриту типу А в англійській літературі. Таким чином, даний випадок вважається дуже рідкісним та забезпечує цінну інформацію. Важливо, що в даний час не існує ефективного лікування, крім ендоскопічного або хірургічного лікування ГФГП, вторинного по відношенню до гастриту типу А. Більше того, оскільки цей тип поліпа має потенційний ризик злоякісної трансформації внаслідок гіпергастрінемії, при підозрі на злоякісну трансформацію слід розглянути питання про ендоскопічне або хірургічне лікування.
- Helicobacter pylori (H
- Лікування злоякісних перешкод на виході із шлунка за допомогою саморозширюваних металевих стентів
- Helicobacter pylori Чи гастрит запобігає коліту FullText - запальні кишкові захворювання
- Навчання радіології - шлунку, шлунку, дивертикулу, тику, рентгенології, барію
- Мб; s Дієта для нарощування м’язів - LDN Muscle - Почніть свою трансформацію сьогодні