Лікування озоновим/киснево-пневмоперитонеумом призводить до повної ремісії плоскоклітинних карцином кроликів
Ветеринарні послуги та лабораторна медицина тварин, Університет Філіппа, Марбург, Німеччина
Кафедра отоларингології, хірургії голови та шиї, Університетська лікарня Гіссен та Марбург, Кампус Марбург, Марбург, Німеччина
Кафедра отоларингології, хірургії голови та шиї, Університетська лікарня Гіссен та Марбург, Кампус Марбург, Марбург, Німеччина
Відділ діагностичної рентгенології, Університетська лікарня Гіссен та Марбург, Кампус Марбург, Марбург, Німеччина
Кафедра гематології, онкології та імунології, Університетська лікарня Гіссен та Марбург, Кампус Марбург, Марбург, Німеччина
Кафедра отоларингології, хірургії голови та шиї, Університетська лікарня Гіссен та Марбург, Кампус Марбург, Марбург, Німеччина
Кафедра отоларингології, хірургії голови та шиї, Університетська лікарня Гіссен та Марбург, Кампус Марбург, Марбург, Німеччина
Кафедра молекулярної нейронауки, Інститут анатомії та клітинної біології, Університет Філіппа, Марбург, Німеччина
Кафедра молекулярної нейронауки, Інститут анатомії та клітинної біології, Університет Філіппа, Марбург, Німеччина
Департамент молекулярної нейронауки, Інститут анатомії та клітинної біології, Університет Філіпса, вулиця Роберта Коха 8, 35032 Марбург, Німеччина Шукати інші статті цього автора
Ветеринарні послуги та лабораторна медицина тварин, Університет Філіппа, Марбург, Німеччина
Кафедра отоларингології, хірургії голови та шиї, Університетська лікарня Гіссен та Марбург, Кампус Марбург, Марбург, Німеччина
Кафедра отоларингології, хірургії голови та шиї, Університетська лікарня Гіссен та Марбург, Кампус Марбург, Марбург, Німеччина
Відділ діагностичної рентгенології, Університетська лікарня Гіссен та Марбург, Кампус Марбург, Марбург, Німеччина
Кафедра гематології, онкології та імунології, Університетська лікарня Гіссен та Марбург, Кампус Марбург, Марбург, Німеччина
Кафедра отоларингології, хірургії голови та шиї, Університетська лікарня Гіссен та Марбург, Кампус Марбург, Марбург, Німеччина
Кафедра отоларингології, хірургії голови та шиї, Університетська лікарня Гіссен та Марбург, Кампус Марбург, Марбург, Німеччина
Кафедра молекулярної нейронауки, Інститут анатомії та клітинної біології, Університет Філіппа, Марбург, Німеччина
Кафедра молекулярної нейронауки, Інститут анатомії та клітинної біології, Університет Філіппа, Марбург, Німеччина
Департамент молекулярної нейронауки, Інститут анатомії та клітинної біології, Університет Філіппа, вулиця Роберта Коха 8, 35032 Марбург, Німеччина Шукати інші статті цього автора
Анотація
Плоскоклітинний рак голови та шиї (HNSCC) часто метастазує та демонструє високий рівень смертності у людей та тварин. Будучи прийнятою твариною моделлю для вивчення прогресування та метастатичного поширення HNSCC, у нашому дослідженні була застосована високоагресивна та летальна модель вушної карциноми VX2 новозеландського білого (NZW) кролика 1, 2. Ця модель пухлини виявилася надзвичайно придатною для дослідження нових терапевтичних підходів, оскільки і HNSCC, і карцинома VX2 подібні за ростом, що веде до раннього регіонарного лімфатичного вузла та подальшого віддаленого метастатичного поширення. 3-5
Як і для багатьох видів раку, клітини пухлини HNSCC якимось чином ухиляються від імунної системи організму. Цю імунну втечу частково можна пояснити часто спостерігається зниженням регуляції або втратою детермінант 6, 7 класу МНС класу I та збільшенням CD4 + CD25 + регуляторних Т-клітин (Treg), які виявляються відповідальними за депресивний протипухлинний імунітет. 8-10 Отже, можливість активувати імуноспостереження щодо пухлинних клітин HNSCC повинна допомогти у розпізнаванні та викоріненні цієї пухлинної сутності. Посилення здатності до імунологічного нагляду є новою концепцією в останніх імунотерапіях раку, 11-13, особливо тих, що зосереджуються на імуномодуляторах або регуляторах імунної відповіді. 14 Для посилення імунної відповіді хазяїна проти ракових клітин в даний час проводяться дослідження терапії рекомбінантними цитокінами, імунізації дендритних клітин та вакцинації проти пухлинних антигенів, а також імунотерапії на основі Т-клітин. 15-17
Озон, недавно виявлений ендогенним продукуванням гранулоцитів, 18 - це газ із комплексним впливом на біологію вільнорадикальних організмів людини та тварин. Більшість досліджень біологічного впливу озону зосереджувались на його токсичності для легенів через вдихання навколишнього озону. 20, 21 Тому застосування дихальних шляхів обмежене в природних умовах дослідження медичного озону при захворюваннях людини. Цікаво, що озон виявляв потужну захисну дію на індукований полімікробними препаратами летальний сепсис, не виявляючи токсичності для легенів при застосуванні у вигляді газової суміші O3/O2 в очеревину. 22 Крім того, докази каталізованого антитілами утворення озону при знищенні бактерій 23 свідчать про імунні опосередковані ефекти ендогенно продукованого або екзогенно застосованого озону. Ранній в пробірці Дослідження описували озон як радіоміметичний газ24, здатний вибірково пригнічувати ріст ізольованих альвеолярних, маткових, грудних та ендометріальних карцином людини. 25
Це привело нас до припущення, що внутрішньочеревне застосування медичної газової суміші O3/O2 стимулює власний протипухлинний імуноспостереження організму.
Матеріал і методи
Тварини
У дослідженні взяли участь 59 здорових дорослих кролів Іфафа Кредо NZW, які живуть у вазі від 2,0 до 3,0 кг, і були придбані у Charles River WIGA, Сульцфельд, Німеччина. Всіх тварин утримували у приміщеннях зі стандартизованим кондиціонером: при 20–22 ° C, вологості 50–60% та штучному денному/нічному ритмі протягом 12 годин. Кожного кролика містили в окремій сталевій клітці, годували 100 г повноцінних дієтичних гранул на день і мали вільний доступ до підкисленої (гідрохлоридна кислота, рН 2,7) водопровідної води ad libitum. Тварини могли акліматизуватися принаймні за 5 днів до початку експериментальної процедури.
Експериментальне проектування та трансплантація пухлини
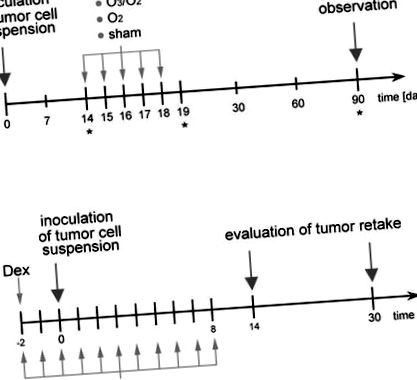
Зображено експериментальний дизайн цього дослідження для (a) схема лікування та (b) швидкість повторного захоплення після імунного придушення кроликів. * Часові точки забору крові
Пригнічення імунітету
Комп'ютерна томографія
Кроликам попередньо призначали 0,1 мл/кг маси тіла глікопіролату підшкірно та знеболювали комбінацією 5 мг/кг ксилазину та 30 мг/кг кетаміну шляхом внутрішньом’язової ін’єкції. Комп’ютерна томографія грудної клітки створена за допомогою Siemens Somatom Plus 4 (Siemens, Ерланген, Німеччина).
Параметри крові
Зразки артеріальної крові з центральної вушної артерії лівого вільного від пухлини вуха відбирали на 14-й день після щеплення (безпосередньо перед першою газовою інсуфляцією/підробленою обробкою) та на 19-й день після щеплення (24 години після останньої газової інсуфляції/підробленої обробки) . Додаткові проби крові були взяті у день 90 у тварин O3/O2-Рим (рис. 1a). Для гематологічних досліджень ми використовували автоаналізатор (Vet abc ™ Counter Animal Blood Counter, ABX Diagnostics, Геттінген, Німеччина), який був ретельно відрегульований та перевірений для аналізу крові кроликів. Для диференціальних показників крові визначали кількість еритроцитів разом із гематокритом (HCT) та гемоглобіном (HGB). Білі кров’яні клітини далі диференціювали на гранулоцити, лімфоцити та моноцити. Дані були виражені як середні значення ± SEM. Для клінічних хімічних досліджень вимірювали значення креатиніну, GOT та GPT за допомогою системи Reflovet® Plus (Roche Diagnostics, Мангейм, Німеччина) для моніторингу функцій нирок та печінки.
Статистика
Для порівняння показників виживання 3 експериментальних груп було проведено тестування логарифмічного рангу з урахуванням стор
Результати
Діаграми Каплана – Мейєра, що показують ймовірність виживання (a) та час до ймовірності очищення пухлини [TTC, (b)] кроликів (n = 41), які розвинули тверду вушну пухлину VX2 на 14 день після щеплення пухлини VX2. (a) Імовірність виживання кроликів, які отримували лікування O3/O2, була вищою, ніж кролики, оброблені штучностор = 0,0006), але суттєво не відрізнялася від такої в групі, обробленій O2 (стор = 0,0559), розрахований за допомогою тесту рангового журналу. Імовірність виживання кроликів, оброблених O2, суттєво не відрізнялася від вірогідності кролів, оброблених штучно (стор = 0,2448). (b) Імовірність TTC суттєво варіювала між обробленими O3/O2 та підробленими кроликами (стор = 0,0243), але не між кроликами, обробленими O3/O2- та O2 (стор = 0,0665). Крім того, не було значної різниці у ймовірності TTC між групами O2 та фіктивними (стор = 0,5781). Статистично значущі зміни були позначені стор
На малюнку 3 представлена репрезентативна послідовність різних стадій пухлини, що демонструє первинну регресію пухлини вушної пухлини після лікування O3/O2 до повної ремісії (рис. 3a) або прогресування пухлини до кінцевої стадії, яка характеризується сильним виразкою та масивною кровотечею незадовго до смерті (рис. 3b).
Ріст і розвиток клітин пухлини VX2 у правому вусі кролів NZW після щеплення. Панель (a) показує репрезентативні макроскопічні види твердої вушної пухлини VX2 у правому вусі кролика на 14-й день після щеплення пухлинних клітин та різні стадії ремісії після терапії O3/O2 (O3/O2-пневмоперитонеум). Спонтанна ремісія пухлини, що спостерігалась у одного підробленого кролика, та 2 ремісії після інсуфляції газом O2 були подібними (макроскопічні види не показані). Зверніть увагу, що на 90 день, кінцеву точку нашого періоду спостереження, залишився лише невеликий рубець від ремітованої вушної пухлини. На відміну від цього, у кроликів, які піддалися прогресуванню пухлини, вушна пухлина продовжувала зростати, що призвело до важких виразок, пов’язаних з масивною кровотечею та початком місцевих інфекцій, що вводили кінцеву стадію цього пухлинного захворювання (b, показані репрезентативні стадії того самого кролика). Зображуються стадії пухлини на 14, 27, 35 дні та в кінці періоду спостереження (90 днів або 42 дні у разі смерті).
Щоб проаналізувати, чи призводить лікування до регресу та/або профілактики віддалених метастазів у легені в грудній клітці, що характерно для запущеного захворювання пухлини VX2 у кроликів, 4, 29, ми просканували всю грудну клітку тварин з регресом первинної пухлини на наявність метастазів за допомогою комп’ютерної томографії (КТ). У всіх 3 експериментальних групах метастази в легенях відсутні у кроликів з ремісією первинної вушної пухлини (рис. 4a). На відміну від кроликів з ремісією пухлини, у всіх тварин із персистуючими вушними пухлинами на 90-й день регулярно спостерігалися численні метастази в легенях (рис. 4b).
Виниклі віддалені метастази в легені пухлини VX2. КТ грудної клітки, що не виявляє метастазів у легенях у кролика групи O3/O2-rem (a) в кінці періоду спостереження, але виявляє величезні метастази в легені кролика на 32 день (b, зірочка), яка згодом піддалася пухлині VX2. (зображені репрезентативні КТ легенів, що складають вену пульмоналіс). Нижні зображення показують макроскопічні види цілих легенів здорового кролика (c) та тварини з множинними метастазами легенів, похідними VX2, у плевральну вісцераліс (d).
Спостереження за тим, що реімплантовані пухлинні клітини VX2 були відхилені у кроликів з ремісією пухлини після перилезійної обробки IL-2 30, спонукало нас перевірити, чи не вдасться реімплантація клітин карциноми VX2 також у кроликів з ремісією пухлини після обробки O3/O2. Щоб перевірити це, ми розділили 6 тварин O3/O2-rem з цього експерименту на 2 групи. Кожна тварина отримала двовушкульну ін'єкцію суспензії пухлинних клітин VX2 для збільшення кількості можливих пухлин. Одна група була пригнічена імунітетом Dex та CSA (n = 3), інша група була підроблена, як описано раніше (n = 3). Як і очікувалось, усіх штучно оброблених тварин було захищено для повторного зараження пухлинами VX2, оскільки за період спостереження протягом 90 днів жодна вушна пухлина не розвинулася (Таблиця I). Навпаки, у пригнічених імунітетом тварин у 4 з 6 реінокуляцій пухлинних клітин виникали пухлини (Таблиця I). Зростання та розмір пухлини у цих тварин не виявляв ніякої різниці до вушних пухлин, попередньо виміряних у імунокомпетентних кроликів підставної групи.
- Бі-аурикулярна реімплантація пухлинних клітин VX2 у кроликів з повною регресією пухлини (O3/O2-rem) та подальшим лікуванням (O3/O2-rem + Dex/CSA) або без (O3/O2-rem + sham) дексаметазону та циклоспорину A. Швидкість вилучення пухлин, виміряних у 2 кроликів, служила базовим контролем: 1 кролик (контроль + Dex/CSA) вперше отримав суспензію пухлини та додатково пригнічений імунітетом, тоді як другий кролик (контроль + підробка) не пригнічений імунітетом.
- 1 Через двовукову трансплантацію суспензії клітин VX2 можливі 2 пухлини на тварину.
- 2 Середнє значення менше 200 мм 3 являє собою базальний набряк, який виникає після імплантації суспензії пухлинних клітин VX2. Тому обсяги менше 200 мм 3 вважаються негативними щодо пухлини VX2.
Щоб перевірити, чи має терапія O3/O2 якісь несприятливі ефекти, ми вимірювали внутрішньочеревний тиск (IAP) під час процесу інсуфляції та аналізували розвиток ваги та деякі основні параметри крові, які часто служать показниками несприятливих ефектів за загальними критеріями токсичності. 28 Вимірювання IAP у наших кроликів не виявило жодного тиску вище 5 мбар. Аналіз маси тіла виявив максимальне падіння приблизно на 8,1% (стор
(a) Курс середньої маси тіла від 0-го дня (при якому інокулювали суспензію клітин VX2) до 42-го дня. На 0-й день початкову масу тіла кожного кролика встановили на рівні 100%; зміни виражались у відсотках до початкової маси тіла. Період терапевтичної інсуфляції газової суміші O3/O2 позначений сірою рамкою. Зміни маси тіла в експериментальній групі обчислювались за кожен день за Студентською т тест. Значну втрату маси тіла було виявлено у групі, яка лікувалась O3/O2 (*стор # стор 31 Зразки артеріальної крові відбирали на день 14 після постинокуляції (безпосередньо перед першою інсуфляцією O3/O2, інсуфляцією O2 або обробкою) та на день 19 після інокуляції (через 24 години після останньої газової інсуфляції або фіктивної обробки). Для розгляду можливих довготривалих наслідків O3/O2-пневмоперитонеуму параметри крові всіх тварин O3/O2-Rem також були виміряні на 90-й день, що являє собою кінець періоду спостереження. Статистичні відмінності між 14-м та 19-м днями в кожній експериментальній групі обчислювались за допомогою парних студентових т тест і статистично значущі зміни були позначені стор
Вимірювання показників крові на день 19 (через 24 години після останньої інсуфляції газом O3/O2 або підробленої обробки) показало незначне збільшення кількості лейкоцитів (рис. 5b). Інші значення, такі як кількість еритроцитів, HGB, HCT, GOT та GPT, залишались у фізіологічному діапазоні (рис. 5b).
Обговорення
Розвиток толерантності до реімплантації пухлин VX2 вказує на залучення імунної системи до кліренсу пухлини, особливо адаптивної імунної системи. Це припущення також підтверджується спостереженням, що перилезійна ін'єкція IL-2 призвела до регресії вушних пухлин VX2 у кроликів, хоча з нижчою ефективністю (25,0%) 30, ніж у групі пневмоперитонеуму O3/O2 - (42,9%). Втрата толерантності до реімплантації пухлин VX2 після пригнічення імунітету додатково вказує на те, що імунонагляд є ключовим фактором у викоріненні клітин пухлини VX2.
Оскільки пневмоперитонеум O3/O2 - це новий терапевтичний підхід, дуже важливо аналізувати можливі несприятливі побічні ефекти. Гострі побічні ефекти, обумовлені високим рівнем IAP, які можуть виникнути в період інсуфляції, малоймовірні, оскільки виміряний піковий тиск був нижче 5 мбар, класифікований як низький IAP в лапароскопічній хірургії. 43 Невелике та тимчасове зменшення маси тіла під час терапії та незабаром після неї може спричинити легкий побічний ефект (втрата ваги 5–10%, І ступінь), порівнянний із тим, що спостерігався у мишей (втрата ваги до 14%, ІІ ступінь) що вдихав озон. 44 Оскільки серйозних побічних ефектів, таких як стійке зниження маси тіла та газова емболія, гарячка, діарея чи перитоніт, не спостерігалося, виявляється, що терапія O3/O2 є відносно безпечною. Пізні побічні ефекти лікування пневмоперитонеуму O3/O2 - досить малоймовірні, оскільки у 2 кроликів у попередньому пілотному дослідженні клінічні ознаки не спостерігались після більш ніж 5 років ремісії пухлини (не показано).
У сукупності інсуфляція медичної суміші газів O3/O2 у порожнину очеревини видається дуже перспективним новим засобом для лікування раку. Точні механізми, що лежать в основі запропонованого посилення пневмоперитонеуму O3/O2 в імунологічному нагляді, досі невідомі. Очевидно, що потрібна додаткова робота для з’ясування основних біохімічних, фізіологічних та імунологічних механізмів, що лежать в основі протипухлинного та антиметастатичного ефекту пневмоперитонеуму O3/O2 на пухлини VX2. Безумовно, ефективність цього нового терапевтичного підходу - включаючи можливі, поки невідомі побічні ефекти - повинна бути доведена на інших моделях пухлинних тварин різних типів пухлини перед тим, як врешті-решт увійти в клінічні випробування на людях.
- Дворічні результати періодичної електростимуляції лікування нижнього стравохідного сфінктера
- Актуальний кофеїн для лікування шкіри IAPAM
- Чому ви перестали бачити результати схуднення від бігу (і що з цим робити)
- 25 найкращих результатів зниження ваги натще Reddit збільшує споживання жиру для схуднення Дженніфер
- 25 найкращих засобів для схуднення доктора Сент-Піта - швидке заміщення їжі для схуднення надзвичайно важко