Лікування геністеїном покращує стійкість до переломів у мишей з діабетом, що страждають ожирінням
Анотація
Передумови
Ожирілі, діабетики другого типу мають підвищений ризик перелому кісток кінцівок у порівнянні із загальною популяцією. Показано, що фітоестрогени, такі як соєвий ізофлавон-геністеїн, захищають від втрати кісткової маси. У цьому дослідженні ми протестували ефекти лікування геністеїном на стегнах об/об мишей, модель для ожиріння та цукрового діабету другого типу.
Методи
Двадцять шість тижневих самок мишей були розділені на групи з ожирінням (ob/ob), групи, які отримували ожиріння геністеїном, нежирний (ob/+) контроль, і групи, які отримували нежирний геністеїн (n = По 5). Лікування геністеїном складалося з дієти 600 мг геністеїну на кг. Контрольним мишам давали стандартну чау гризунів. Наприкінці чотиритижневого періоду лікування серед груп порівнювали гістоморфометричні та триточкові властивості згинання кісток.
Результати
Повні миші мали більші площі кісток (B.Ar .; P 0,05) проксимального епіфізу стегнової кістки порівняно з худими мишами. Лікування геністеїном зменшило Tt.Ar. і довжина стегнової кістки, а також збільшена гранична сила, необхідна для перелому стегнової кістки і максимальної деформації до руйнування (P
Передумови
Цукровий діабет є широко розповсюдженим захворюванням, яким страждає приблизно 8,5% населення Сполучених Штатів. Він часто має різноманітні ускладнення, включаючи гіпертонію, дисліпідемію, інфаркт міокарда, інсульт та ниркову недостатність [1]. Ожиріння є фактором ризику розвитку цукрового діабету 2 типу (T2DM), що пов’язано з підвищеним ризиком переломів кісток кінцівок, які заживають довше і частіше призводять до інфекції та ускладнень [2–4]. Недавні дані свідчать про те, що T2DM знижує стійкість до згинальних навантажень через неефективний перерозподіл кісткової маси [5].
Лептин - гормон, який виділяється білою жировою тканиною, щоб допомогти регулювати ожиріння, викликаючи втрату ваги та гомеостаз кісток. Хоча одне лише ожиріння не пов'язане зі зменшенням кісткової маси [6], люди з ожирінням з T2DM часто виявляють стійкість до лептину, що, ймовірно, відіграє певну роль у збільшенні частоти переломів [7–10]. Миша ob/ob має дефіцит лептину через спонтанну мутацію гена ob. Ця модель ожиріння є близьким аналогом стану людини, що призводить до гіперфагії, ожиріння та діабетоподібного фенотипу, включаючи інсулінорезистентність, гіперглікемію та зменшення маси кісткової тканини кінцівок. Як модель на тваринах, миша ob/ob зазвичай використовується для вивчення фенотипу T2DM та резистентності до лептину, характерних для ожиріння та T2DM, особливо коли це пов'язано з метаболічним синдромом [11–15]. Хоча метаболічний синдром сам по собі не асоціюється з підвищеним ризиком переломів, він виявляється разом із T2DM [13, 16, 17].
Метою цього дослідження було оцінити ефекти лікування геністеїном на структуру кістки стегнової кістки та стійкість до переломів у жіночих мишей. Геністеїн - це фітоестроген, що міститься в сої та продуктах на основі сої. Він за своєю структурою схожий на естроген і може з великою спорідненістю зв’язуватися з рецепторами естрогену [18, 19]. Фітоестрогени, такі як геністеїн, можуть запобігати зменшенню втрати кісткової тканини подібним чином до замісної естрогенної терапії у жінок в постменопаузі, проте його повний ефект на моделі ожирілої діабетичної миші невідомий [19–24].
Методи
Експериментальний дизайн
В експерименті було використано двадцять самок мишей, що страждають ожирінням, об’ємних та об’ємних мишей (B6.V-Lep/J, лабораторія Джексона; Bar Harbor, ME, США) у віці шести тижнів. Мишей утримували в приміщенні для тварин з 12-годинним циклом світло/темрява і температурою 22 ° C. Мишам давали їжу та воду за бажанням. Ці дослідження на тваринах були схвалені Інституційним комітетом з догляду та використання тварин в Університеті Середнього Заходу та ретельно дотримувались Керівництва Національного інституту охорони здоров’я щодо догляду та використання лабораторних тварин.
На початку експерименту мишей розділили на чотири групи однакового розміру (n = 5), (1) нежирних мишей, які годували стандартним раціоном, (2) нежирних мишей, які годували дієтою геністеїну, (3) мишей, що страждали ожирінням, годували стандартною дієтою, та (4) мишей, що страждали ожирінням, годували дієтою геністеїну. Дієта геністеїну була розроблена компанією Dyets Inc. (Віфлеєм, Пенсільванія, США) і включала дієту 600 мг геністеїну/кг, введену протягом досліджуваного періоду 4 тижні. Ця дієта зазвичай використовується для вивчення впливу фітоестрогенів на стан T2DM на моделях мишей, порівнянна з дієтами на соєвій основі людини, і було показано, що вона має значні фізіологічні ефекти протягом чотирьох тижнів лікування [22, 25–28].
Гістоморфометрія стегнової кістки
Після жертвоприношення у кожної миші видаляли задні кінцівки. Праву та ліву стегнову кістку збирали та розтинали чистими м’якими тканинами. По одній стегновій кістці від кожної миші відводили для тестування на три точки згинання. Інша стегнова кістка була використана для проведення гістоморфометричного аналізу проксимального епіфізу та діафізу. Ці стегнові кістки зневоднювали в 70 і 85% спирті з двома змінами тривалістю 24 години в кожній концентрації, очищали за допомогою Histoclear (National Diagnostics, Атланта, штат Джорджія, США) у двох 24-годинних промиваннях, інфільтрували смолою Osteo-Bed A і каталізували Osteo- Полімерна смола A (100 мл смоли остео-шару A, 1,40 г пероксиду бензоїлу) з двома змінами тривалістю 24 години, а потім вбудована в смолу (100 мл смоли Osteo-Bed A, 3,50 г перекису бензоїлу; Polysciences Inc., Warrington, PA, США). Шість мл розчину для вбудовування додавали у флакони, що містять стегнові кістки, які закупорювали та поміщали у бісерну ванну при 33,5 ° C на 48 год для полімеризації. Положення та орієнтація стегнових кісток у флаконах була стандартизована, щоб забезпечити послідовну орієнтацію під час секціонування.
Після затвердіння смоли один ділянку проксимального відділу стегнової кістки взяли в корональній площині, а інший - діафізу в поперечній площині, дистально до третього трохантера, за допомогою низькошвидкісної пилки (Isomet; Buehler, Lake Bluff, IL, USA ). Зрізи вирізали товщиною 200 мкм, полірували (MetaServ; Buehler, Lake Bluff, IL, США) і фарбували алізариновим червоним (Sigma-Aldrich, Co., Сент-Луїс, Міссурі, США). Потім зрізи знімали зі збільшенням 40 разів за допомогою мікроскопа Eclipse 55i (Nikon, Inc., Мелвілл, Нью-Йорк, США). ImageJ v1.6 (NIH) використовували для вимірювання загальної площі (Tt.Ar.), площі кістки (B.Ar.) та обсягу кістки (B.Ar./Tt.Ar.) Для кожного проксимального епіфізу на основі Алізарину Червоне забарвлення кісткової тканини. Плагін MomentMacroJ (M Warfel та S Serafin) для ImageJ був використаний для розрахунку площі кори (Ct.Ar), максимального та мінімального секундних моментів площі (IMAX та IMIN) та полярного моменту площі (J). Це вимірювання, засновані на теорії інженерної балки, яка наближає опір стиску, згинанню та крученню від геометрії поперечного перерізу.
Триточковий тест на згинання стегнової кістки
Одну стегнову кістку від кожного зразка піддавали триточковому випробуванню на згинання до відмови оцінити стійкість до руйнування. До завантаження довжину кожної стегнової кістки вимірювали з точністю до сотих міліметрів за допомогою цифрових супортів, а розташування середнього валу позначали олівцем. Зусилля було прикладено до середнього вала в передньо-задньому напрямку при 0,5 Н/с за допомогою наконечника із закругленим краєм (HP-5 з випробувальним стендом HSV; Handpi Instruments Co., Ltd, Китай). Стегнові кістки утримувались на двох опорах, які розташовувались у контакті з проксимальним і дистальним кінцями кістки. Відстань між опорами не було постійним, оскільки довжина стегнової кістки в нашому зразку сильно варіювалась, і вимірювання властивостей матеріалу кістки пропорційні відстані між опорами та діаметром кістки в площині розриву [29, 30]. Були записані дані про граничну силу, максимальне переміщення до відмови та час до відмови. Також було виміряно місце перелому, виражене у відсотках від загальної довжини стегнової кістки вздовж довгої осі.
Статистичний аналіз
Статистичний аналіз був проведений за допомогою програмного забезпечення SPSS 19 (IBM, США). Для виявлення суттєвих відмінностей між групами лікування застосовували двосторонній дисперсійний аналіз (ANOVA). Оскільки сила перелому кістки пропорційна довжині та діаметру кістки, двосторонній ANOVA повторювали з довжиною та діаметром стегнової кістки як коваріати [24]. Статистичне значення було встановлене P
Результати
Лікування геністеїном зменшило масу тіла
На початку експерименту та на момент жертви миші з ожирінням мали більшу масу тіла, ніж худі миші (P 0,05).
Лікування геністеїном зменшувало загальну площу проксимального епіфізу стегнової кістки, але не об’єм кістки
Ожирілі миші мали більші площі кісток (B.Ar.) та загальні площі (Tt.Ar.) проксимального відділу стегнової кістки, ніж худі миші (P 0,05, рис. 1). Лікування геністеїном зменшило загальну площу (P 0,05). Для цих гістоморфометричних змінних не виявлено взаємодії між генотипом та лікуванням (P > 0,05).
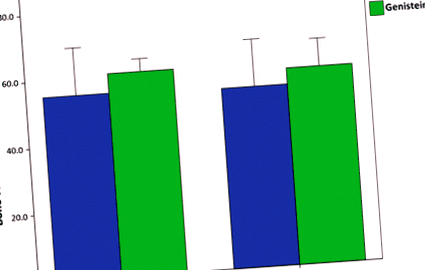
Порівняння співвідношення площі кістки до загальної площі (B.Ar./Tt.Ar.) Проксимального епіфізу стегна для худорлявих та ожирілих мишей, що харчуються стандартною чау гризунами або дієтою 600 мг геністеїну/кг. При двосторонньому дисперсійному аналізі не було виявлено ефекту генотипу (ob/+ проти ob/ob) або лікування (стандартна дієта проти геністеїну)P > 0,05). Смуги помилок становлять 2 ± SE
Лікування геністеїном не впливало на гістоморфометричні показники міцності кісток
Порівняння площі кори (Ct.Ar.), максимального та мінімального моментів інерції (IMAX, IMIN) та полярного моменту площі (J) між худими та ожирілими мишами не показали відмінностей (P > 0,05, таблиця 1). Порівняння цих змінних між мишами, яких годували стандартною дієтою, та тими, хто отримував геністеїн, також не показало відмінностей (P > 0,05). Жодної взаємодії лікування генотипом * не виявлено (P > 0,05).
Лікування геністеїном зменшило довжину стегнової кістки
Стегна худих мишей були значно довшими, ніж у мишей із ожирінням (P 0,05).
Порівняння довжини стегнової кістки для худорлявих і ожирілих мишей, яких годували стандартною чау-гризною їжею або дієтою 600 мг геністеїну/кг. Миші, які отримували дієту з геністеїном, мали значно коротші стегна (P 0,05). Смуги помилок становлять 2 ± SE
Лікування геністеїном збільшило кількість сили, необхідної для перелому стегнової кістки
Результати двостороннього аналізу ANOVA для триточкового випробування на згинання наведені в таблиці 2. Миші, оброблені геністеїном, мали стегнові кістки, які були більш стійкими до руйнування від згинальних навантажень на середньому валу. Кінцева сила була значно більшою у мишей, що годувались геністеїном, ніж у мишей, яких годували стандартною чау (P 0,05), вказуючи, що дієта на геністеїні впливає на стійкість до руйнування в обох генотипах однаково. Коли аналіз повторювали з довжиною стегнової кістки та середнім валом передньо-заднього діаметра як коваріати, основний ефект лікування залишався значним (F = 4,40; P Таблиця 2 Триточковий дисперсійний аналіз стегнового стегна
Порівняння граничних навантажень для худорлявих та ожирілих мишей, що харчуються стандартним чау-гризом або дієтою 600 мг геністеїну/кг. Лікування геністеїном суттєво збільшило граничну силу до відмови на середній вал стегна (P 0,05). Похибки складають 2 ± SE
Криві навантаження-переміщення, отримані з результатів випробувань на триточкові вигини. Тест проводили на стегнових кістках нежирних мишей, які годувались стандартною дієтою (Lean STD), нежирних мишей, які годували 600 мг генистеїну/кг дієти (Lean + GEN), ожирілих мишей, які харчувались стандартною дієтою (Obese STD), та ожирених мишей, яких годували 600 мг дієта геністеїн/кг (ожиріння + ГЕН)
Обговорення
Миші, що мають дефіцит лептину, мають ожиріння і демонструють клінічно значущий фенотип T2DM [9]. Лептин - гормон, який бере участь у регуляції обміну речовин і відіграє важливу роль у контролі надходження їжі, а також у розвитку кісток [7]. Отже, довжина кісток кінцівок мишей ob/ob зменшується на відміну від худих мишей [8, 23, 31]. Результати нашого експерименту узгоджувались із цими звітами, оскільки ми виявили, що у об/об мишей значно коротші стегна. Хоча точний механізм, який інгібує ріст кісток поздовжньої кінцівки, невідомий, було доведено, що геністеїн та інші фітоестрогени впливають на товщину, кальцифікацію та проліферацію хондроцитів пластинок росту кісток кінцівок, як було показано в попередніх дослідженнях [22, 23, 32, 33] . Ефекти лікування геністеїном на довжину кістки можуть бути обумовлені його інгібуючим впливом на хрящ пластини росту. Потрібні подальші розслідування для з’ясування механізму.
Висновки
Миші, які отримували дієту 600 мг геністеїну/кг, виявляють більшу стійкість до руйнування під час триточкових тестів на згинання в порівнянні з контрольними мишами, яких годували стандартною чау гризунами. Ці дані підтверджують гіпотезу, згідно з якою споживання фітоестрогену покращує стійкість кісток кісток до переломів не тільки у худих мишей, але і у мишей з ожирінням, які демонструють фенотип T2DM. Подальші дослідження повинні зосередитись на маркерах якості кісток, щоб визначити, як геністеїн впливає на ультраструктуру кісток та властивості матеріалу.
- Вправи покращують роботу мозку у людей із надмірною вагою та ожирінням - ScienceDaily
- Оцінка інсулінорезистентності у собак із надмірною вагою та ожирінням
- Ендокринні руйнівники - Гормональні ефекти токсинів - Мережа жіночого здоров’я
- Підготовка до спільної роботи Що робити до лікування
- Енергетичні витрати на опір посилюються