Кверцетин полегшує генералізовану гіпералгезію у мишей з індукованим аденоміозом
Джичан Ні
Кафедра гінекології, акушерства та гінекології лікарні Університету Фудана, Університет Фудань, Шанхай 200011, Китай
Сісі Лю
Кафедра гінекології, акушерства та гінекології лікарні Університету Фудана, Університет Фудань, Шанхай 200011, Китай
Анотація
Вступ
Аденоміоз - це поширений гінекологічний розлад, що характеризується гетеротопічними залозами ендометрія та стромою в міометрії. Він часто вражає жінок у віці 30–50 років (1) і часто викликає дисменорею, менорагію, метрорагію, дифузно збільшену матку та диспареунію, а також безпліддя (2,3). Проте точні механізми болю, викликаного аденоміозом, досі невідомі. Тому лікування аденоміозу є основною проблемою. В даний час хірургічна та медична терапія є загальним методом лікування аденоміозу. При важкому симптоматичному аденоміозі методом гістеректомії є спосіб лікування (4), який може бути травматичним для жінок, які бажають завагітніти. Отже, медичні методи лікування, такі як даназол та агоніст голідотропін-рилізинг-гормону, важливі для пацієнтів, які прагнуть завагітніти. Однак дані показали, що існує кілька обмежень цих методів лікування, включаючи тривалий період лікування, важкі побічні явища та часті рецидиви (5). Тому необхідні подальші дослідження щодо розробки більш ефективної медичної терапії.
Кверцетин (3,3 ′, 4 ′, 5,7-пентагідроксифлавон; молекулярна маса, 302 г/моль), біоактивний флавоноїд широко присутній у різних фруктах та овочах, включаючи цибулю, а найбільш вивченими первинними джерелами кверцетину є брокколі, яблука, ягідні культури та виноград, а також в деяких травах, чаї та вині (6,7). Нові докази продемонстрували, що кверцетин має потенційні переваги для лікування раку та ендометріозу без явних побічних ефектів, має антиканцерогенну, протизапальну, противірусну, антиоксидантну та психостимулюючу активність, а також здатність інгібувати перекисне окислення ліпідів., агрегацію тромбоцитів та проникність капілярів, а також для стимулювання біогенезу мітохондрій (8,9). Однак основний механізм кверцетину, що полегшує генералізовану гіпералгезію аденоміозу, залишається недостатньо вивченим. Тому необхідні добре розроблені випробування для оцінки впливу кверцетину на аденоміоз.
Завдання цього дослідження - оцінити вплив кверцетину на мишей з аденоміозом у контрольних регіонах відбиття (ICR). Вона мала на меті дослідити, чи покращує лікування кверцетином біль і придушує інфільтрацію міометрія ендометріальними імплантатами. Ми припустили, що кверцетин може зменшити гіпералгезію, а також придушити інфільтрацію міометрієм ектопічного ендометрію у мишей з індукованим аденоміозом. Для з'ясування молекулярного механізму лікування кверцетином, рівні деяких важливих медіаторів болю, включаючи транзиторний потенціал рецептора катіонного каналу підродини V член 1 (Trpv-1), фосфо (p) -p38 мітоген-активованої протеїнкінази (MAPK) та р-позаклітинну регульовану сигналом кіназу (ERK). Наше попереднє дослідження продемонструвало, що вальпроєва кислота (VPA), інгібітор гістондеацетилази, покращує генералізовану гіпералгезію та зменшує інфільтрацію міометрія (10). Тому VPA використовували як позитивний показник у цьому дослідженні.
Матеріали і методи
Хімікати
Кверцетин та VPA (натрієва сіль VPA, кат. № P4543) були придбані у Sigma-Aldrich (Merck KGaA, Дармштадт, Німеччина). Всі ці препарати розчиняли у 2% диметилсульфоксиді в 0,1 М Na2SO4, доведені до рН 5,0. Тамоксифен цитрат був придбаний у фармацевтичної компанії Fudan Forward (Шанхай, Китай).
Тварини та лікування
Новонароджених мишей ICR (1 день після народження; n = 43) та їх мишей, що народилися (n = 10) було придбано у Shanghai Laboratory Animal Corporation (Шанхай, Китай). Кожна миша-мати та її потомство були поміщені в одну клітку в контрольованих умовах (
20 ° C, цикл 12:12 світло/темно) і мав вільний доступ до їжі та прісної води.
Відповідно до протоколу Green et al (11) та Parrott et al (12), самкам новонароджених мишей перорально вводили 1 мг/кг тамоксифену, суспендованого в суміші арахісової олії/лецитину/згущеного молока (2: 0,2: 3, за обсягом) об'єм дози 5 мкл/г маси тіла з 2 по 5 день після народження. Жіночих контрольних мишей-новонароджених (n = 9), позначених випадковим чином, годували еквівалентною кількістю розчинника без тамоксифену. Коли мишам виповнилося 3 тижні, їх відлучали від грудей і відділяли від своїх матерів, а самки мишей продовжували в рамках дослідження.
Усі експерименти проводились згідно з керівництвом Керівництва Національної дослідницької ради з догляду та використання лабораторних тварин (13) та затверджено інституційною комісією з огляду експериментальних тварин Шанхайської лікарні акушерства та гінекології Університету Фудань (Шанхай, Китай).
Протокол експерименту
Неонатальним мишам дозували тамоксифен, як описано (n = 34), і 9 контрольним мишам дозували лише розчинник. Починаючи з 4 тижнів після народження, тест на конфорку вводили всім мишам кожні 4 тижні, також вимірювали і реєстрували масу їх тіла. Через 16 тижнів після народження всіх мишей, яким дозували тамоксифен, було випадковим чином розділено на 4 групи, кожна з яких отримувала певне лікування щоденним внутрішньошлунковим введенням протягом 3 тижнів наступним чином: Група L (n = 9) отримувала низькі дози (25 мг/кг маса тіла) лікування кверцетином; Група Н (n = 9) отримувала лікування кверцетином у високих дозах (50 мг/кг маси тіла); Група V (n = 8) отримувала лікування VPA (160 мг/кг маси тіла); Група U (n = 8) або необроблена група отримали лише транспортний засіб. Групу мишей (n = 9), яким неонатально вводили лише розчинник, позначали як групу С, не отримували жодної обробки і служили пустим контролем. Дози цих препаратів визначали на підставі наших попередніх досліджень та інших досліджень (10,14–18).
Після 3-тижневого лікування наркотиками було проведено остаточне тестування конфорки для всіх мишей з індукованим аденоміозом, а також була зареєстрована маса тіла. Всім мишам знеболювали і перфузували через висхідну аорту теплий (37 ° С) фізіологічний розчин, а потім теплий розчин, що складається з 4% параформальдегіду і 0,2% пікринової кислоти в 0,1 М фосфатному буфері. Потім після перфузії негайно слідував той самий фіксатор (4 ° C). Потім матки вирізали і фіксували на ніч при кімнатній температурі в тому ж фіксуючому розчині, потім вносили у парафін для гістопатологічного дослідження та імуногістохімічного аналізу. Ганглії дорсальних коренів L6 та S1 (DRGs) розсікали, і тканини після цього фіксували в тому ж фіксаторі на 90 хв при 4 ° C, а потім занурювали в 10% сахарозу в 0,1 М фосфатний буфер на ніч.
Глибину інфільтрації міометрієм ектопічного ендометрію оцінювали згідно з критеріями, описаними Bird et al (19). Коротко, 1 ступінь був визначений як випадок проникнення ектопічного ендометрію до поверхневого міометрія, 2 ступеня як проникнення до середини міометрія, а 3 ступеня як проникнення за межі середини міометрія. Для зручності статистичного аналізу зафіксовано глибину 0 ступеня при повній відсутності ектопічного ендометрію в міометрії.
Для гістологічного дослідження були отримані серійні 4-мм зрізи з кожного вкладеного в парафін блоку тканини, а потім обрані три випадково вибрані зрізи для фарбування гематоксиліном та еозином (H&E) для підтвердження патологічного діагнозу. Зрізи фарбували 0,6% гематоксиліном та 0,5% еозином протягом 5 хв при кімнатній температурі. Якщо спостерігалося зміщення залоз і строми ендометрія в міометрії, ставили діагноз аденоміоз.
Процедура випробування конфорки
Тест конфорки - це загальновживаний метод вимірювання ноцицепції у гризунів (20) та тест порогу реакції на термічні подразники, що представляє собою форму гострого теплового болю (21). У поточному дослідженні випробування конфорки проводили за допомогою вимірювача знеболення на гарячих пластинах (BME-480; Інститут біомедичної інженерії Китайської академії медичних наук, Тяньцзінь, Китай), що складається з металевої пластини розміром 25 × 25 см. Поверхня пластини може бути нагріта до постійної температури 55,0 ± 0,1 ° C, виміряна вбудованим цифровим термометром, а пластинковий циліндр (діаметром 20 см, висотою 18 см) розміщений на конфорці. Мишей доставляли в приміщення для випробувань і давали їм можливість акліматизуватися протягом 10 хв до випробування. Латентність реагування на термічні подразники, що визначається як час (у секундах), що минув з моменту, коли миша була введена всередину циліндра, до того моменту, коли вона лизнула задні лапи. Кожну мишу тестували лише один раз за один сеанс. Латентність розраховували як середнє значення двох показань, записаних з інтервалом у 24 години.
Імуногістохімія
Для всіх експериментальних груп зрізи товщиною 10 мкм нерухомих DR6 L6 та S1 вирізали послідовно в кріостаті та встановили на предметних предметних стеклах, покритих желатином. Слайди зберігали при -20 ° C до імунозабарвлення. Зрізи гасили 0,3% H2O2 протягом 10 хв, а потім блокували 0,3% Triton X-100 в 0,05 M Tris-NaCl 10% нормальної козячої сироватки (NGS) протягом 1 год при кімнатній температурі. Згодом зрізи інкубували з кролячим поліклональним анти-TRPV-1 (1: 5000; кат. No acc-030; Alomone Labs, Ltd., Єрусалим, Ізраїль), кролячим моноклональним анти-p-p38 MAPK (1:50; кат. No 4631; Cell Signaling Technology, Inc., Danvers, MA, USA), або моноклональний анти-ERK1/2 (1: 100; кат. No 4376; Cell Signaling Technology, Inc.) в 0,3% Triton X -100 в 0,05 M трис-NaCl, включаючи 1% NGS при 4 ° C протягом ночі. Згодом біотинільоване вторинне антитіло та реагент для виявлення універсального (проти кролика) (пероксидаза хрону) (1: 100; кат. № GK500705; Shanghai Gene Tech Company, Шанхай, Китай) інкубували при кімнатній температурі протягом 30 хв. Зв'язані комплекси антитіл фарбували протягом 3–5 хв або до відповідного для мікроскопічного дослідження 3,3′-діамінобензидином, а потім фарбували 0,6% гематоксиліном протягом 50 с при кімнатній температурі і встановлювали.
Кількісний аналіз проводився згідно з попередніми дослідженнями (22). Коротше кажучи, для кількісного аналізу використовували принаймні 5 зрізів з кожної ДСГ у кожен момент часу. В кінці експериментального періоду всіх мишей забивали. Поля були вибрані випадковим чином у кожних 3 секціях під світловим мікроскопом Olympus BX51 (Olympus Corporation, Токіо, Японія). Кількість імунозабарвлених нейронних профілів ділили на загальну кількість нейронних профілів і визначали відсоток мічених нейронних профілів. Для визначення відсотка міченого нейрона в підмножині нейронів DRG підраховували нейронні профілі з ясним ядром.
Статистичний аналіз
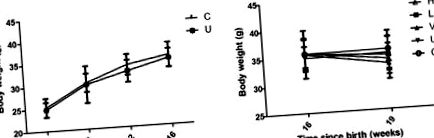
Для всіх аналізів використовувався комп'ютерний пакет SPSS18.0 для Windows (SPSS, Inc., Чикаго, Іллінойс, США). Для опису статистики використовуються засоби ± стандартні відхилення експериментів. Відмінності між парними групами перевіряли за допомогою t-критерію Стьюдента, а відмінності між різними обробленими групами аналізували за допомогою одностороннього дисперсійного аналізу, за яким проводився пост-hoc тест на найменшу значущу різницю для множинних порівнянь. P Рис. 1). Результати показали, що маса тіла мишей, яким дозували тамоксифен, виявилася нижчою, ніж маса контрольних мишей на 4, 8, 12 та 16 тижнях; однак статистично значущої різниці не виявлено (рис. 1А). Після лікування високою та низькою дозою кверцетину або VPA протягом 3 тижнів миші мали нижчу масу тіла порівняно з необробленою групою, але різниця була незначною (рис. 1B). Крім того, високі та низькі дози лікування кверцетином та VPA спричинили втрату маси тіла порівняно з контрольною групою, без суттєвої різниці (рис. 1B).
Середня маса тіла у різних груп мишей. (А) До лікування кверцетином або вальпроєвою кислотою на 16 тижні. (B) Після 3 тижнів лікування кверцетином (n = 9 мишей) або вальпроєвою кислотою (n = 8 мишей). Н, високі дози кверцетину (n = 9 мишей); L, низькі дози кверцетину (n = 9 мишей); V, вальпроєва кислота (n = 8 мишей); U, необроблений; С, контроль.
Вплив лікування кверцетином на інфільтрацію міометрія
Оцінювали вплив лікування кверцетином на інфільтрацію міометрію у мишей, індукованих аденоміозом. Як було показано на рис. 2 на графіках, порівняно з контрольними мишами, миші, яким дозували тамоксифен, мали значно більшу інфільтрацію (P рис. 3A-E, миші, яким дозували тамоксифен, значно зменшували латентність відповіді порівняно з контрольними мишами (P Fig. 3D та Е. Латентність відповіді мишей груп H, L та V продовжилася після лікування VPA та кверцетином на 19 тижні порівняно з мишами на 16 тижні (P Рис. 3F). У порівнянні з необробленими мишами латентність відповіді мишей, які отримували лікування високим або низьким кверцетином або VPA, демонструвала значно подовжену латентність реакції (P Рис. 3F).
Затримка відповіді конфорки в різних групах. Затримка відповіді конфорки через (A) 4 тижні (B) 8 тижнів, (C) 12 тижнів, (D) 16 тижнів та (E) наприкінці лікування. (F) Зміна затримки реакції конфорки до (тиждень 16)/після лікування у різних групах. Дані виражаються як середнє значення ± стандартне відхилення. * P Рис. 4 - 7. Порівняно з контрольною групою спостерігалося очевидне збільшення Trpv-1, p-p38 та p-ERK-позитивних клітин у нейронах L6 та S1 необробленої групи (P Рис. 4). У тварин, яким дозували або високі, або низькі дози кверцетину, або VPA, кількість Trpv-1, p-p38 та p-ERK-позитивних клітин була значно нижчою, ніж у необробленої групи (P Рис. 4). Не було значної різниці між групами, які отримували VPA/кверцетин, та контрольною групою. Імуногістохімічне фарбування продемонструвало, що рівні Trpv-1, p-p38 та p-ERK, присутні в нейронах DRG, були значно вищими у мишей, яким дозували тамоксифен, порівняно з контрольною групою (рис. 4 - 7). Високі та низькі дози кверцетину суттєво знижували експресію Trpv1, p-p38 та p-ERK порівняно з необробленою групою (; P Рис. 4 - 7). Високі дози кверцетину знижували рівні Trpv1, p-p38 та p-ERK порівняно з низькими дозами кверцетину, однак ця зміна не була статистично значущою.
Імуногістохімічна кількісна оцінка експресії Trpv-1, p-p38 та p-ERK в нейронах гангліозного дорсального кореня. ** P Long L, Chen J, Xiong Y, Zou M, Deng Y, Chen L, Wang Z. Ефективність високоінтенсивної сфокусованої ультразвукової абляції для терапії аденоміозу та якості сексуального життя. Int J Clin Exp Med. 2015 рік; 8: 11701–11707. [Безкоштовна стаття для PMC] [PubMed] [Google Scholar]
- P38SJ, новий білок DINGG, захищає клітини нейронів від травм та смерті, спричинених алкоголем
- Ресвератрол і кверцетин СУПЕРВИСНИЙ КОМБО З ВИСОКУ ЖИРИ! Форум природи з трав
- Дослідження на мишах показують, як харчові волокна зменшують шкідливий вплив дієти з високим вмістом жиру
- Водний екстракт Rosa rugosa полегшує витривалість вправи, що викликається фізичними вправами, Журнал лікарської їжі
- Короткочасне обмеження калорій покращує відновлення ДНК за рахунок негомологічних кінцевих з’єднань у мишей npj Старіння