p38SJ, новий білок DINGG захищає нейронні клітини від алкогольних травм та смерті
Шоре Аміні
1 Кафедра нейронауки, Центр нейровірусології, Медична школа Темплського університету, Філадельфія, Пенсільванія
2 Департамент біології, Коледж науки і техніки, Університет Темпла, Філадельфія, Пенсільванія
Нана Мерабова
1 Кафедра нейронауки, Центр нейровірусології, Медична школа Темплського університету, Філадельфія, Пенсільванія
Камель Халілі
1 Кафедра нейронауки, Центр нейровірусології, Медична школа Темплського університету, Філадельфія, Пенсільванія
Нуне Дарбініан
1 кафедра нейронауки, Центр нейровірусології, Медична школа Темплського університету, Філадельфія, Пенсільванія
Анотація
Етанол індукує пошкодження нейрональних клітин та смерть шляхом порушення регуляції кількох сигнальних подій, які частково контролюються активацією MAPK/ERK1/2 та/або інактивацією відповідної фосфатази, PP1. Нещодавно ми очистили новий білок розміром 38 кДа, p38SJ, від культури калюсу Hypericum perforatum, яка належить до нового сімейства білків DINGG з фосфатно-зв'язуючою активністю. Тут ми показуємо, що обробка нейрональних клітин p38SJ захищає клітини від пошкоджень, спричинених впливом етанолу. Крім того, попередня обробка нейрональних клітин p38SJ знижує рівень проапоптотичного білка Bax та деякі події, пов'язані з апоптозом, такі як розщеплення каспази 3. Крім того, викликаючи стрес, алкоголь може підвищити вироблення активних форм кисню (АФК), що призводить до зменшення активності супероксиддисмутази (СОД). Наші результати показали, що p38SJ відновлює активність СОД у нейрональних клітинах, оброблених етанолом. Ці спостереження забезпечують новий біологічний інструмент для розробки нових підходів для запобігання загибелі нейрональних клітин, спричинених етанолом, і, можливо, лікування неврологічних розладів, пов'язаних із зловживанням алкоголем.
ВСТУП
Зловживання алкоголем пов'язане з численними неврологічними та поведінковими дефіцитами, включаючи нейропатію та енцефалопатію, дегенерацію мозочка, когнітивні зміни та порушення судження та пам'яті (огляд див. Alderazi and Brett 2007; Brun and Andersson 2001; Brust 2008; Johnson et al., 1986 ). Етанол пошкоджує нервову систему та спричинює пошкодження нейрональних клітин, впливаючи на кілька шляхів передачі сигналу, включаючи MAPK (Sanna et al, 2002, Logrip 2008). Активація MAPK етанолом залежить від рецепторів. Серед рецепторів, на які впливає етанол, є рецептори ГАМК (Lee et al, 2007a, Ueno 2001). Було показано, що клітинні ефекти етанолу, що виникають за допомогою модуляції транскрипційних шляхів PKA та CREB, активуються через рецептори GABA (Criswell and Breese, 2005); підвищена експресія PKA та CREB спостерігалася після обробки етанолом (Pandey et al., 2001).
Більш ранні дослідження показали, що етанол може спричинити загибель нейрональних клітин через окислювальний стрес (Antonio et al., 2008; Haorah et al., 2008a; Heaton et al., 2002, 2003; Lee et al., 2007; Ramachandran et al., 2003; Watts et al., 2005). Недавні дослідження також показали підвищення рівня АФК у ЦНС алкоголіків, ймовірно, через метаболізм етанолу (Haorah et al., 2008a). Індукований алкоголем окислювальний стрес у мозку широко вивчався як новий шлях нейродегенерації, пов'язаний із зловживанням алкоголем (Haorah et al., 2008a та b). Багато добре розроблених досліджень вказують на важливість активації кіназ та інгібування фосфатаз при пошкодженні клітин, спричиненому індукованим етанолом окислювальним стресом у мозку (Haorah et al., 2005, 2007, 2008b; Lohmann 2004). Потенційні механізми, що ведуть до індукції окисного стресу та алкогольної індукції АФК, і, отже, до пошкодження нейронів, не повністю вивчені.
Нещодавно ми ідентифікували новий білок 38 кДа, p38SJ, із культури культивування калюсу Hypericum perforatum in vitro та клонували його часткову кДНК, p27SJ. p27SJ належить до сімейства білків DINGG, оскільки містить збережену послідовність DINGG на N-кінці (Darbinian et al., 2008; Perera et al., 2008). p27SJ проявляє здатність модулювати експресію вірусних і клітинних генів, включаючи ВІЛ-1, MCP-1 (Darbinian-Sarkissian et al., 2006; Mukerjee et al., 2008),
У людини пептид, що містить DINGG, був вперше виявлений у синовіальній рідині і виявлено, що він є частиною більш великого білка, відомого як стимулюючий білок синовіальних Т-клітин р205 (Blass et al, 1999; Hain et al, 1996). Подальші дослідження призвели до ідентифікації іншого члена сімейства DINGG людини з ефектами, що стимулюють ріст у нормальних та пухлинних клітинах (Adams et al, 2002; Belenky et al, 2003; Morales et al, 2006). На додаток до людської тканини, білки DINGG були виділені з різних грибів, тканин тварин і рослин і виявляють тісну гомологію з білками Pseudomonas (огляд див. Ahn et al, 2007; Berna et al, 2002, 2008; Chen et al, 2007; Lewis and Crowther, 2005; Moniot et al, 2007; Pantazaki et al, 2007; Riah et al, 2000; Scott and Wu, 2005).
Тут ми демонструємо, що лікування нейрональних клітин p38SJ захищає їх від апоптозу, викликаного етанолом.
МАТЕРІАЛИ І МЕТОДИ
Культура клітин
Кортові нейрони щурів розмножували після ферментативної та механічної обробки ембріональної тканини щурів Sprague Dawley на 17 день (E17) з використанням ферменту TrypleExpress (Invitrogen, Carlsbad, CA) при 37 ° C протягом 10 хв, після чого проводили три промивання середовищем Hibernate E. Після механічної обробки тканини полірованою вогнем скляною піпеткою Пастера суспензію одноклітин розбавляли живильним середовищем і клітини висівали на 60-міліметровий посуд з покриттям полі-D-лізину щільністю 2,5 × 10 6/пластину і культивували в 3 мл нейробазального середовища, що містить добавку B27, 0,25 мМ глутамаксу та 0,25 мМ L-глутаміну (все від Invitrogen). Клітини підтримували при 37 ° С у зволоженому інкубаторі, що містив 7% СО2.
Мікроскопія
Фазово-контрастні зображення нейрональних клітин візуалізували за допомогою інвертованого флуоресцентного мікроскопа Olympus за допомогою програмного забезпечення IPLAB. Контраст і яскравість регулювались однаково для всіх зображень за допомогою Adobe Photoshop версії 5.5.
Препарат рослинного екстракту
Сто міліграм висушеної H. perforatum розчиняли в 1 мл буфера для лізису, що містив 30 мМ Трис (рН 7,4), 167 мМ NaCl, 0,1% Нонідет Р-40 та коктейль інгібіторів протеази (Sigma, Сент-Луїс, Міссурі, США). Клітинний сміття видаляли центрифугуванням при 14000 об/хв протягом 5 хв при 4 ° С. Загальні розчинні білки з калюсу центрифугували при 10000 об/хв протягом 5 хв, і супернатант відновлювали і фракціонували через фільтри MilliPore Microcon 3, 30 і 50 кДа (Millipore, Billerica, MA, США), щоб відокремити білок 38 кДа від низькомолекулярного ваги білків та інших рослинних органічних компонентів. Чистоту білка 38 кДа визначали за допомогою SDS-PAGE.
Приготування білкових екстрактів та імуноблот-аналіз
Для приготування цільноклітинних білкових екстрактів, після обробки етанолом та/або p38SJ, клітини промивали холодним забуференним фосфатом сольовим розчином (PBS) і розчиняли в буфері для лізису, що містить 50 мМ Трис (рН 7,4), 150 мМ NaCl, 0,1% Нонідету Коктейль Р-40 та 1% інгібіторів протеази (Sigma, Сент-Луїс, Міссурі, США). Клітинний сміття видаляли центрифугуванням при 10000 об/хв протягом 5 хв при 4 ° С. П'ятдесят мікрограмів білка розчиняли в буфері зразків Леммлі і фракціонували за допомогою 10% електрофорезу додецилсульфату натрію та поліакриламідного гелю (SDS-PAGE). Для вестерн-блот-аналізу зразки білка розбирали за допомогою SDS-PAGE і після перенесення на мембрану реагували зі специфічними антитілами, а білки візуалізували за допомогою посиленої системи виявлення хемілюмінесценції ECL + відповідно до інструкцій виробника (GE Healthcare, Piscataway NJ) та піддавали впливу Рентгенівська плівка.
Аналіз каспази-GLO 3/7
Апоптоз визначали аналізом активації каспази-3 з використанням субстрату DEVD-амінолюциферину з набору для аналізу Caspase-Glo ™ 3/7 (Promega, Madison, WI, USA), згідно з інструкцією виробника. Люмінесценцію реєстрували на люмінометрі Turner Designs TD-20/20 Дані аналізували за допомогою програмного забезпечення Excel.
Аналіз метилтіазолететразолію (МТТ)
Для аналізу метилтіазолететразолію (МТТ) ми використовували набір для клітинної проліферації (МТТ) відповідно до протоколу виробника (Рош, Індіанаполіс, США). Клітини висівали на 96-лункові планшети у трьох примірниках у двох наборах при щільності 15000 клітин/лунку та попередньо інкубували з p38SJ (протягом 2 годин), потім ко-інкубували з етанолом. Через 24 години в лунки додавали 10 мкл МТТ (5 мг/мл) (кінцева концентрація, 0,5 мг/мл) протягом 4 год, і реакцію зупиняли додаванням 100 мкл солюбілізаційного розчину. Життєздатні клітини з активними мітохондріями розщеплюють тетразолієве кільце до видимого продукту реакції темно-синього формазану, який кількісно визначали за допомогою спектрофотометрії в мікропланшеті при 570 нм з контрольною довжиною хвилі 650 нм. Відносну життєздатність клітин (відсоток) визначали як відношення середньої поглинання для оброблених клітин до такої для оброблених, необроблених клітин.
Аналіз активності супероксиддисмутази (СОД)
Для вимірювання активності СОД у первинних нейронах, після обробки p38SJ протягом двох годин та етанолу, готували цитозольну фракцію та інкубували з розчином ксантиноксидази протягом 1 години при 37 ° C. Поглинання зчитували при 490 нм для утворення супероксидних аніонів. Активність СОД визначається як пригнічення відновлення хромагену. У присутності СОД концентрація супероксид-аніону знижується, що дає менший колориметричний сигнал. Активність СОД була показана у%.
Антитіла
Антитіла, специфічні для фосфо-p44/42 мітоген-активованої протеїнкінази (MAPK/Erk1/2), анти-p44/42 MAPK, кролячі поліклональні та анти-GRB2 кролячі поліклональні антитіла були придбані у Cell Signaling Technologies (Danvers, MA). Анти-каспаза-3 кролячі поліклональні та анти-Bax антитіла були отримані від Santa Cruz Biotechnology Inc. (Санта-Крус, Каліфорнія, США).
РЕЗУЛЬТАТИ І ОБГОВОРЕННЯ
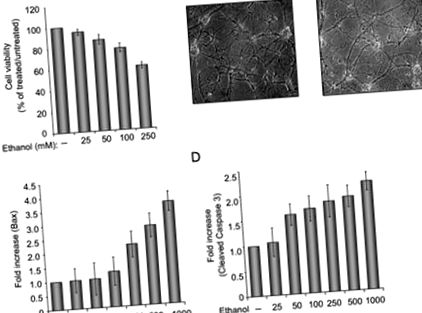
Для вивчення впливу етанолу на нейронні клітини ми підготували первинні культури нейронів щурів та дослідили життєздатність клітин у відповідь на лікування етанолом. Як показано на малюнку 1А, збільшення концентрації етанолу призводить до зниження життєздатності клітин нейронів. При обробці етанолом 250 мМ приблизно 40% клітин були мертвими, а решта клітин демонстрували знижений рівень арборизації та процесів (рис. 1В). Дослідження проапоптотичних білків виявило індукцію BAX та підвищений рівень каспази 3. Фігура 1 ілюструє кількісний аналіз Bax (панель C) та розщепленої каспази 3 (панель D), визначену імуноблот-аналізом. Щоб оцінити здатність p38SJ захищати нейронні клітини від апоптозу при обробці етанолом, клітини інкубували з високоочищеним p38SJ (рис. 2А) протягом 24 годин до аналізу життєздатності клітин та розщеплення каспаз. Як показано на рис. 2, обробка клітин p38SJ різко покращила кількість арборизації клітин, оброблених етанолом (панель B), і життєздатність клітин (панель C) та знизила рівень розщеплення каспази 3 (панель D), вказуючи що p38SJ має нейропротекторну активність у відповідь на лікування етанолом.
(А) Аналіз життєздатності клітин у первинних нейронах щурів, інкубованих із збільшенням концентрації етанолу (від 25 до 250 мМ). Рівну кількість клітин висівали у двічі, а потім інкубували з етанолом. Життєздатність клітин оцінювали методом виключення трипанового синього. Стовпчик 1 представляє необроблені клітини, встановлені як 100%. (B) Фазові зображення (збільшення 200 ×) нейрональних клітин, інкубованих за відсутності та присутності 250 мМ етанолу. (C) Кількісне визначення різниці рівнів Bax, визначене денситометричним аналізом смуги, що відповідає Bax (як визначено за допомогою вестерн-блот-аналізу), яка була нормалізована до рівня Grb2. (D) Кількісне визначення різниці в розщепленій каспазі 3 після нормалізації до рівня Grb2.
(A) SDS-PAGE, що ілюструє високоочищений p38SJ, отриманий при фракціонуванні сирих білкових екстрактів із культури калюсу звіробою (Дарбініан-Саркісян та ін., 2006). Положення p38SJ показано стрілкою. (B) Фазові зображення нейрональних клітин, інкубованих з етанолом (250 мМ) та/або p38SJ (300 нг/мл). Зменшення кількості нейронів та нейрональних процесів, спричинених етанолом, було скасовано у присутності p38SJ. (C) Аналіз життєздатності клітин у первинних нейронах щурів, попередньо інкубували зі зростаючими концентраціями p38SJ, як зазначено на малюнку 2B, протягом 2 годин, а потім обробляли етанолом. Рівну кількість клітин висівали у двох примірниках, а життєздатність клітин оцінювали за допомогою аналізу виключення Trypan blue. Доріжка 1 містить необроблені клітини, встановлені як 100%. (D) p38SJ запобігає розщепленню каспази-3 в нейрональних клітинах, оброблених етанолом. Клітинні лізати, приготовані з необроблених, попередньо оброблених p38SJ протягом 2 годин до обробки етанолом, і клітини, оброблені етанолом, за 24 години інкубації аналізували імуноблот-аналізом на розщеплену каспазу-3. Рівне навантаження було перевірено за допомогою антитубулінових антитіл. Гістограми демонструють кількісно визначену щільність смуг, представлену у вигляді гістограми для розщепленої каспази-3, нормалізованої до тубуліну.
Далі ми досліджували вплив p38SJ на окислювальний стрес у клітинах нейронів. З цією метою ми визначили активність супероксиддисмутази (SOD) у клітинах, інкубованих з p38SJ перед обробкою етанолом. Для вимірювання активності SOD у первинних нейронах ми використовували систему аналізу активності SOD OxiSelect (Cell Biolabs, Сан-Дієго, Каліфорнія). Дані аналізу СОД вказують, що етанол індукує окислювальний стрес у нейронах, пригнічуючи активність СОД (рис. 3А). p38SJ зміг запобігти індукованому етанолом окислювальний стрес і відновити активність СОД у клітинах, оброблених етанолом. В однакових експериментальних умовах результати аналізу метаболізму/активності клітин МТТ показали відновлення клітин p38SJ у клітинах, оброблених етанолом (рис. 3B), та зменшення активності каспази 3, як оцінювали за допомогою аналізу Glo (рис. 3C).
(А) Нейронні клітини, оброблені етанолом протягом 24 годин, або попередньо оброблені p38SJ протягом 2 годин перед впливом етанолу. Клітини аналізували за допомогою аналізу SOD. Активність SOD відображається як% необробленого контролю (бар 1). (B) Життєздатність клітин, визначена методом МТТ. (C) Активність каспази-3, визначена за допомогою аналізу Caspase-3/7.
У світлі попередніх досліджень, що вказують на здатність етанолу порушувати регуляцію сигнальних подій, що включають фосфорилювання ERK1/2 (Glotin et al., 2006; Ku et al., 2007; Lee et al., 2006; Luo et al., 2006; Zhuang et al., 2007), ми дослідили рівні фосфорильованого та загального ERK1/2 у нейрональних клітинах при обробці етанолом. Як видно з рис. 4А, обробка етанолом індукує фосфорилювання ERK1/2 (pERK1/2) без істотного впливу на загальний рівень ERK1/2. Як і раніше, рівень BAX та розщепленої каспази підвищувався при обробці етанолом. Обробка цих клітин p38SJ знижувала рівень фосфорильованої форми pERK1/2, не впливала на загальний рівень ERK1/2, а також значно знижувала рівень BAX і розщепленої каспази 3. Ці спостереження вказують на те, що p38SJ має здатність інгібують індуковане етанолом фосфорилювання ERK1/2 та активацію апоптотичних шляхів. Зниження фосфорилювання ERK1/2 може знизити рівень проапоптотичного BAX і каспази 3.
(A) Експресія ERK1/2 та білків, що беруть участь в апоптозі в нейрональних клітинах, оброблених етанолом. Вестерн-блот-аналіз на ERK1/2 та фосфо-Erk 1/2 у первинних клітинах нейронів щурів після обробки 100 та 250 мМ етанолом протягом 24 годин. Рівень загальної експресії ERK1/2 та Grb2 служить контролем завантаження білка. (В). Вплив p38SJ на фосфорилювання ERK1/2 в клітинах, інкубованих з етанолом. Вестерн-блот-аналіз на ERK1/2 та фосфо-ERK1/2 в клітинах нейронів при впливі етанолу протягом 24 годин після попередньої обробки клітин p38SJ протягом 2 годин.
Подяка
Автори хочуть подякувати колишнім і нинішнім працівникам кафедри нейронауки та Центру нейровірусології за обмін реагентами та ідеями та їх постійну підтримку. Ми дякуємо доктору Юрію Попову з Єреванського державного університету в Єревані, Вірменія, за співпрацю та надання початкової культури калюсу H. perforatum. Ми також дякуємо К. Шріверу за редакційну допомогу. Ця робота стала можливою завдяки грантам, які NIH надав SA.
Спонсор грантового контракту: NIH; Номер грантового контракту: R01MH074392
- Спостереження за перетравленням білка In Vivo The Journal of Nutrition Oxford Academic
- Білок на рослинній основі; 88 акрів
- Санкції за порушення статутів про контроль за алкоголем
- Білок на рослинній основі для схуднення Найкраще схуднення для жиру на животі Найкраще схуднення при доставці додому
- Ожиріння збільшує ризик смерті від COVID-19 у чоловіків 5 надійних способів схуднення