Кристалізація та попередній рентгенологічний аналіз 6-гідроксиметил-7,8-дигідроптеринпірофосфокінази із золотистого стафілокока
Сандіп Чхабра
лікарської хімії та дії лікарських засобів, Інститут фармацевтичних наук Монаша, Університет Монаш, 381 Royal Parade, Парквілл, Вікторія 3052, Австралія
b Відділ молекулярних та медичних технологій CSIRO, 343 Royal Parade, Парквілл, Вікторія 3052, Австралія
Джанет Ньюман
b Відділ молекулярних та медичних технологій CSIRO, 343 Royal Parade, Парквілл, Вікторія 3052, Австралія
Томас С. Торф
b Відділ молекулярних та медичних технологій CSIRO, 343 Royal Parade, Парквілл, Вікторія 3052, Австралія
Росс Т. Фернлі
b Відділ молекулярних та медичних технологій CSIRO, 343 Royal Parade, Парквілл, Вікторія 3052, Австралія
Джоан Кейн
b Відділ молекулярних та медичних технологій CSIRO, 343 Royal Parade, Парквілл, Вікторія 3052, Австралія
Джеймі С. Сімпсон
лікарської хімії та дії лікарських засобів, Інститут фармацевтичних наук Монаша, Університет Монаш, 381 Royal Parade, Парквілл, Вікторія 3052, Австралія
Джеймс Д. Суорбрік
лікарської хімії та дії лікарських засобів, Інститут фармацевтичних наук Монаша, Університет Монаш, 381 Royal Parade, Парквілл, Вікторія 3052, Австралія
Анотація
6-гідроксиметил-7,8-дигідроптерінпірофосфокіназа (HPPK) каталізує Mg 2+ -залежний перенос пірофосфату від АТФ до 6-гідроксиметил-7,8-дигідроптерину (HMDP), утворюючи 6-гідроксиметил-7,8-дигідроптерин пірофосфат, що є критичним кроком на шляху біосинтезу фолієвої кислоти de novo. Кристали дифракційної якості HPPK від медично важливих видів золотистого стафілокока вирощували у присутності сульфату амонію або малонату натрію і дифракції досягали роздільної здатності, що перевищує 1,65 Å. Кристали належали до космічної групи P21 з параметрами елементарної комірки a = 36,8, b = 76,6, c = 51,5 Å, α = γ = 90,0, β = 100,2 °. Кристали містили дві молекули на асиметричну одиницю, з об'ємом на масу білка (V M) 2,04 Å 3 Da −1 та розрахунковим вмістом розчинника 39,6%.
1. Вступ
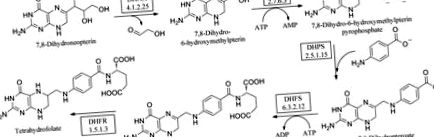
Фолати необхідні всім живим клітинам для росту. Відповідно, ферменти цього шляху (рис. 1 ▶) перевірені як мішені для антимікробних та протигрибкових препаратів. Відновлена форма фолату, тетрагідрофолат (ТГФ), бере участь у кількох важливих перекладах з одним вуглецем, які мають вирішальне значення для біосинтезу тимідину, гліцину та метіоніну та життєво важливі для реплікації ДНК (Schirch & Strong, 1989 ▶). Шлях de novo фолат-біосинтез перетворює 7,8-дигідронеоптерин в 7,8-дигідроптероат за допомогою АТФ та пара-амінобензойної кислоти (pABA). Він містить три виділені ферменти, серед яких HPPK є другим. Спочатку дигідронеоптерин-альдолаза (DHNA) каталізує реакцію епімеризації, перетворюючи 7,8-дигідронеоптерин в 6-гідроксиметил-7,8-дигідроптерин (HMDP). Потім HPPK переносить пірофосфат із зв’язаного АТФ, в результаті чого утворюється 6-гідроксиметил-7,8-дигідроптеринпірофосфат (HMDPP). DHPS конденсує HMDPP з pABA, утворюючи 7,8-дигідроптероат (DHP; Bermingham & Derrick, 2002 ▶). Ферментативне додавання глутамату супроводжується відновленням DHFR, утворюючи 5,6,7,8-тетрагідрофолат (THF). Ці дві останні реакції не є специфічними для мікробів, рослин чи найпростіших. Однак у випадку DHFR структурні відмінності між ферментами людини та бактеріями означають, що селективні антимікробні засоби (такі як TMP) або, у випадку людського ферменту, лікування раку, такі як метотрексат, були успішно застосовані.
Фолієвий шлях.
Тут ми представляємо попереднє кристалографічне дослідження ферменту S. aureus (SaHPPK) як прелюдію до розуміння його каталітичного механізму та як початковий крок до раціонального проектування нових терапевтичних засобів.
2. Матеріали та методи
2.1. Експресія та очищення
Плазміду pET28a, що містить синтезовану послідовність SaHPPK (Geneart), клонували N-кінцевою гексагістидиновою міткою та місцем розщеплення тромбіну. Клітини E. coli BL21 (DE3), трансформовані плазмідою, вирощували протягом ночі в 10 мл 2 × YT середовища, доповненої 100 мкг мл -1 канаміцину для відбору. Потім культуру протягом ночі пересівали в свіжу 2 × YT (1 л) і вирощували при 310 К, поки OD600 не досяг 0,5–0,8. Ізопропіл β- d -1-тіогалактопіранозид (IPTG) додавали до кінцевої оптимізованої концентрації 0,3 мМ і експресію проводили при 301 К протягом 5 годин. Культури центрифугували при 5000g та 278 K протягом 10 хв, і клітини ресуспендували в 100 мл 50 мМ HEPES, 5% гліцерину, рН 8,0. Повна коктейльна таблетка без інгібітора протеази без ЕДТА (Roche) була додана разом з лізоцимом; останню додавали до кінцевої концентрації 0,2 мг мл -1. Через 10 хв клітини обробляли ультразвуком, клітинний залишок видаляли центрифугуванням при 18000g протягом 30 хв і супернатант фільтрували (фільтр 0,45 мкм).
Супернатант завантажували на колонку Ni – NTA IMAC (Qiagen) і незв’язаний білок змивали 10 мМ імідазолом у 50 мМ буфері HEPES – NaOH, 0,3 М NaCl, рН 8,0. Позначений білок елюювали з колонки IMAC 250 мМ імідазолом у буфері HEPES – NaCl; немічений білок генерували шляхом перетравлення на колонці, проведеного тромбіном для видалення N-кінцевої мітки His. На міліграм міченого білка використовували одну одиницю тромбіну (Sigma – Aldrich). Розщеплений білок елюювали з колонки 10 мМ імідазолом у буфері HEPES – NaCl. Як позначені, так і не позначені версії білка додатково очищали на колоні Superdex 75 для виключення розмірів 16/60 (GE Healthcare) і елюювали 50 мМ HEPES, 2 мМ DTT рН 8,0. Фракції аналізували за допомогою 15% гелю SDS – PAGE з фарбуванням Кумасі, а фракції, що містять білок, об’єднували та концентрували до 4,5 мг мл −1 за допомогою відцентрового пристрою для ультрафільтрації з молекулярною масою 3 кДа (Amicon). Урожайність міченого та розщепленого білка становила, як правило, 35-50 і ~ 15-25 мг на літр культури відповідно. Всі зразки заморожено заморожували та зберігали при 193 K.
2.2. Кристалізація
Експерименти з кристалізації білка (як для мічених, так і для немічених білків) проводили на вузлі CSIRO Центру спільної кристалізації Bio21 (C3), спочатку використовуючи PACT та комерційні екрани JCSG + Suite (Qiagen) при 281 та 293 K. A Екран рН проти градієнта солі також тестували при обох температурах. На всіх екранах використовували метод дифузії пари за допомогою сидячих крапель з краплями, що складаються з розчину білка 250 нл і розчину резервуару 250 нл та об’єму резервуару 50 мкл. Кристалізацію проводили в планшетах SD-2 (IDEX Corporation) та встановлювали за допомогою робота Фенікс (Art Robbins Industries).
Невеликі множинні або здвоєні кристали спостерігали через тиждень у кількох умовах сульфату амонію та малонату натрію. Для поліпшення розміру та якості кристалів була застосована послідовна стратегія мікронасіювання. Насіння створювали за допомогою протоколу насіннєвої кульки (Luft & DeTitta, 1999 ▶; Newman et al., 2008 ▶) і вводили до крапель кристалізації при налаштуванні за допомогою багатоаспіратного протоколу робота-комара (TTP Labtech). Однак навіть після кількох раундів оптимізації мікронасінь майже всі кристали все ще частково вросли. Ми також спробували аддитивний скринінг на комерційно доступних аддитивних екранах (включаючи Additive Screen HT від Hampton Research та The OptiSalt Suite від Qiagen), а також додавши різні іони металів, щоб знайти умови кристалізації, що дадуть монокристали.
2.3. Збір та аналіз даних
Для збору рентгенівських даних кристали захищали кріслом шляхом додавання 1 мкл розчину резервуару до краплі та подальшого додавання до краплі 1,2 мкл масла AP/E Core 150 (Mobil-Exxon). Кристали кріоохолоджувались в потоці азоту після витягування через масляну поверхню AP/E. Дані були зібрані на мікрофокусному (MX2) променевому каналі австралійського синхротрону. 720 зображень коливань 0,5 ° було зібрано за допомогою детектора ADSC Quantum 315. Відстань кристала до детектора становила 250 мм, а експозиція - 1 с для кожного зображення. Дані дифракції обробляли за допомогою MOSFLM (Leslie, 1992 ▶) та SCALA/TRUNCATE (Collaborative Computational Project, Number 4, 1994 ▶). Дифракційна картина SaHPPK показана на рис. 2 ▶ .
- Прогноз ринку косметичних сортів, що зігрівають, аналіз тенденцій та відстеження конкуренції - глобальний
- Фізичне навантаження та зниження ваги у людей похилого віку з ожирінням, які страждають на артроз колінного суглоба, попереднє дослідження - PubMed
- ДЕНЗИТОМЕТРИЧНИЙ АНАЛІЗ СКЛАДУ ТІЛА Перегляд деяких кількісних припущень - Брожек -
- Чи справді олія чорного насіння працює під час наукового аналізу переваг?
- Дієтичні добавки Що в назві Що в пляшці Маркус - 2016 - Тестування та аналіз наркотиків