Кодування пам’яті
Пов’язані терміни:
- Отримання пам'яті
- Амігдала
- Гіпокампу
- Медіальна скронева частка
- Нейрони
- Посттравматичний стресовий розлад
- Префронтальна кора
- Сегментація
Завантажити у форматі PDF
Про цю сторінку
Підвищення продуктивності для дії та сприйняття
Едвард Ф. Пейс-Шотт, Ребекка М.К. Спенсер, In Progress in Brain Research, 2011
Дослідження консолідації залежно від сну у здоровому старінні
Кілька нещодавніх досліджень досліджували, чи не змінюються залежно від сну процеси пам'яті зі збільшенням віку. До експериментальних оцінок дві теоретичні роботи висували гіпотезу про те, що консолідація, залежна від сну, зменшиться у літніх людей. Хорнунг та ін. (2005) передбачали взаємозв'язок між зменшенням пам'яті та змінами у фізіології сну, які зазвичай спостерігаються у літніх людей. Згідно з цією теоретичною роботою, зменшення сну та пам'яті може мати спільне джерело, таке як зменшення об'єму мозку, серцево-судинні або нейрохімічні зміни. І навпаки, взаємозв'язок може бути прямим: зміни в режимі сну - такі як зменшення SWS, REM або щільності веретена - можуть призвести до зменшення пам'яті.
Згідно з гіпотезою Баклі та Шатцберга (2005), зміни осі гіпоталамо-гіпофіз-наднирники (ГПА) у літніх людей лежать в основі зниження якості сну, а отже, і зменшення пам’яті у літніх людей. Вісь HPA - це петля зворотного зв'язку, яка контролює реакцію на стрес та інші процеси за допомогою вивільнення кортизолу. Кортизол також коливається в циркадному ритмі з піком вранці і падаючим протягом дня до вечірнього надиру. У старших дорослих циркадний ритм згладжується, і вісь HPA стає гіперактивною. Поєднання цих двох змін, за словами Баклі і Шатцберга (2005), призводить до вікових змін сну, які, в свою чергу, зменшують залежність від сну консолідації пам'яті.
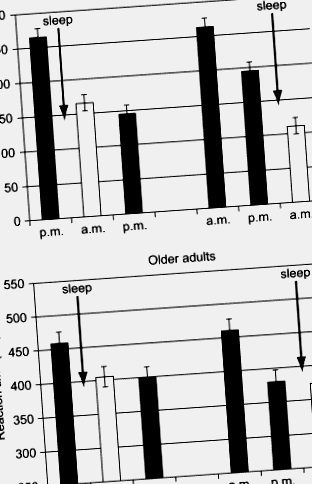
Рис.2. Час реакції на чітке навчальне завдання з послідовністю після 12-годинних інтервалів, що містять нічний сон (наприклад, з 8 вечора до 8 ранку), або пробудження в неспаному стані (наприклад, з 8 ранку до 8 вечора). Молоді люди (верхня панель) послідовно демонструють найбільші покращення продуктивності (зменшення часу реакції) після нападів сну, незалежно від того, відбудеться перший із трьох сеансів ввечері (ліва сторона) або вранці (справа). Хоча старші дорослі демонструють покращення після першого сеансу, ця зміна не залежить від сну.
Siengsukon and Boyd (2008, 2009) досліджували, чи будуть очевидні зміни продуктивності, пов'язані зі сном, у осіб після інсульту. Здорові дорослі учасники, приблизно 55–75 років, служили контролем. Вони також виявили, що продуктивність праці незмінною після сну у здорових людей похилого віку. Насправді, у другому дослідженні, що порівнювало офлайн-зміни щодо явних та неявних завдань моторного навчання, здорові літні люди показали подібні зміни у продуктивності протягом інтервалів зі сном та інтервалів із неспанням незалежно від обізнаності (Siengsukon and Boyd, 2009). Однак результати діяльності групи після інсульту показали суттєві зміни продуктивності після сну. Автори припускають, що ця збережена користь від сну, яка була відсутня у здорових контролях за віком, пов'язана із збільшенням сну та щільності веретена, яке спостерігалося після інсульту (Vock et al., 2002).
Два останні дослідження досліджували залежність від сну закріплення немоторного навчання у літніх людей. Алі та Москович (2010) порівняли епізодичне відкликання після інтервалу з нічним сном відносно відкликання після денного інтервалу, проведеного неспавши. У той час як старші дорослі (69–80 років) виявляли більше забуття через обидва інтервали щодо групи молодих дорослих (19–29 років), захист пам’яті, забезпечуваний сном, не відрізнявся у вікових групах, що свідчить про щадність сну. залежний процес консолідації пам'яті. Подібним чином ми виявили пощаджене залежне від сну закріплення пам’яті у літніх людей за завданням із вивчення пари слів. Ми порівняли зміни в залежній від сну обробці пам’яті навчального завдання з руховою послідовністю та офлайн-змінам у вивченні пар слів (Wilson et al., Подано). Знову ж таки, старші дорослі (55–70 років) не виявляли ніяких змін, що залежать від сну, при виконанні завдання з рухового навчання. Однак ці самі люди демонстрували схожий захист виконання, що залежить від сну, при виконанні завдання пари-пари.
Це дослідження (Wilson et al., Представлене) також включало дорослих середнього віку (35-50 років), і ми повідомляємо, що їхні зміни в продуктивності в режимі сну та неспання були подібними до молодих дорослих для обох завдань. Однак Backhaus et al. (2007) припускають, що залежність від сну консолідації декларативних спогадів у цій віковій групі (48–55 років) зменшується порівняно з молодими дорослими. Молоді люди згадували більше пар слів у відповідному навчальному завданні, пов’язаному з парою слів, після раннього нічного (багатого SWS) сну, ніж сну пізнього (багатого на REM). Група середнього віку не показала суттєвих змін за будь-який інтервал. Однак, коли вони розглядали фізіологічні заходи у цих суб'єктів, вони виявили, що особи середнього віку, які отримали таку ж кількість SWS, як і молоді люди, виявляють більшу консолідацію після сну, ніж особи середнього віку, які залишаються в стані спокою.
Фармакологічні підходи до розуміння, запобігання та пом’якшення болючих спогадів. Уроки посттравматичних стресових розладів
3.3 Основні фармакологічні стратегії для пом'якшення або запобігання травматичній пам'яті: результати емпіричних досліджень
Оскільки норадреналін відіграє центральну роль у кодуванні та консолідації емоційної пам’яті з самого початку будь-якого травматичного викриття, а також тому, що норадренергічна гіперароза може призвести як до основних порушень когнітивного контролю, так і до ефективної модуляції емоційного збудження, яке зазвичай опосередковується префронтальними системами, протидіючи норадренергічній гіперактивній силі бути перспективним першим кроком для запобігання ризикованому переходу на ПТСР після травматичного стресу. Норадренергічна гіперактивність може зменшуватися як за допомогою постсинаптичного β- та α1-адренергічного антагонізму, так і пресинаптичного α2-адренергічного агонізму (Schwabe, Nader, Wolf, Beaudry, & Pruessner, 2012). Доступні кілька фармакологічних засобів, які досліджувались в емпіричних дослідженнях. Наразі результати були непослідовними.
Пітман, Сандерс та Зусман (2002) провели перше пілотне дослідження. Вони набрали 41 особу, яка представила критерії DSM-IV А1 і А2 та ознаки підвищеної автономної активності (пульс у спокої> 80/хв) у відділення невідкладної допомоги відразу після травматичної події (в основному важкі ДТП). Пацієнти брали участь у рандомізованому, подвійному сліпому та плацебо-контрольованому дослідженні, отримуючи або 4 × 40 мг пропранололу на добу, або плацебо протягом 10 днів. Через місяць два пацієнти групи пропранололу відповідали діагностичним критеріям ПТСР відповідно до шкали ПТСР, призначеного клініцистом, проте шість пацієнтів групи плацебо (р = 0,19). Через 3 місяці спостереження один пацієнт групи пропранололу та три пацієнти групи плацебо мали ПТСР (р = 0,35). Ця позитивна, але статистично незначима тенденція (через занадто низьку потужність) була підкреслена в додатковому психофізіологічному дослідженні, яке проводилося за сценарієм травми, вказуючи на автономну гіперароза у жодного з пацієнтів групи пропранололу та у восьми пацієнтів групи плацебо (p = 0,004). Інші контрольовані, але неосліплені та нерандомізовані дослідження також висловились на користь β-адренергічної блокади за цим показанням (Taylor et al., 2002; Vaiva, Ducrocq, & Jezequel, 2003). Рандомізоване, подвійне сліпе та контрольоване плацебо- або габапентином дослідження з пацієнтами після травматичних пошкоджень не могло підтвердити жодної переваги пропранололу (Stein, Kerridge, Dimsdale, & Hoyt, 2007). Існують негативні результати профілактичного застосування пропранололу у пацієнтів після важких опіків щодо частоти пізнішого ПТСР (McGhee, Maani, & Garza, 2009; Sharp, Thomas, & Rosenberg, 2010).
Відкриті дослідження з використанням α2-агоністичних речовин, таких як клонідин або гуанфацин, які зменшують вивільнення норадреналіну з пресинаптичних пухирців у синаптичну щілину, обіцяють превентивний потенціал (Morgan, Krystal та Southwick, 2003). Проте поки що жодні перспективні контрольовані дослідження не досліджували жодного профілактичного використання цих речовин. Контрольовані випробування при лікуванні ветеранів із хронічним ПТСР виявили негативні результати гуанфацину (Davis et al., 2008; Neylan, Lenoci, & Samuelson, 2006). Α1-антагоніст празозин, позитивний вплив якого на порушення сну та кошмари, пов’язані з ПТСР, був добре встановлений у кількох рандомізованих контрольованих дослідженнях (Germain, Richardson, & Moul, 2012; Raskind, Peskind, & Hoff, 2007; Raskind, Peskind, & Kanter, 2003; Taylor, Martin, & Thompson, 2008), може бути ще одним перспективним кандидатом, можливо, запобігаючи переходу до ПТСР після викриття травми. Однак це показання вимагає належного фармакологічного дослідження.
Загалом, протидія норадренергічній гіперактивності після травматичного стресу, як видається, все ще є цікавим варіантом для ранніх досліджень з метою запобігання або зменшення ризику переходу на ПТСР. Проведені до цього часу рандомізовані плацебо-контрольовані дослідження є рідкістю і, як правило, включали лише невеликі зразки пацієнтів. Результати випробувань є всеохоплюючими (Hoge, Worthington, & Nagurney, 2012). Будь-яке втручання, наприклад, при β-адренергічній блокаді, має дуже ретельно оцінювати клінічні ознаки автономної гіперарозуальності та оцінювати загальну патофізіологію, яка може бути досить складною при станах тілесних ушкоджень (наприклад, опіки) або супутніх соматичних захворювань (Schelling, 2008 ).
Добре встановлено, що ендогенна опіатна система бере участь у регуляції емоційного навчання та пам’яті і, таким чином, відіграє центральну роль під час та після викриття травми (Garakani et al., 2009). На підставі клінічних звітів, ранній прийом опіатів у пацієнтів з важкими травматичними опіками, здається, корелює з меншою частотою пізніших ПТСР (Saxe, Stoddard, & Courtney, 2001; Stoddard, Sorrentino, & Ceranoglu, 2009). Військово-медичний досвід із важко пораненими під час бою солдатів також зміцнює стратегію раннього використання опіатів (Holbrook, Galarneau, & Dye, 2010). Персистуючий і неконтрольований біль може вважатися належним фактором ризику для подальшого ПТСР (Norman, Stein, Dimsdale, & Hoyt, 2008; Schelling, 2008). Проте ще слід встановити, чи забезпечують опіати справжній загальний ефект зменшення ризику ПТСР за межами спеціального знеболюючого ефекту (Bryant, Creamer, O’Donnell, Silove та McFarlane, 2009).
Серотонін модулює норадренергічну реактивність та автономне збудження. Це впливає на функціонування осі HPA. Як правило, він опосередковує інгібуючий вплив як на активність нейронів, так і на пластичність. Добре збалансована серотонінергічна нейромедіація є основною передумовою гнучкої орієнтації реальності та адекватної реакції. Будь-який тривалий і неконтрольований стрес, як у травматичних ситуаціях, може призвести до серотонінергічної дисфункції (Krystal & Neumeister, 2009). Серотонінергічні антидепресанти відіграють першорядну роль у фармакологічному лікуванні встановленого ПТСР. Однак було дуже мало спроб емпірично довести будь-який профілактичний потенціал серотонінергічних речовин незабаром після викриття травми (Zohar, Sonnino, Juven-Wetzler, & Cohen, 2009). Рандомізоване, подвійне сліпе та плацебо-контрольоване дослідження не могло встановити вищий ефект есциталопраму за цим показником у дорослих після різних травм (Шалев та ін., 2012). Однак у дітей, які страждають від сильних опіків, сертралін продемонстрував статистично значущий профілактичний ефект, який у клінічному відношенні доводилось розглядати як середній (Stoddard, Luthra, & Sorrentino, 2011).
Поступальний потенціал реконсолідації пам'яті
Філіп Р. Корлетт, Джейн Р. Тейлор, у Реконсолідації пам'яті, 2013 рік
13.1 Вступ
Спогади дозволяють нам спиратись на наш минулий досвід, щоб адаптивно реагувати на сучасність та планувати наше майбутнє (Dudai & Eisenberg, 2004). Однак вони є не просто записами минулого, які можна відтворити за необхідності, і вони не завжди є веричними або адаптивними (Естес, 1997). Поява когнітивної нейронауки та її застосування до проблем психіатрії - когнітивної нейропсихіатрії - змусило вчених-клініцистів охарактеризувати багато симптомів психічних захворювань як патології формування, підтримання та використання пам'яті (Halligan & David, 2001). У цій главі ми розглядаємо деякі з цих тверджень щодо реконсолідації пам’яті або як патофізіологічний механізм (Corlett et al., 2009), або як можливе терапевтичне вікно (Debiec, 2012; Taylor et al., 2009), оцінюючи їх достовірність. проти наявних клінічних даних. Ми обговорюємо етичні наслідки терапії модифікації пам'яті. Ми також окреслюємо деякі з того, що, на нашу думку, будуть практичними перешкодами та складностями, пов’язаними зі спробою модифікувати аберрантні спогади у пацієнтів-людей, що виділяється доклінічною роботою з вивчення граничних умов та особливостей реконсолідації пам’яті (Inda et al., 2011).
Феномен повторної консолідації пам'яті спостерігається, коли після кодування та консолідації пам’яті процедура нагадування знову активує початкову пам’ять у лабільний стан, в якому вона стає сприйнятливою до втручань, що перешкоджають її подальшій консолідації (Misanin et al., 1968; Nader et al., 2000; Przybyslawski & Sara, 1997). Ці дестабілізуючі втручання можуть погіршити подальше отримання початкової пам'яті, можливо, навіть повністю її стерти (Kindt et al., 2009). Звичайно, невідомо, чи пам'ять справді стирається, чи, скоріше, перекривається і гальмується новим навчанням вимирання (Osan et al., 2011). Баланс між вимиранням та реконсолідацією є ще одним ключовим аспектом потенційного патофізіологічного внеску та терапевтичного потенціалу відхилених процесів пам'яті (Corlett et al., 2009; Eisenhardt & Menzel, 2007; Pedreira et al., 2004). Клінічна привабливість здатності видаляти або гальмувати небажані спогади давно оцінена; тут Шекспірівський «Макбет» просить лікаря лікувати його дружину:
Чи не можеш ти служити хворому розуму?,
Вирвати з пам'яті вкорінене горе,
Знизити письмові проблеми мозку,
І з яким-небудь солодким забутим протиотрутою
Очистіть пазуху від цієї небезпечної речі
Що тяжче на серці?
Цей потенціал ще не реалізований, але є деякі інтригуючі початкові результати лікування пацієнтів з посттравматичним стресовим розладом (ПТСР), тривожністю та наркоманією. Крім того, розглядаючи, яким чином може служити реконсолідація функціональної пам'яті (Alberini, 2011; Stickgold & Walker, 2007), теоретичні моделі деяких симптомів передбачають надмірну реконсолідацію пам'яті як патофізіологічний процес. Наприклад, марення, яке стосується серйозних психічних захворювань, таких як шизофренія, може зберігатися на тлі суперечливих доказів через неналежне відновлення пам’яті (Corlett et al., 2009); тобто, якщо функція реконсолідації пам’яті полягає в оновленні та упорядкуванні пам’яті у світлі нової інформації (Alberini, 2011; Stickgold & Walker, 2007), то надмірна реконсолідація може пояснити дивовижну еластичність маячних переконань (Simpson & Done, 2002) в результаті чого, зіткнувшись з безперечним доказом того, що їхні марення не стосуються, пацієнти спритно включатимуть цю інформацію у свою марення, роблячи інформацію зрозумілою та зміцнюючи віру (Milton et al., 1978). Перш ніж розширити потенційні теоретичні розширення реконсолідації, ми окреслимо деякі доклінічні висновки з поступальним потенціалом у психіатрії.
Довідник з розпізнавання новизни об’єкта
Нік ван Гетем,. Джос Приккертс, у Довіднику з поведінкових нейронаук, 2018
8.3 Медіальна скронева частка в порівнянні з префронтальною корою
Культурні впливи на розвиток дитячої пам’яті та пізнання
3.1 Кодування пам'яті
Рис.3. Приклад завдання ілюзії Еббінгауза. . В експерименті Imada та його колег протягом усього періоду вони змінювали розмір правильного цільового кола.
Ця фігура була створена на основі фігури у Imada, T., Carlson, S. M., & Itakura, S. (2013). Культурні відмінності між Сходом та Заходом у контекстній чутливості виявляються в ранньому дитинстві. Наука про розвиток, 16 (2), 198–208. doi: 10.1111/desc.12016.
Когнітивна неврологія сну
Джина Р. По,. Тереза Е. Бьорнесс, «Прогрес у дослідженні мозку», 2010
Гіпокампу для асоціативного навчання та консолідації пам’яті
Структура швидкого кодування гіпокампу - це місце, де було виявлено будівельний блок для кодування пам’яті, довготривалого потенціювання (LTP) (Bliss and Lomo, 1973). Консолідація пам'яті - це перенесення цієї пластичності гіпокампа на більш постійні місця тривалого зберігання, розподілені по всій неокортексі. LTP вимагає постсинаптичної деполяризації мембрани, що збігається з потенціалами пресинаптичної дії, щоб забезпечити внутрішньоклітинний каскад молекулярних подій, які впливають на тривале збільшення синаптичної сили. LTP легко індукується під час неспання та швидкого сну в гіпокампі (Bramham and Srebro, 1989).
Обчислювальні та процесні моделі прийняття рішень у психології та поведінковій економіці
Ерік Дж. Джонсон, Роджер Раткліф, у нейроекономіці (друге видання), 2014
Компонент, що не приймає рішення
Поза накопиченням доказів, захоплених дрейфуючою частинкою, існують інші процеси, такі як кодування стимулів, доступ до пам'яті та процеси руху, які виробляють поведінкову реакцію суб'єкта. Існує також процес перетворення представлення стимулу у змінну, пов’язану з рішенням, яка керує процесом прийняття рішення. Ці компоненти обробки вимагають часу, який не фіксується безпосередньо моделлю, і об'єднуються в один компонент "без рішення", який має середню тривалість терміну дії. Таким чином, загальний час обробки рішення приймається як сума часу, зайнятого процесом прийняття рішення, і часу, зайнятого компонентом, що не приймає рішення.
Гіпокамп, пам’ять та свідомість
Висновки
Розуміння психологічних травм та посттравматичного стресового розладу (ПТСР)
Джуліан Д. Форд,. Крістін А. Куртуа, у посттравматичному стресовому розладі (друге видання), 2015
Розуміння психологічних травм та посттравматичного стресового розладу (ПТСР)
- Сільське господарство комах - огляд тем ScienceDirect
- MacConkey Agar - огляд тем ScienceDirect
- Мальтодекстрин - огляд тем ScienceDirect
- Lactobacillus - огляд тем ScienceDirect
- Герпетичний стоматит - огляд тем ScienceDirect