Клінічні характеристики та фактори ризику спалаху подагри у післяопераційний період
Анотація
Завдання
Оцінити клінічні особливості та фактори ризику спалаху подагри у післяопераційний період у пацієнтів, яким раніше був діагностований подагра.
Методи
Були включені сімдесят пацієнтів, у яких в анамнезі була подагра та які проходили консультації в ревматологічній клініці до операції під загальним наркозом. Клінічні характеристики пацієнтів, у яких розвинувся післяопераційний приступ подагри, порівнювали з тими пацієнтами, у яких не розвинувся приступ подагри.
Результати
Серед 70 пацієнтів у 31 (44,3%) у післяопераційному періоді розвинувся приступ подагри. Середні інтервали від операції до спалаху подагри становили 3,7 дня. Спалахи, як правило, вражали суглобові суглоби (61,3%) і вражали суглоби нижніх кінцівок (83,9%). Колінні суглоби (26%) та суглоби стопи, за винятком першого плюснефалангового (МТР) суглоба (26%), були частіше задіяні, ніж перший МТП суглоб (13%). Рівень сечової кислоти до хірургічного втручання ≥ 9 мг/дл (АБО 3,77, 95% ДІ 1,28–11,10, стор = 0,016) та кількість змін сечової кислоти між операціями до та після операції (АБО 1,62, 95% ДІ 1,21–2,18, стор = 0,001) були факторами ризику спалаху подагри після хірургічного втручання. Прийом алопуринолу знижує ризик післяопераційного спалаху подагри (АБО 0,15, 95% ДІ 0,05–0,45, стор = 0,001). Час операції, кількість крововтрати під час операції та місце операції не були суттєво пов'язані з післяопераційним спалахом подагри.
Висновки
Адекватний контроль сечової кислоти перед операцією може запобігти післяопераційному спалаху подагри.
Вступ
Метод
Навчання населення
Випробовуваних відбирали з групи пацієнтів, які мали в анамнезі подагру та проконсультувались у ревматологічній клініці перед операцією в одній вищій лікарні в Південній Кореї в період з січня 2007 року по вересень 2017 року. Ревматологи клінічно поставили діагноз спалаху подагри. Всього було виявлено 184 пацієнтів. Серед них хірургічне втручання під місцевою анестезією та хірургічне втручання на артеріовенозних норицях для гемодіалізу були виключені з аналізу. Пацієнти з недостатньою клінічною інформацією в електронній медичній картці були виключені з аналізу. Всього було включено 70 пацієнтів.
Зібрані параметри
Індекс маси тіла (ІМТ), медичні супутні захворювання, включаючи гіпертонію, цукровий діабет, хронічні захворювання нирок, діаліз, серцево-судинні захворювання та сечовий камінь, були зібрані за допомогою електронної системи медичних карток. Інформацію про суглоби, що беруть участь у спалаху подагри, час початку захворювання було зібрано з консультаційного листа ревматологічного відділення. Також були зібрані ліки, включаючи алопуринол, фебуксостат та колхіцин. Будь-які ліки від подагри означають прийом одного або декількох ліків серед алопуринолу, фебуксостату та колхіцину. Хірургічні фактори, включаючи місце операції, час операції, кількість крововтрати, кількість введення рідини та переливання крові під час операції, були зібрані через медичну документацію. Були визначені рівні сечової кислоти в до- та післяопераційний період, і розраховано кількість змін сечової кислоти між до- та післяопераційним періодами.
Статистичний аналіз
Описова статистика була використана для виявлення характеристик досліджуваної сукупності. Клінічне порівняння проводили з використанням точних тестів хі-квадрат та Фішера для категоріальних змінних та студента т-тест на неперервні змінні. Співвідношення між змінами сечової кислоти та хірургічними факторами, включаючи загальну кількість введених рідин, оцінювали за допомогою коефіцієнта кореляції Пірсона. Для аналізу фактора ризику спалаху подагри використовували уніваріантну логістичну регресію. Всі аналізи проводились із використанням SPSS версії 19.0 (IBM Co., Armonk, NY, USA). MedCalc версії 18.6 був використаний для розрахунку кривої робочих характеристик приймача (ROC) та аналізу специфічності, чутливості та негативних та позитивних прогнозних значень сечової кислоти до хірургічного втручання для післяопераційного спалаху подагри. Статистичне значення було призначене для стор
Результати
Клінічні характеристики 70 пацієнтів наведені в таблиці 1. Середній вік становив 62,6 року, а 60 (85,7%) пацієнтів були чоловіками. Серед 70 пацієнтів у 31 (44,3%) у післяопераційному періоді розвинувся приступ подагри. Передопераційний рівень сечової кислоти був значно вищим у групі спалахів, ніж у групі, що не спалахувала. Кількість зміни сечової кислоти від до і після операції була значно вищою у групі спалахів, ніж у групі, що не спалахнула. Швидкість використання алопуринолу була значно нижчою у групі спалахів. Тривалість захворювання та супутні захворювання не суттєво відрізнялися між двома групами.
Клінічні характеристики пацієнтів із спалахом подагри протягом післяопераційного періоду наведені в таблиці 2. Середні інтервали від операції до спалаху подагри становили 3,7 дня. Факели, як правило, були односуглобовими і частіше вражали суглоби нижніх кінцівок. Серед 46 залучених суглобів, включаючи поліартикулярні суглобові суглоби, колінні суглоби (26%) та суглоби стопи, за винятком першого плюснефалангового суглоба (МТР) (26%), були зачеплені частіше, ніж перший суглобовий суглоб (13%).
Хірургічні фактори, пов’язані із спалахом подагри, наведені в таблиці 3. Час операції, кількість крововтрати, споживання рідини та переливання крові між групами суттєво не відрізнялись. Незважаючи на те, що не було значної різниці в хірургічному місці між групами, шлунково-кишковий тракт був найпоширенішим хірургічним місцем у групі спалахів, за якою слідували сечовивідні шляхи. Кількість сечової кислоти, що змінюється від до до після операції, позитивно пов’язано з кількістю рідини, що вводиться під час операції (r = 0,258, стор = 0,031). Крововтрата, час операції та кількість рідини відповідно до типу не були суттєво пов'язані з кількістю змін сечової кислоти.
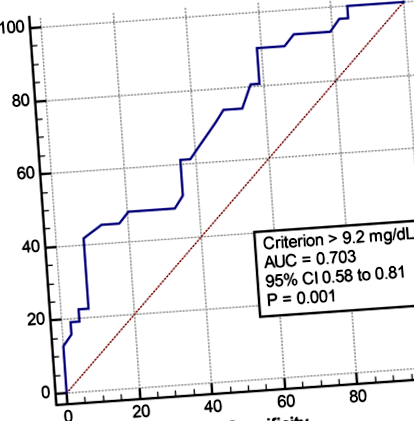
Високий рівень хірургічної сечової кислоти та велика зміна рівнів підвищували ризик виникнення післяопераційної подагри (табл. 4). Рівень сечової кислоти до хірургічного введення ≥9 мг/дл був значним фактором ризику розвитку спалаху подагри після хірургічного втручання. Прийом будь-яких ліків від подагри та алопуринолу перед операцією знижує ризик спалаху подагри. В аналізі ROC граничне значення для доопераційного рівня сечової кислоти понад 9,2 мг/дл мало чутливість 41,9%, специфічність 92,3%, позитивне прогнозне значення 81,3% та негативне прогнозне значення 66,7% для спалаху подагричної подагри. Встановлено, що площа під кривою (AUC) дорівнює 0,70 (95% ДІ 0,58–0,81, стор = 0,001) для граничного значення 9,2 мг/дл (рис. 1).
Крива робочої характеристики приймача сечової кислоти до хірургічного втручання (ROC) для прогнозування післяопераційного спалаху подагри. ДІ, довірчий інтервал; AUC, площа під кривою
Обговорення
Хоча місце операції між групами суттєво не відрізнялося, шлунково-кишковий тракт був найпоширенішим місцем операції серед групи спалахів. Кан та ін. повідомили, що шлунково-кишкова хірургія була пов'язана з розвитком подагрі [14]. Під час операцій на шлунково-кишковому тракті тривалість періопераційного голодування, як правило, займає більше часу, ніж операція на інших органах, і дієта з високим вмістом пуринів, така як м’ясо або морепродукти, може бути дозволена пізніше, ніж для інших типів операцій. У нашому дослідженні зміни сечової кислоти були найбільшими у групі шлунково-кишкових хірургічних втручань (2,9 ± 2,5 мг/дл), ніж середні зміни сечової кислоти (1,9 ± 2,1 мг/дл). Пацієнти, які перенесли операцію на шлунково-кишковому тракті, можуть збільшити ризик спалаху подагри після операції за допомогою тривалого голодування та голодування, що, в свою чергу, швидко знижує рівень сечової кислоти.
Лікування спалаху подагри під час хірургічного періоду, вибір препарату базувався на наявності або відсутності протипоказань та попередньому досвіді лікування пацієнта [20, 21]. Для пацієнтів з відсутністю протипоказань ми використовували нестероїдні протизапальні препарати (НПЗЗ) та інгібітори протонної помпи, якщо це доречно, як варіант першої лінії. У пацієнтів з нирковою недостатністю уникали прийому колхіцину та НПЗЗ та застосовували пероральний кортикостероїд (20 мг – 30 мг/добу еквівалентного преднізолону протягом 3–5 днів). Для пацієнтів з нульовим ставленням (нічого через рот) (НПО) через шлунково-кишкову хірургію або захворювання з ураженням 1-2 суглобів застосовували внутрішньосуглобову ін’єкцію кортикостероїдів (доза варіюється залежно від розміру суглоба). Внутрішньовенне введення метилпреднізолону (0,5 мг/кг) також застосовували для пацієнтів з НПО з поліартикулярною участю.
Обмеженням цього дослідження є його невеликий обсяг вибірки. Ми спробували оцінити клінічні фактори ризику, включаючи хірургічні фактори, для післяопераційного спалаху подагри. Більший обсяг вибірки може призвести до більш значущих результатів. Інші фактори, які можуть впливати на післяопераційні спалахи подагри, особливо такі ліки, як аспірин, діуретики та нестероїдні протизапальні засоби, не були включені в аналіз, оскільки важко оцінити вплив ліків на спалахи подагри, а ефект складніший коли одночасно використовується кілька препаратів.
Висновки
Високий рівень сечової кислоти до хірургічного втручання, особливо перевищує 9 мг/дл, і кількість змін сечової кислоти в періопераційному періоді були суттєво пов'язані з підвищеним ризиком спалаху подагри після хірургічного втручання. А прийом алопуринолу зменшив ризик спалаху подагри після хірургічного втручання. Швидко знижена сечова кислота в післяопераційному періоді може бути пов'язана з введенням рідини та голодуванням у періопераційний період. Наші результати показують, що адекватний контроль сечової кислоти перед операцією може запобігти післяопераційним спалахам подагри.
Наявність даних та матеріалів
Усі дані, отримані або проаналізовані під час цього дослідження, включені в цю опубліковану статтю. Набори даних, створені та/або проаналізовані під час поточного дослідження, не є загальнодоступними через етичну політику установ, але доступні у відповідного автора на обґрунтований запит.
Список літератури
Zhu Y, Pandya BJ, Choi HK. Поширеність подагри та гіперурикемії у загальній популяції США: Національне обстеження здоров’я та харчування 2007-2008. Ревматизм артриту. 2011; 63 (10): 3136–41.
Trifiro G, Morabito P, Cavagna L, Ferrajolo C, Pecchioli S, Simonetti M, et al. Епідеміологія подагри та гіперурикемії в Італії протягом 2005-2009 років: загальнонаціональне популяційне дослідження. Енн Реум Дис. 2013; 72 (5): 694–700.
Bursill D, Taylor WJ, Terkeltaub R, Kuwabara M, Merriman TR, Grainger R, et al. Подагра, гіперурикемія та пов'язана з кристалами хвороба консенсусна заява щодо міток та визначень елементів захворювання при подагрі. Arthritis Care Res (Hoboken). 2019; 71 (3): 427–34.
Martinon F, Petrilli V, Mayor A, Tardivel A, Tschopp J. Кристали сечової кислоти, пов’язані з подагрою, активують запальний процес NALP3. Природа. 2006; 440 (7081): 237–41.
Фелпс П, DJ MC-молодший Кристально-індуковане запалення в суглобах собак. II. Значення поліморфно-ядерних лейкоцитів. J Exp Med. 1966; 124 (1): 115–26.
Герн П.А., Теркельтауб Р., Зурав Б., Лоц М. Запальні мікрокристали стимулюють вироблення та секрецію інтерлейкіну-6 моноцитами та синовіоцитами людини. Ревматизм артриту. 1989; 32 (11): 1443–52.
Terkeltaub R, Zachariae C, Santoro D, Martin J, Peveri P, Matsushima K. Хемотаксичний фактор нейтрофілів, отриманий моноцитами/інтерлейкін-8, є потенційним медіатором кристально-індукованого запалення. Ревматизм артриту. 1991; 34 (7): 894–903.
ді Джовін Ф.С., Малавіста СЕ, Торнтон Е, Дафф Г.В. Кристали уратів стимулюють вироблення фактора некрозу пухлини альфа з моноцитів крові людини та синовіальних клітин. МРНК цитокінів та кінетика білка, а також клітинний розподіл. J Clin Invest. 1991; 87 (4): 1375–81.
Singh JA, Reddy SG, Kundukulam J. Фактори ризику подагри та профілактики: систематичний огляд літератури. Curr Opin Ревматол. 2011; 23 (2): 192–202.
Фрідман ДЖ, Даллал Р.М., Лорд Дж. Подагричні напади часто трапляються у хворих на шунтування шлунка після операції. Surg Obes Relat Dis. 2008; 4 (1): 11–3.
Огризло М.А. Гіперурикемія, спричинена дієтами з високим вмістом жиру та голодуванням. Ревматизм артриту. 1965; 8 (5): 799–822.
Фейнштейн Е.І., Квіон-Верде Н, Каптейн Е.М., Массі СГ. Важка гіперурикемія у пацієнтів із виснаженням об’єму. Am J Нефрол. 1984; 4 (2): 77–80.
Крейг М.Х., Пул Г.В., Хаузер С.Дж. Постхірургічна подагра. Am Surg. 1995; 61 (1): 56–9.
Кан Е.Х., Лі Е.Й., Лі Й.Й., Сонг Ю.В., Лі Е.Б. Клінічні особливості та фактори ризику післяопераційної подагри. Енн Реум Дис. 2008; 67 (9): 1271–5.
Едвардс НЛ. Клінічна подагра. Ревматологія, 6-е видання. Філадельфія, Пенсільванія: Елсевер Мосбі; 2015. с. 1569–74.
Сімкін П.А. Патогенез подагри. Ann Intern Med. 1977; 86 (2): 230–3.
Ter Maaten JC, Voorburg A, Heine RJ, Ter Wee PM, Donker AJ, Gans RO. Обробка нирок уратами та натрієм під час гострої фізіологічної гіперінсулінемії у здорових суб’єктів. Клін Сай (Лонд). 1997; 92 (1): 51–8.
Quinones Galvan A, Natali A, Baldi S, Frascerra S, Sanna G, Ciociaro D, et al. Вплив інсуліну на виведення сечової кислоти у людини. Am J Phys. 1995; 268 (1 Pt 1): E1–5.
Бобулеску І.А., Мо О.В. Нирковий транспорт сечової кислоти: еволюційні концепції та невизначеності. Adv Хронічна ниркова дис. 2012; 19 (6): 358–71.
Richette P, Doherty M, Pascual E, Barskova V, Becce F, Castaneda-Sanabria J, et al. 2016 оновлені рекомендації EULAR на основі фактичних даних щодо лікування подагри. Енн Реум Дис. 2017; 76 (1): 29–42.
Khanna D, Khanna PP, Fitzgerald JD, Singh MK, Bae S, Neogi T, et al. 2012 Американський коледж ревматологічних керівних принципів для лікування подагри. Частина 2: Терапія та протизапальна профілактика гострого подагричного артриту. Arthritis Care Res (Hoboken). 2012; 64 (10): 1447–61.
- Спростовані або суперечливі фактори ризику раку молочної залози
- Етнічні відмінності у факторах ризику ожиріння у новозеландських немовлят Journal of Epidemiology;
- Фактори, які не збільшують ризик раку молочної залози
- Подагра - характеристики, причини та лікування
- Чи впливає споживання кальцію на серцево-судинні фактори ризику та на події