Кетоз, кетогенна дієта та контроль споживання їжі: складні взаємозв’язки
Антоніо Паолі
1 Лабораторія фізіології харчування та фізичних вправ, Відділ біомедичних наук, Падуський університет, Падуя, Італія
Херардо Боско
1 Лабораторія фізіології харчування та фізичних вправ, Відділ біомедичних наук, Падуський університет, Падуя, Італія
Енріко М. Кампорезі
2 Кафедра хірургії, Університет Південної Флориди, Тампа, Флорида, США
3 TEAMHealth, Тампа, Флорида, США
Девананд Мангар
3 TEAMHealth, Тампа, Флорида, США
4 Загальна лікарня Тампа, Тампа, Флорида, США
Анотація
Хоча явище зменшення голоду, про яке повідомляється під час кетогенних дієт, добре відоме, основні молекулярні та клітинні механізми залишаються невизначеними. Було продемонстровано, що кетоз надає анорексигенний ефект за рахунок вивільнення холецистокініну (CCK), одночасно зменшуючи орексигенні сигнали, наприклад, через грелін. Однак, здається, кетонові тіла (КБ) можуть збільшити споживання їжі за допомогою фосфорилювання АМФ-активованої протеїнкінази (АМРК), гамма-аміномасляної кислоти (ГАМК) та вивільнення та вироблення адипонектину. Метою цього огляду є короткий виклад наших сучасних знань про вплив кетогенної дієти (КД) на контроль за харчовими продуктами, намагаючись об'єднати очевидно суперечливі дані в цілісну картину.
Вступ
Голод і ситість - два важливі механізми регулювання ваги тіла. Хоча люди можуть регулювати споживання їжі за власним бажанням, в центральній нервовій системі (ЦНС) існують системи, які регулюють споживання їжі та витрати енергії. Ця складна мережа, центр управління якої розподілений по різних областях мозку, отримує інформацію з жирової тканини, шлунково-кишкового тракту (ЖКТ), а також з крові та периферичних сенсорних рецепторів. На дії центрів голоду/ситості мозку впливають поживні речовини, гормони та інші сигнальні молекули. Кетонові тіла є основним джерелом енергії в періоди голодування та/або нестачі вуглеводів і можуть відігравати роль у контролі надходження їжі.
Гіпоталамічний контроль годування/апетиту/голоду
Роль поживних речовин у контролі надходження їжі
Гіпоталамус є головним центром мозку, відповідальним за контроль голоду/ситості (H/S). У теорії, яку Майер запропонував більше 60 років тому, він відводив центральну роль рівня глюкози в контролі H/S: так звана "глюкостатична теорія" (Mayer, 1955). Майер припустив, що виснаження рівня вуглеводів призводить до голоду, а гіпоталамічні центри з рецепторами, чутливими до рівня глюкози, можуть брати участь у короткочасному регулюванні споживання енергії (Mayer, 1955). «Центр живлення» у бічній гіпоталамусовій зоні (ЛГК), згідно з глюкостатичною теорією, реагує на падіння глюкози в крові між їжею та стимулює споживання їжі. LHA містить нейрони, інгібовані глюкозою, які стимулюються гіпоглікемією - процесом, що має вирішальне значення для опосередкування гіперфагії, що зазвичай спричиняється гіпоглікемією. Подальша постпрандіальна гіперглікемія активує «центр ситості» у вентромедіальному гіпоталамусі (VMH), який містить збуджені глюкозою нейрони та інгібує як «центр живлення», так і прийом їжі.
У 1953 р. Кеннеді запропонував ліпостатичну гіпотезу, припускаючи, що метаболіти ліпідів також можуть брати участь у регулюванні їжі (Kennedy, 1953), а в 1956 р. Меллінков вивчав ефекти білкового обміну, пропонуючи аміностатичну гіпотезу (Mellinkoff et al., 1956).
Глюкозочутливі нейрони виявлені в ряді областей ЦНС, включаючи центри метаболічного контролю гіпоталамуса. Медейрос та ін. ін. використовували електрофізіологію за допомогою патч-затиску, щоб дослідити, чи є нейрони в певній спеціалізованій області, відомій як субфорнічний орган (SFO), області, де гематоенцефалічний бар’єр відсутній, також чутливими до глюкози чи ні. Ці експерименти продемонстрували, що нейрони SFO реагують на глюкозу і що SFO є важливим датчиком та інтегративним центром циркулюючих сигналів енергетичного стану (Medeiros et al., 2012).
Але комплексне транскрипційне профілювання нейронів, що сприймають глюкозу, є складним завданням, оскільки глюкокіназа (Gck) та інші ключові білки, які трансдурують сигнали глюкози, експресуються на низькому рівні. Глюкоза також надає гормонально-подібну дію на нейрони; електрофізіологічні записи продемонстрували, наприклад, що гіпоглікемія активує нейрони, що вивільняють гормон росту (GHRH), вказуючи на механістичний зв'язок між низьким рівнем глюкози в крові та вивільненням гормону росту (Stanley et al., 2013).
Нейрони, чутливі до поживних речовин, що реагують на концентрацію глюкози, а також на жирні кислоти (ФК), присутні в багатьох ділянках мозку і можуть відігравати ключову роль у нервовому контролі енергії та гомеостазу глюкози. Наприклад, центральне введення олеату перешкоджає надходженню їжі та виробленню глюкози у щурів. Це свідчить про те, що ЦНС може виявляти добові коливання концентрацій FA у плазмі крові як сигнал, що сприяє регуляції енергетичного балансу (Moulle et al., 2014).
Незважаючи на те, що внутрішньоклітинний метаболізм і активація ATP-чутливих K + каналів, як видається, необхідні для деяких сигнальних ефектів FA, велика кількість реакцій FA у вентромедіальних нейронах гіпоталамусу опосередковується взаємодією з транслоказою жирних кислот (FAT)/CD36 . Транслоказа - це транспортер/рецептор FA, який активізує передачу сигналів навіть за відсутності внутрішньоклітинного метаболізму (Moulle et al., 2014).
Класична уніфікована модель базується на ролі трьох метаболічних субстратів: ліпідів, глюкози та білків/амінокислот у підтримці харчового статусу у відповідних локусах ЦНС, однак існує безліч інших сигналів та цілей мозку (Williams et al., 2001).
Роль нейроендокринної системи у контролі надходження їжі
Зовсім недавно були виявлені інші області контролю апетиту гіпоталамуса, включаючи області дугоподібного ядра (ARC), перивентрикулярного ядра (PVN) та дорсомедіального ядра гіпоталамуса (DMH) (Valassi et al., 2008). Це місця зближення та інтеграції багатьох центральних та периферійних сигналів, а не лише макроелементів, які беруть участь у механізмах споживання їжі та витрати енергії, наприклад, група нейронів ARC, що стимулює споживання їжі через нейропептид Y (NPY) та ген агуті -споріднений білок (AGRP). Ці нейрони взаємодіють з тими, що продукують анорексигенний про-опіомеланокортин (POMC) та регульований кокаїном/амфетаміном транскрипт (CART) (Williams et al., 2001). Таким чином, більш вичерпна уніфікована модель повинна включати макроелементи, а також багато одиничних амінокислот та інших сигнальних молекул.
Розрізняють два типи регулювання споживання їжі: а) короткочасні (сигнали ситості, СС), що виникають на початку та в кінці разового прийому їжі; він також включає тривалість між прийомами їжі і b) довгострокову регуляцію (сигнал ожиріння, АС), на яку впливають такі фактори, як відкладення жиру в організмі.
СС, що надають інформацію мозку, головним чином надсилають інформацію до ядра одиночного тракту (НТС). Ці сигнали генеруються в шлунково-кишковому тракті та черевних органах, а також у ротовій порожнині та забезпечують інформацію про механічні та хімічні властивості їжі. Інформація передається через блукаючий та спинномозковий нерв до NTS. АС досягають середньої висоти через ARC або через гематоенцефалічний бар'єр (BBB). Всі ці аферентні об'єднані в складну і не до кінця зрозумілу мережу.
Гормони, такі як лептин та інсулін, що виділяються в кров, відображають накопичений жир. Ці гормони можуть передавати ВВВ і стимулювати специфічні рецептори. Області гіпоталамусу багато забезпечуються аксонами від ARC, який має більші концентрації рецепторів лептину та інсуліну, ніж будь-який інший сайт гіпоталамусу (Valassi et al., 2008).
ARC здійснює протилежні дії на прийом їжі, реагуючи не тільки на лептин та інсулін, але й на гормони кишечника (найбільш вивченими є грелін та, нещодавно, PYY). Нейрофізіологічні шляхи дозволяють припустити, що годування регулюється за допомогою циклу зворотного зв’язку, де гіпоталамус забезпечує довгостроковий регуляторний вхід до NTS, який діє як заданий показник (Williams et al., 2001).
Нещодавно було висловлено думку, що ARC необхідний для координації гомеостатичних циркадних систем, включаючи температуру та активність. Автори перевірили цю гіпотезу шляхом ін'єкції сапоринового токсину, кон'югованого з лептином, в ARC щурів. Wiater та ін. показав, що чутлива до лептину мережа необхідна для захоплення активності фотичними сигналами та набору температури їжею, але не потрібна для активізації активності їжею або температури фотичними сигналами (Wiater et al., 2013).
Ще один гравець: шлунково-кишковий тракт і мікробіота кишечника
Зв’язок кишечник-мозок важливий не тільки для гормонів, що виробляються кишечником, але і для довгострокового регулювання маси тіла. Дослідження на мишах показують, що мікробіом кишечника впливає на обидві сторони енергетичного балансу, сприяючи поглинанню поживних речовин та регулюючи гени господаря, що впливають на ожиріння [однак існують суперечливі повідомлення (Parks et al., 2013; Schele et al., 2013)]. Однак залишається невизначеним, наскільки важлива мікробіота кишечника для засвоєння поживних речовин у людини. Когортне дослідження продемонструвало, що навантаження поживними речовинами є ключовою змінною, яка може впливати на вміст бактерій в кишечнику/калі протягом коротких періодів часу. Крім того, спостережувана асоціація між мікробами кишечника та поглинанням поживних речовин вказує на можливу роль мікробіоти кишечника людини в регулюванні споживання та використання поживних речовин (Jumpertz et al., 2011).
Більше того, згідно з останніми доказами, початок прийому їжі, як видається, біохімічно викликаний лише у випадку серйозного дефіциту енергії, хоча зазвичай він контролюється соціальними, культурними та екологічними факторами, суворо пов'язаними із способом життя (Karatsoreos et al., 2013).
Системний кетоз у терапії КД
Кетогенні дієти стали популярними в останні десятиліття завдяки демонструванню позитивного впливу на втрату ваги (Bueno et al., 2013), хоча точний механізм дії до кінця не вивчений (Paoli, 2014). Насправді існують суперечливі дані про КД у мишей та щурів. Насправді існують суперечливі дані про КД у мишей та щурів. Наприклад, хоча величезна кількість даних підтверджує, що КД у людей ефективно знижує вагу, покращує толерантність до ліпідемії та глюкози (Bueno et al., 2013), нещодавно було продемонстровано, що довготривала КД (22 тижні) спричиняла дисліпідемію, прозапальний стан, печінковий стеатоз, непереносимість глюкози та зменшення маси клітин бета- та альфа-клітин, все без втрати ваги у мишей (Ellenbroek et al., 2014). Слід врахувати два міркування: (1) індукція кетозу та реакція на кетоз у людини та миші досить різні і (2) миші та люди мають різний термін життя, і результати, отримані у мишей через кілька тижнів дієти, можуть відповідати до місяців на дієті у людей (Demetrius, 2005, 2006).
Незалежно від його ефективності для схуднення, середньо тривала дієта (Paoli et al., 2013) є надто обережно сприйнятою лікарями, можливо, через відсутність уваги до цієї теми на спеціалізованих курсах медичної освіти. Як результат, більшість лікарів пов'язують термін "кетоз" лише в контексті діабетичного кетоацидозу.
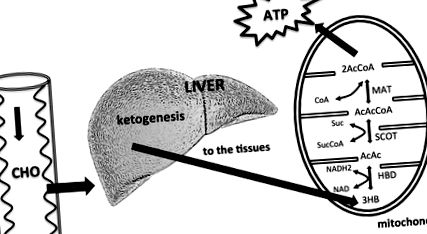
Знижена доступність дієтичних вуглеводів призводить до збільшення вироблення в печінці КБ. Печінка не може використовувати KB, оскільки їй бракує мітохондріального ферменту сукциніл-КоА: 3-кетокислоти (оксокислоти) КоА трансферази (SCOT), необхідного для активації ацетоацетату до ацетоацетил КоА. KB використовуються тканинами, особливо мозком. KB вступають у цикл лимонної кислоти після перетворення їх в ацетил КоА за допомогою гідроксибутиратдегідрогенази (HBD), сукциніл-КоА: 3-КоА трансферази (SCOT) та метилацетоацетил КоА тіолази (MAT). Змінено з Owen (2005), Paoli et al. (2014).
Таблиця 1
Рівень крові під час нормальної дієти, кетогенної дієти та діабетичного кетоацидозу (Paoli et al., 2012).
| Глюкоза (мг/дл) | 80–120 | 65–80 | > 300 |
| Інсулін (мкУ/л) | 6–23 | 6,6–9,4 | ≅ 0 |
| КБ конц (ммоль/л) | 0,1 | 7–8 | > 25 |
| рН | 7.4 | 7.4 | (Рис.3); 3); BHB індукує експресію AgRP, одночасно підвищуючи АТФ та інгібуючи фосфорилювання AMPK (Cheng et al., 2008). Більше того, Лагер та його колеги нещодавно продемонстрували, що за фізіологічних умов BHB зменшує фосфорилювання AMPK та експресію мРНК AgRP у клітинах гіпоталамусу GT1-7 (Laeger et al., 2012). |
Вплив кетонових тіл на дію АМФ-активованої протеїнкінази (АМФК) у різних тканинах.
Інші можливі механізми
Мікробіота кишечника
Відомо, що різні дієтичні компоненти справляють певний вплив на склад мікробіому кишечника, головним чином, відносно ожиріння та запальних станів. Взагалі, середземноморська дієта має позитивний ефект, тоді як дієта з високим вмістом білка, здається, має згубний ефект через явища гниття (Lopez-Legarrea et al., 2014; Flint et al., 2015). На даний момент доступно мало даних про вплив КД на мікробіоти кишечника. Наприклад, дослідження Crawford et al. (2009) досліджували регуляцію метаболізму кетонового тіла міокарда мікробіотою кишечника і продемонстрували, що під час голодування наявність мікробіоти кишечника покращує надходження кетонових тіл до серця, де окислюються KB. За відсутності мікробіоти низький рівень КБ був пов'язаний із відповідним збільшенням утилізації глюкози, але вага серця все ще була значно знижена. Зменшення маси міокарда було повністю скасовано у мишей без мікробів, яких годували кетогенною дієтою. Щодо контролю їжі, ми можемо припустити, що конкретний метаболічний стан кетозу може надати певну користь контролю над вагою та їжею через синергічну дію між виробленням бутирату кишковими бактеріями та високим вмістом кетонів у крові (Sanz et al., 2015).
Активні форми кисню
Як і у випадку з ГАМК, гіпотеза внутрішньоклітинних активних форм кисню (АФК) працює проти пригнічуючої голоду ролі КД: було продемонстровано, що збільшення АФК гіпоталамусу за допомогою оксидази НАДФН необхідне для інгібуючого дієти інсуліну ( Jaillard et al., 2009); крім того було продемонстровано, що в гіпоталамусі існує залежний від АФК сигнальний шлях, який регулює енергетичний гомеостаз, і що активація АФК-чутливих механізмів може бути достатньою для сприяння насиченню (Бенані та ін., 2007). З іншого боку, KBs зменшує вироблення АФК у мітохондріях, збільшуючи окислення NADH в дихальному ланцюзі мітохондрій (Maalouf et al., 2007).
Висновки
Хоча ефект зменшення голоду КД добре задокументований, його основні механізми дії все ще невловимі. Глобальна картина ускладнюється суперечливою роллю кетозу щодо анорексигенних та орексигенних сигналів (узагальнено на рисунку Рисунок 4). 4). Кетони (переважно BHB) можуть діяти як орексигенно, так і анорексигенно. В орексигенному механізмі він підвищує рівень циркуляції адипонектину, збільшуючи фосфорилювання ГАМК та AMPK у мозку та зменшуючи вироблення АФК у мозку. Анорексигенний механізм запускає основну нормальну реакцію на глюкозну їжу, збільшуючи циркулюючу FFA після їжі (таким чином зменшуючи загальний NPY), підтримуючи реакцію CCK на їжу та зменшуючи циркулюючий грелін. Можна припустити, що чистий баланс контрастних подразників призводить до загального зменшення відчуття голоду та споживання їжі. Потрібні додаткові дослідження для вивчення механізму потенційного сприятливого впливу КД на контроль харчових продуктів.
Схема орексигенних та анорексигенних ефектів кетозу. Зображення дуже схематичне. Детальніше див. У тексті. AMPK, AMP-активована протеїнкіназа; CCK, холецистокінін; ГАМК, гамма-аміномасляна кислота; BHB, β-гідроксимасляна кислота; FFA, вільні жирні кислоти; АФК, активні форми кисню; NPY, нейропептид Y; AgRP, білок, пов'язаний з геном агуті.
Заява про конфлікт інтересів
Автори заявляють, що дослідження проводилось за відсутності будь-яких комерційних або фінансових відносин, які можна трактувати як потенційний конфлікт інтересів.
- Кетоз Пасадена Кетогенна дієта Пасадена Кето Дієта Лос-Анджелес
- Як харчуватися всією їжею та відповідями на дієтичні запитання; КНИЖНА КНИГА "WHISTLESTOP"
- Поліпшення споживання їжі у мешканців будинків престарілих за допомогою годування Журнали геронтології
- Затверджений HCG перелік продуктів харчування фази 3 - дієта HCG
- KAYTEE Fiesta Естрадна дієтична дієта Gerbil; Харчування хом'яків, 2