Канал Mergla K + індукує атрофію скелетних м’язів, активуючи шлях протеїсоми убиквітину
Кафедра основних медичних наук, Школа ветеринарної медицини, Університет Перд'ю, Вест-Лафайєт, штат Індіана, США
Кафедра медичної хімії та молекулярної фармакології, Фармацевтичний коледж, Університет Пердью, Вест-Лафайєтт, штат Індіана, США
Департамент ветеринарних клінічних наук, Школа ветеринарної медицини, Університет Пердю, Вест-Лафайєт, штат Індіана, США
Кафедра основних медичних наук, Школа ветеринарної медицини, Університет Перд'ю, Вест-Лафайєт, штат Індіана, США
Кафедра ветеринарної патобіології, Центр раку, Університет Пердью, Вест-Лафайєтт, штат Індіана, США
Департамент наук про тварин, сільськогосподарський коледж, Університет Пердью, Вест-Лафайєт, штат Індіана, США
Департамент наук про тварин, сільськогосподарський коледж, Університет Пердью, Вест-Лафайєт, штат Індіана, США
Інститут серцево-судинної системи, Університет Пітсбурга, Пітсбург, штат Пенсільванія, США
Кафедра основних медичних наук, Школа ветеринарної медицини, Університет Перд'ю, Вест-Лафайєт, штат Індіана, США
Ці автори не менш сприяли цій роботі. Шукайте більше статей цього автора
Кафедра основних медичних наук, Школа ветеринарної медицини, Університет Перд'ю, Вест-Лафайєт, штат Індіана, США
Ці автори не менш сприяли цій роботі. Листування: Школа ветеринарної медицини, Університет Пердью, 625 Гаррісон Сент, Вест Лафайєтт, ІН 47907, США. Електронна пошта: [email protected] Шукати інші статті цього автора
Кафедра основних медичних наук, Школа ветеринарної медицини, Університет Перд'ю, Вест-Лафайєт, штат Індіана, США
Кафедра медичної хімії та молекулярної фармакології, Фармацевтичний коледж, Університет Пердью, Вест-Лафайєтт, штат Індіана, США
Департамент ветеринарних клінічних наук, Школа ветеринарної медицини, Університет Пердю, Вест-Лафайєт, штат Індіана, США
Кафедра основних медичних наук, Школа ветеринарної медицини, Університет Перд'ю, Вест-Лафайєт, штат Індіана, США
Кафедра ветеринарної патобіології, Центр раку, Університет Пердью, Вест-Лафайєтт, штат Індіана, США
Департамент наук про тварин, сільськогосподарський коледж, Університет Пердью, Вест-Лафайєт, штат Індіана, США
Департамент наук про тварин, сільськогосподарський коледж, Університет Пердью, Вест-Лафайєт, штат Індіана, США
Інститут серцево-судинної системи, Університет Пітсбурга, Пітсбург, штат Пенсільванія, США
Кафедра основних медичних наук, Школа ветеринарної медицини, Університет Перд'ю, Вест-Лафайєт, штат Індіана, США
Ці автори не менш сприяли цій роботі. Шукайте більше статей цього автора
Кафедра основних медичних наук, Школа ветеринарної медицини, Університет Перд'ю, Вест-Лафайєт, штат Індіана, США
Ці автори не менш сприяли цій роботі. Листування: Школа ветеринарної медицини, Університет Пердью, 625 Гаррісон Сент, Вест Лафайєтт, ІН 47907, США. E-mail: [email protected] Шукати більше статей цього автора
АНОТАЦІЯ
Атрофія S скелетних м’язів, зменшення вмісту скорочувального білка та м’язової сили, може бути наслідком пошкодження м’язів, захворювань, зникнення або старіння (1–4); наслідки виснаження можуть серйозно погіршити якість життя. Фізична терапія та введення факторів росту (5), інгібіторів протеолізу (6) або стимуляторів синтезу білка (7) є методами, що вивчаються для лікування атрофії; однак необхідні більш ефективні методи лікування. Шлях протеасоми убиквітину (UPP), за допомогою якого білкові субстрати деградуються (8), є важливим серед механізмів, відомих для модуляції атрофії скелетних м’язів; однак про фактори, що активують цей шлях, відомо мало.
МАТЕРІАЛИ І МЕТОДИ
Тварини Усі процедури були затверджені Комітетом з догляду та використання тварин Пердю. Мишей ND4-Swiss Webster (Harlan-Sprague, Indianapolis, IN) використовували у всіх процедурах, за винятком досліджень пухлин, на яких застосовували мишків атимуса (NCr-nu; Harlan-Sprague). Тварин розміщували в університетах Пердью, контролювали лабораторні ветеринари-тварини та забезпечували їжу та воду за бажанням.
Підвіска задньої кінцівки
Спеціальні підвісні клітини були побудовані, як описано раніше (16). Мишей поміщали в ці клітини, відпочиваючи приблизно на 30 ° нахилом голови вниз із піднятими задніми кінцівками, так що вони не могли покласти жодних навантажень на задні кінцівки. Контрольних мишей утримували в клітинах для комерційних мишей у нормальному стані несучої маси.
Індукція пухлини
Кб клітин раку стравоходу людини (7000 клітин/100 мкм середовища RPMI з 10% FBS і 1% глютаміном; 17) імплантували підшкірно (с. С.) В праву пахву мишей (n= 8; NCr ‐ nu; Harlan ‐ Sprague). Контрольні миші (n= 8) вводили транспортний засіб. Мишей зважували щотижня протягом 6 тижнів. Пухлини вимірювали цифровим штангенциркулем щотижнево.
Вестерн-блот
Для імуноблотів мембранні білки витягували з м’язів шлунково-кишкового мозку та мозку (14). Зразки імуноблотували за допомогою антитіла erg1 (Ab) (14). Після промокання мембрани фарбували 0,1% Coomassie R ‐ 250, щоб підтвердити, що зразки мембран містять однаковий білок.
Зрізи тканин і фарбування
М'язи шлунково-кишкового тракту були підготовлені та кріосекціоновані (14 мкм), як описано раніше (16). Зрізи фарбували на активність β-галактозидази (lacZ) (16) або імунозабарвлювали (16), використовуючи erg1 Ab (14), за винятком випадків, коли зазначено. Зображення зрізів були зроблені цифровою камерою Leaf Micro-Lumina (Scitex; Тель-Авів, Ізраїль). Кількість пікселів кожного перерізу м’язового волокна визначали (Adobe Photoshop 6) і перетворювали на мкм 2. Були проаналізовані два зрізи (по 50 волокон у кожному) з кожного середнього відділу м’яза.
Плазміди
Клони Mergla (10), Merg1b (10) та DN ‐ Mergla (G628S; 15) знаходились у pBK/цитомегловірусі (CMV). Уцивілізована люцифераза світлячка (Ub-FL) у pGL ‐ 3/CMV була подарована доктором Девідом Півникою-Вормсом (18; Вашингтонський університет, Сент-Луїс, Міссурі). CMV ‐ nlacZ у векторі pNL був придбаний у Centre Commercial de Gros (Тулуза, Франція). PHRL синтетичний Ренілла репортерний вектор люциферази (RL) був придбаний у ProMega (Madison, WI).
Електропорація
Мишей знеболювали 0,01 мкл/мг маси тіла ксилазину (1 мг/мл) та кетаміну (9 мг/мл) у стерильному фізіологічному розчині. Гастрокнеміальним м’язам поголених задніх кінцівок вводили плазміди та електропорували 8 імпульсів при 200 В/см протягом 20 мс при 1 Герці (19) із позаклітинною матрицею (ECM) 830 ElectroSquare Porator (BTX; Hawthorne, NY).
Ланцюгова реакція з зворотною транскрипцією (RT-PCR)
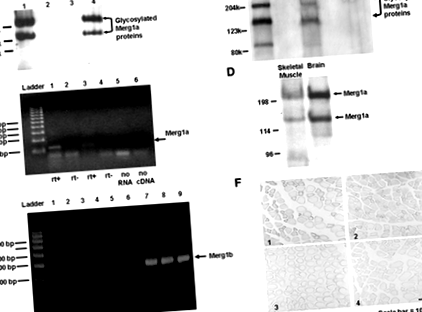
RT-PCR проводили, як було описано раніше (16), за винятком того, що забруднюючу ДНК видаляли із загального екстракту РНК двома 10-хвилинними обробками DNase I (ProMega). Повторювані зразки РНК піддавали дії або зворотної транскриптази, або лише впливу носія. Шаблон контрольних зразків не отримував РНК. Продукт зворотної транскрипції ампліфікували за допомогою ПЛР, поєднували з бромідом етидію та електрофорезували на 2% агарозному гелі. Грунтовками для Mergla були: 5′– CGC AGA ACA CCT TCC TCG ACAC ‐ 3 ′ (вперед) і 5′– GCA GAA GCC GTC GTT GCA GTA G - 3 ′ (реверс). Праймери для Merg1b були: 5′‐ AGT CCT CCA TGG CGA TTC - 3 ′ (вперед) і 5 ′ - GGC CTG CAG CTT ATA CTC - 3 ′ (реверс).
Астемізол (Сігма, Сент-Луїс, Міссурі)
Антигістамінний астемізол (20) суспендували у воді.
Мишей знеболювали 240 мг/кг маси тіла внутрішньовенно. ін'єкція 20 мг/мл авертину (2, 2, 2-триброметанолу; Sigma) у розчині 1,25% трет-амілового спирту у фізіологічному розчині (21). Стандартну ЕКГ свинцю II було отримано шляхом розміщення голкових електродів 18-го калібру s.c. у правої передньої ноги (-), лівої задньої ноги (+) та правої задньої ноги (землі). ЕКГ реєстрували (3 хв) за допомогою багатоканальної системи фізіологічного запису Biopac MP100 (Biopac Systems Inc; Goleta). Інтервали QT вимірювали та коригували на частоту серцевих скорочень за формулою: QTC = QTo/(RRo/100) 0,5 (22).
Подвійний аналіз репортера люциферази
Набір для аналізу подвійної люциферази (Promega) використовували відповідно до інструкцій виробника. Люцифераза світлячка і Ренілла люцифераза (Р.L) активність вимірювали люмінометром TD ‐ 20/20 (Promega).
Статистика
Дані були проаналізовані ANOVA для повністю рандомізованого дизайну. Коли були знайдені суттєві відмінності, засоби відокремлювались захищеною різницею найменшої значущості Фішера. Всі дані були проаналізовані із застосуванням Загальної лінійної модельної процедури SAS. Заяви про значущість базувалися на P‐ Рівні, як зазначено.
РЕЗУЛЬТАТИ
Експресія пухлини індукує синтез і атрофію Мергла в скелетних м’язах
Через шість тижнів після ін'єкції пухлинних клітин середня маса мишей, що несуть пухлину (мінус вага пухлини), була на 10,8% (P≤0,005) менше, ніж у контрольних мишей. Миші, що експресують пухлину, мали 18% (P≤0,001) нижчий коефіцієнт масової маси тіла до тіла (1,10 ± 0,019%, сем), ніж у контрольних мишей (1,34 ± 0,018%, сем), демонструючи, що миші, що несуть пухлину, втрачали м’язову масу. Середня площа поперечного перерізу м’язових волокон (csa) м’язів лівого шлунково-кишкового тракту від мишей, що несуть пухлину, була на 25% менше (P≤0,05), ніж у контрольних мишей (1445,8 ± 103,8 мкм 2 сем проти. 1925,0 ± 161,6 мкм 2 сем відповідно), демонструючи, що миші, що несуть пухлину, зазнали атрофії скелетних м'язів. Вестерн-блот-аналіз вилучених мембранних білків виявив два білки Mergla в кахектичних скелетних м’язах миші, як повідомлялося раніше в мозку та серці (14; Рис. 1А). У контрольній тканині не виявлено білка каналу Merg1 (рис. 1А).
Підвіска задньої кінцівки призводить до атрофії та синтезу Mergla в скелетних м’язах
Електропорація призводить до експресії плазмідної ДНК
Лівим шлунково-м’язовим м’язам 14 мишей вводили експресійну плазміду, що кодує Mergla (30 мкг; 10), тоді як ліві шлунково-м’язові м’язи інших 14 мишей отримували експресійну плазміду, що кодує Merg1b (30 мкг; 10). Правим гастрокнеміусам усіх мишей вводили експресійну плазміду, що кодує lacZ (30 мкг; 10). Шлунково-м’язові м’язи електропорували, щоб полегшити поглинання плазміди (19). Через 7 днів білки Mergla (14) були виявлені в м'язах, що вводяться Mergla, за допомогою Вестерн-блот-аналізу; ці білки не були виявлені в контрольному м'язі (Рис. 2А). Білок Merg1b був виявлений трохи вище 95 кДа в м'язах, яким вводили плазміду Merg1b; цей білок відсутній у контрольних м’язах (рис. 2Б).
Експресія Мергла у мишей, що несуть wt, викликає атрофію скелетних м’язів
Лівим гатрокнеміальним м’язам 14 мишей вводили lacZ (20 мкг) та контрольну (40 мкг) експресійну плазміду. Праві шлунково-м’язові м’язи семи з цих мишей були введені спільно з Mergla (20 мкг; 10), lacZ (20 мкг) та контрольними плазмідами експресії ДНК pBK/CMV (20 мкг). Праві шлунково-м’язові м’язи решти мишей (n = 7) були введені разом з трьома експресійними плазмідами, кожна з яких кодує або: Mergla (20 мкг; 10), lacZ (20 мкг), або домінантно-негативний мутант Mergla (DN Mergla; 20 мкг; 15). Продукт гена DN Mergla - мутант пор, який транспортується до клітинної мембрани, але перешкоджає провідності струму Merg1 (15). Миші залишалися несучими. Через сім днів після електропорації волокна гастрокнеміуса, що експресують Mergla та lacZ (сині волокна), зазнали значного зменшення м'язових волокон CSa на 16,3% порівняно з волокнами, введеними лише з плазмідою lacZ (Рис. 3A1, 2; B1, 2). Блокада функції Мергла Д. Н. Мерглою запобігла всім атрофіям, крім 6,7%, викликаним експресією Мергла (рис. 3A1, 3; B1, 3). Цей неповний порятунок не дивно, оскільки навряд чи всі випадково зібрані канали міститимутантну субодиницю мутантного каналу.
Блок функції Мергла пригнічує атрофію скелетних м’язів, спричинену суспензією задніх кінцівок
Ектопічна експресія Merg1b у шлунково-м’язовому м’язі не викликає атрофії
Лівим шлунково-м’язовим м’язам семи мишей вводили експресійну плазміду lacZ (20 мкг) і контрольну експресійну плазміду (30 мкг), тоді як праві гастрокнемії отримували експресійну плазміду lacZ (20 мкг) та плазміду експресії Merg1b (30 мкг; 10). Через сім днів після електропорації (19) не спостерігалося суттєвої різниці в клітині csa контрольного м'яза, що експресує лише lacZ (2456 ± 13 мкм 2, сем), та у тих, що експресують lacZ та Merg1b (2449 ± 16 мкм 2, сем). Цей висновок свідчить про те, що індуковане Merg1 значне зменшення розміру волокна є специфічним для варіанту 1a.
Крива доза-відповідь астемізолу
Три групи з трьох мишей кожну давали раз на 12 год суспензією астемізолу, потужного блокатора каналів erg1 (20); з отриманням 80, 160 або 320 мг/кг маси тіла. Контрольну групу оцінювали рівним об'ємом. води. ЕКГ та вагу тварин вимірювали щодня. До сьомого дня лікування виправлені інтервали QT (QTc, 22) у всіх оброблених тварин були значно довшими (P≤0,02), ніж у контрольної групи, демонструючи, що препарат блокував канал Merg1 у серці. Оскільки втрати маси були мінімальними, а подовження інтервалу QTc максимальним, у дослідженні суспензії використовували 160 мг/кг.
Лікування астемізолом пригнічує атрофію у підвішених на задніх кінцівках мишах і збільшує розмір м’язів у контролів, що несуть масу
| Група 1: Контроль | 7,0 ± 0,12 а | 0,19 ± 0,006 а | 0,58 ± 0,033 а | 28,2 ± 0,5 а | 1900 ± 29,4 а |
| Група 2: Астемізол | 5,9 ± 0,6 а | 0,21 ± 0,005 b | 0,66 ± 0,015 b | 27,9 ± 0,4 а | 2025 ± 24,8 b |
| Група 3: Підвіска | -7,0 ± 1,5 c | 0,17 ± 0,160 c | 0,59 ± 0,018 а, c | 26,0 ± 0,9 b | 1610 ± 32,8 с |
| Група 4: Астемізол та суспензія | −4,2 ± 0,06 b | 0,19 ± 0,005 а | 0,63 ± 0,010 б, c | 29,8 ± 0,8 с | 1841 ± 29,4 а |
- Дані подаються як середні значення ± se. Заяви про значущість базуються на P ≤ 0,05. Статистичних відмінностей між групами, позначеними однаковою літерою в колонці, немає. Різні літери вказують на значні відмінності в колонці. QTc подібні до тих, що повідомляються для мишей, знеболених авертином (21).
Експресія Мергла індукує активність UPP
Індукція діяльності UPP є специфічною для Мерґли
Обидві шлунково-м’язові м’язи 12 мишей були введені разом з Ub-FL (40 мкг; 18) та Р.Експресійні плазміди L (10 мкг). Праві шлунково-м’язові м’язи шести з цих мишей були введені разом з експресійною плазмідою Mergla (30 мкг; 10), тоді як праві м’язи шлунково-кишкового тракту решти шести мишей були введені з експресійною плазмідою Merg1b (30 мкг; 10). Ліві шлунково-м’язові м’язи отримували відповідну контрольну плазміду (30 мкг). Через сім днів після електропорації (19) ектопічна експресія Mergla суттєво збільшила активність UPP, про що свідчить зменшення (на 80%) відносної активності Ub-FL (рис. 4B1, 2); однак, ектопічна експресія Merg1b не збільшила активність UPP, що продемонстровано незначним (9,4%) зменшенням відношення Ub-FL-до-RL (рис. 4A1, 3), кількість, яка може бути результатом спільного складання субодиниці Merg1b з низький рівень ендогенної Мергли. Дані показують, що Mergla, а не Merg1b, особливо збільшує активність UPP.
ОБГОВОРЕННЯ
- Механізми специфічності волокнистої атрофії скелетних м’язів
- Кето дієта набирає м’язи і втрачає жир
- Як втратити жир на животі для гарної мускулатури; Фітнес
- Як втратити жир і набрати м’язи одночасно Gro-Fit
- Як втратити найбільше жиру та побудувати найбільше м’язів за 30 днів - нарощування м’язів