Явища карбонільного стресу під час хронічного зараження Opisthorchis felineus
Ірина Василівна Салтикова
Центральна науково-дослідна лабораторія Сибірський державний медичний університет, Московський тракт, 2, Томськ, 634050, Томськ, Російська Федерація
b Лабораторія каталітичних досліджень, вул. Аркадія Іванова, 49, 634050, Томськ, Томський державний університет, Російська Федерація
c Науково-дослідний центр знехтуваних хвороб бідності, Департамент мікробіології, імунології та тропічної медицини, Школа медицини та медичних наук, Університет Джорджа Вашингтона, Росс Холл, 2300 I Street, NW, Вашингтон, округ Колумбія, 20037 США
Людмила М. Огородова
Центральна науково-дослідна лабораторія Сибірський державний медичний університет, Московський тракт, 2, Томськ, 634050, Томськ, Російська Федерація
Володимир Васильович Іванов
Центральна науково-дослідна лабораторія Сибірський державний медичний університет, Московський тракт, 2, Томськ, 634050, Томськ, Російська Федерація
Олександр О. Богданов
Центральна науково-дослідна лабораторія Сибірський державний медичний університет, Московський тракт, 2, Томськ, 634050, Томськ, Російська Федерація
Олена Геренг
Центральна науково-дослідна лабораторія Сибірський державний медичний університет, Московський тракт, 2, Томськ, 634050, Томськ, Російська Федерація
Катерина. Періна
Центральна науково-дослідна лабораторія Сибірський державний медичний університет, Московський тракт, 2, Томськ, 634050, Томськ, Російська Федерація
Пол Дж. Бріндлі
c Науково-дослідний центр знехтуваних хвороб бідності, Департамент мікробіології, імунології та тропічної медицини, Школа медицини та медичних наук, Університет Джорджа Вашингтона, Росс Холл, 2300 I Street, NW, Вашингтон, округ Колумбія, 20037 США
Олексій Є. Сазонов
Центральна науково-дослідна лабораторія Сибірський державний медичний університет, Московський тракт, 2, Томськ, 634050, Томськ, Російська Федерація
d Московський державний університет імені Ломоносова, 1, Ленінські гори, Москва, 119991, Російська Федерація
Пов’язані дані
Анотація
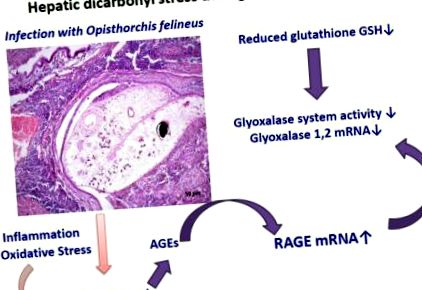
Графічний реферат
1. Вступ
Opisthorchis felineus та O. viverrini - тісно пов’язані між собою рибні зоонозні дигенейські трематоди, які вражають людей та різних інших ссавців, що харчуються рибою. O. viverrini залишається важливою проблемою охорони здоров’я в ендемічних районах Південно-Східної Азії, де заражено понад 40 мільйонів людей [1-3]. Висока поширеність інфекції O. felineus була описана для Східної Європи (Україна та європейська частина Росії), Північної Азії (Сибір) та Центральної Азії (північ Казахстану) [4]. Випадки зараження O. felineus також зростають у Західній Європі, зокрема в Італії, Німеччині та Португалії [5-7].
Ускладнення опісторхозу виникають внаслідок закупорки жовчних проток. Непрохідність внутрішньопечінкових жовчних проток може перерости в піогенний холангіт, абсцес печінки та гепатит. Підвищені показники смертності після операцій на печінці розглядаються під час зараження O. felineus як наслідок ураження печінки та жовчовивідних шляхів, пов’язаного з інфекцією [8,9]. Молекулярні механізми, що лежать в основі патологічних змін печінки під час хронічного опісторхозу, заслуговують подальшого дослідження.
Метаболізм вуглеводів трематодами використовує гліколіз [10]. Метилгліоксаль (MGO), реакційноздатна дикарбонільна сполука, є неминучим побічним продуктом гліколізу. Метаболізм печінкової сірки та отримані метаболіти - не єдине можливе джерело МГО під час опісторхозу. Крім того, реагуючі глікуючі сполуки, такі як MGO та гліоксаль, також можуть утворюватися під час окисного стресу та перекисного окислення ліпідів [11,12] під час запалення, пов’язаного з опісторхозом. MGO може реагувати з різними макромолекулами (ліпіди, білки, нуклеїнова кислота), утворюючи вдосконалені гліковані продукти (AGE). AGE викликають пошкодження через зв'язування з рецепторами AGE на поверхні клітини, найкращим із яких є RAGE, рецептор для просунутих кінцевих продуктів глікування [13]. Ферментативна система гліоксалази складається з гліоксалази 1 (Glo1) та гліоксалази 2 (Glo2); Glo1 нейтралізує MGO. У присутності відновленого глутатіону (GSH) MGO спонтанно утворює гемітіоацеталь. Glo1 каталізує ізомеризацію гемітіоацеталу до S-D-лактоїлглутатіону, який, у свою чергу, перетворюється в D-лактат Glo2 [14-16].
Ми припускаємо, що опісторхоз пов'язаний з утворенням MGO та карбонільного стресу печінки та жовчовивідних шляхів. Щоб покращити розуміння цих систем у патогенезі опісторхозу, тут ми дослідили аспекти системи гліоксалази та RAGE під час хронічного зараження хом'яків О. felineus.
2 методи
2.1. Матеріали
Розчинники для ВЕРХ, глутатіон (GSH), забуференний фосфатом фізрозчин (PBS), фосфатний натрієвий буфер (NaH2PO4) та інші хімічні речовини були отримані від Fisher Scientific (Пітсбург, Пенсільванія, США); етиламінодіамінтетраоцтова кислота (EDTA), 5,5′-дитио-біс (2-нітробензойна кислота) DTNB, MGO та S-D/L-лактоїлглутатіон були від Sigma-Aldrich (Сент-Луїс, Міссурі, США).
2.2. Хом'яки
2.3. Гістологічний аналіз
Резецированную тканину печінки фіксували у 10% забуференному формаліні та вкладали у парафін. Тканину розрізали на товщину 4-5 мкм, переносили на предметне скло мікроскопа і фарбували гематоксиліном та еозином. Зрізи забарвлених тканин печінки розглядали під оптичним мікроскопом (Axiostar plus, Carl Zeiss).
2.4. Загальна екстракція РНК, синтез кДНК та ПЛР-праймери
2.5. Глутатіон
Рівні глутатіону (та активності гліоксалази-1 та -2, нижче) вимірювали у зразках печінки від кожного з 12 заражених та шести неінфікованих хом'яків на кожному з 8, 12, 24, 36, 48 тижнів зараження. Заморожені зразки печінки гомогенізували з 10 обсягами крижаного 0,1 М фосфату калію (рН 7,4), що містить 1% Triton X-100, і лізат освітлювали центрифугуванням при 20000 g протягом 15 хв при 4 ° C. Рівні глутатіону (GSH) у надосадовій рідині визначали за допомогою спектрофотометрії, як описано [18]. GSH відновлює DTNB до 5-тіонітробензойної кислоти (TNB), яка має жовтий колір. Поглинання, виміряне при 412 нм, прямо пропорційне концентрації GSH. Абсорбцію стандартів у концентрації від 25 до 100 мг/дл GSH визначали для встановлення стандартної кривої, після чого рівні GSH у зразках печінки визначали шляхом інтерполяції зі стандартної кривої.
2.6. Гліоксалаза-1 та -2 активність у печінці
Активність Glo1 вимірювали в гомогенатах печінки за допомогою спектрофотометричного методу [19]. 2,0 мМ MGO та 2,0 мМ GSH у 50 мМ фосфаті натрію, рН 6,6, попередньо інкубували протягом 10 хв при 37 ° C з утворенням гемітіоацеталю. Активність Glo1 визначали шляхом вимірювання утворення S-D-лактоїлглутатіона при 240 нм. Коефіцієнт поглинання, використаний для утворення S-D-лактоїлглутатіону, становив 2,86 мМ -1 см -1. Одиницю активності визначали як кількість ферменту Glo1, необхідну для каталізу утворення 1 мкмоль/хв S-D-лактоїлглутатіона.
Активність Glo2 оцінювали при 25 ° C після збільшення поглинання за рахунок гідролізу S-D-лактоїлглутатіону шляхом титрування утворення GSH у присутності DTNB при 412 нм [20]. Одну активність визначали як кількість Glo2, необхідну для каталізу гідролізу 1 мкмоль/хв S-D-лактоїлглутатіона.
2.7. Статистичний аналіз
Статистичний аналіз проводили за допомогою IBM SPSS Statistics для Windows, версія 21.0 (Armonk, NY: IBM Corp.). Усі параметри розглядались як непараметричні дані. Дані повідомлялись як середній та міжквартильний діапазони. Для порівняння двох незалежних груп даних був використаний тест Манна – Уітні. Значення P ≤ 0,05 вважали значущими.
3. Результати
3.1. Міра стабільності (М) еталонних генів
За допомогою geNorm ми проаналізували три референтні гени-кандидати. GAPDH був найменш стабільним геном печінки хом'ячка в контексті зараження O. felineus (дані не представлені). Для нормалізації використовували два гени, ACTB, GUSB.
3.2. Glo1, Glo2, вираз RAGE
Через вісім тижнів після зараження зниження експресії мРНК, що кодує GLO1, у печінці хом'яка під час зараження O. felineus було очевидним порівняно з контрольними, неінфікованими хом'ячками (Р = 0,014). Експресія GLO2 знижувалася на 8, 12, 24 та 36 тижнях зараження, тоді як експресія RAGE була вищою у печінці заражених хом'яків (порівняно з неінфікованими тваринами) протягом усього експерименту, на кожному з 8, 12 тижнів, 24, 36 та 48 після зараження (рис. 1).
Аналіз експресії генів за допомогою кількісної ПЛР у режимі реального часу (RT-qPCR) гліоксалази 1 (GLO1) (A) та 2 (GLO2) (B) та RAGE (C) у печінці контрольних та інфікованих хом'яків. Калібровані нормалізовані відносні величини (CNRQ), визначені за допомогою програмного забезпечення qbase plus. Дані представлені у середньому та міжквартильному діапазонах. * Суттєві відмінності (P ≤ 0,05) були помітні між контрольною (відкриті смуги) (n = 6) та інфікованими групами (сірі смуги) (n = 12).
3.3. Активність системи гліоксалази
Активність Glo1, Glo2 знижувалась через вісім та 12 тижнів після зараження у хом'яків, тоді як підвищена активність Glo1 спостерігалася на 24 тижні після зараження (P = 0,047). Різниці в активності Glo1 та Glo2 на пізній стадії інфекції, на 36 та 48 тижнях після зараження, не було виявлено порівняно з контрольними неінфікованими хом'ячками (рис. 2). MGO детоксикується через систему гліоксалази в залежності від GSH, і, відповідно, ми проаналізували рівні GSH. Рівень GSH в печінці був нижчим у заражених хом'яків через вісім тижнів після зараження (рис. 3).
Активність печінкових ферментів Glo1 (A) та Glo2 (B). Дані представлені у середньому та міжквартильному діапазонах. * Значні відмінності (P ≤ 0,05) між контролем (відкриті смуги) (n = 6) та зараженою групою (сірі смуги) (n = 12).
Концентрація глутатіону в печінці (GSH). Дані представлені у середньому та міжквартильному діапазонах. * Очевидні суттєві відмінності (P ≤ 0,05) між контрольною (відкриті смуги) (n = 6) та інфікованими групами (сірі смуги) (n = 12).
3.4. Гістопатологічні зміни
Патологічних змін у печінці контрольних хом'яків протягом періоду дослідження не було. Навпаки, основні ураження у хом'яків виявилися через вісім тижнів після зараження. Сюди входили холангіт, розширення жовчних проток, гіперплазія слизової та лімфоплазмацитарна інфільтрація. Більше того, проліферація жовчних проток була виражена як через 12, так і через 24 тижні після зараження. Гістопатологічні дані після 36 тижня зараження виявили гіперплазію епітелію жовчних проток з метаплазією келихоподібних клітин. Перидуктальний фіброз із холангітом був очевидний починаючи з 24 тижня зараження і далі. На малюнку 4 представлені мікрофотографії, репрезентативні опісторхозу, індукованої гістопатологією, разом із контрольним зображенням від неінфікованого контрольного хом'яка. Хоча іноді інші повідомляли про передракові ураження або навіть холангіокарциному у хом'яків гризунів після хронічної інфекції [21], ми не спостерігали жодної маси пухлини у цих хом'яків з давніми інфекціями.
Гістологічний аналіз тканин печінки хом'ячка (А) контрольної печінки (8 тижнів); (B) печінка зараженого хом'яка через 8 тижнів після зараження; бар = 50 мкм; (C) печінка зараженого хом'яка через 8 тижнів після зараження; бар = 100 мкм; (D) печінка зараженого хом'яка через 24 тижні після зараження; бар = 100 мкм; (E) печінка зараженого хом'яка через 36 тижнів після зараження; бар = 100 мкм; (F) печінка зараженого хом'яка через 48 тижнів після зараження; бар = 100 мкм. Репрезентативні анатомо-патологічні орієнтири вказуються, як показано нижче, з номерами анотацій на мікрофотографіях: 1. Жилка, неінфікований хом'як; 2. Жовчний проток, неінфікований хом'як; 3. Печінковий набій (дорослий глист), що мешкає в просвіті жовчної протоки через вісім тижнів після зараження; 4. Холангіт; 5. Розширення жовчної протоки та гіперплазія слизової; 6. Дифузна перибіліарна інфільтрація поліморфними одноядерними клітинами з еозинофілами; 7. Перидуктальний фіброз; 8. Пролиферація жовчної протоки (мостиковий малюнок).
4. Обговорення
Тут ми описали явища карбонільного стресу під час хронічного зараження хом'яків О. felineus. Експресія GLO1 знизилася на восьмому тижні зараження, а каталітична активність також знизилася на 8 та 12 тижнях після зараження, а експресія GLO2 зменшилась до 36 тижнів після зараження, що пов'язано зі зниженням активності ферменту через 8 та 12 тижнів після інфекція. Рівні GSH в інфікованій печінці знижувались на 8 тижні зараження, тоді як рівень РНК RAGE був помітно підвищений під час експериментальної інфекції тривалістю близько одного року. Ці висновки нагадують ситуацію під час шистосомозу: рівень GSH зростає в легенях та селезінці на 4 та 6 тижні, але знижується на 8-10 тижнях після зараження Schistosoma heematobium. Зниження рівня GSH спостерігалося також у сечових міхурах через 8 і 10 тижнів після зараження [22].
На основі цих висновків ми припускаємо, що в печінці спостерігається дикарбонільний стрес під час хронічного опісторхозу. Дікарбонільний стрес може бути посередником ожиріння та резистентності до інсуліну [36], а карбонільний стрес, як відомо, відіграє важливу роль у патогенезі діабету [12]. Існують дискусії щодо взаємозв'язку між цукровим діабетом та розвитком холангіокарциноми у людей, інфікованих відповідним печінковим ритмом, O. viverrini [37]. Підсумовуючи, інгібування системи гліоксалази та накопичення MGO на ранніх стадіях зараження цими печінковими сипами представляє механізм, який потенційно може призвести до настання інсулінорезистентності під час опісторхозу.
Основні моменти
Інфікування хом'яків описторхісом котячим, спричиненим утворенням печінкового метилгліоксалю та карбонільним стресом
На початку хронічної інфекції глутатіон печінки виявився зниженим, але згодом повернувся до нормального рівня
Інфекція тимчасово пригнічувала систему гліоксалази, тоді як рівень РНК РАЖ був конститутивно підвищений
- Сприятливі наслідки обмеження вуглеводів з їжею при хронічному пульмоналі - ScienceDirect
- Антибіотики для зараження ран - PlushCare
- Сприятливий короткочасний ефект дієти з низьким вмістом білка на прогресування хронічних захворювань нирок у пацієнтів
- Найкраще масло CBD для спостерігачів тривоги, депресії та стресу
- 5 підказок щодо способу життя з хронічним мієлоїдним лейкозом (ХМЛ) - де оздоровлення; Культура Connect