Інозин зменшує запалення і покращує виживання при мишачих моделях коліту
Inotek Pharmaceuticals, Беверлі, штат Массачусетс 01915; і
Inotek Pharmaceuticals, Беверлі, штат Массачусетс 01915; і
Кафедра хірургії Університету медицини та стоматології - Медична школа Нью-Джерсі, Ньюарк, Нью-Джерсі 01703
Кафедра хірургії Університету медицини та стоматології - Медична школа Нью-Джерсі, Ньюарк, Нью-Джерсі 01703
Кафедра хірургії Університету медицини та стоматології - Медична школа Нью-Джерсі, Ньюарк, Нью-Джерсі 01703
Inotek Pharmaceuticals, Беверлі, штат Массачусетс 01915; і
Inotek Pharmaceuticals, Беверлі, штат Массачусетс 01915; і
Кафедра хірургії Університету медицини та стоматології - Медична школа Нью-Джерсі, Ньюарк, Нью-Джерсі 01703
Inotek Pharmaceuticals, Беверлі, штат Массачусетс 01915; і
Анотація
Інозин, природний пурин, що утворюється в результаті розпаду аденозину, нещодавно було доведено, що він надає потужну протизапальну дію як in vivo, так і in vitro. У цьому дослідженні інозин оцінювали як потенційну терапію коліту. Коліт індукували у мишей введенням декстрансульфату натрію (DSS). Пероральне лікування інозином розпочинали або до початку коліту, або як післялікування після встановлення коліту. Оцінку пошкодження товстої кишки та запалення визначали грубо (маса тіла, ректальна кровотеча), гістологічно та біохімічно (рівні MPO, MDA та цитокінів у товстій кишці). DSS-індукований коліт значно посилював запальну інфільтрацію клітин у товсту кишку. Індукований DSS коліт також підвищував рівень перекисного окислення ліпідів у товстій кишці, цитокінів та хемокінів. Інозин захищав товсту кишку від DSS-індукованої запальної інфільтрації клітин та перекисного окислення ліпідів. Інозин також частково знижував ці параметри в експериментальній моделі встановленого коліту. Таким чином, лікування інозином може бути потенційною терапією коліту.
Реагенти були отримані з наступних джерел: DSS (40 000 МВт) - від ICN Pharmaceuticals; інозин, MPO людини, 1,1,3,3-тетраметоксипропан, тіобарбітурова кислота, додецилсульфат натрію, тетраметилбензидин, гексадецилтриметиламмоній бромід та перекис водню були від Sigma (Сент-Луїс, Міссурі); Миші BALB/c походили з ферм Taconic (Germantown, NY); і специфічні набори ELISA для цитокінів були від R&D Systems (Міннеаполіс, Міннесота).
Індукція коліту та лікування.
Для цих досліджень використовували самців мишей BALB/c, вік 8 тижнів, вагою 20–23 г. Тварин розміщують у приміщеннях із контрольованою температурою та циклом світло-темрява протягом 48 год перед початком експериментальних протоколів. Усі експерименти на тваринах проводились відповідно до «Посібника з догляду та використання лабораторних тварин» [Публікація DHEW № (NIH) 85–23, переглянута 1985 р., Доповіді Управління науки та охорони здоров’я, DRR/NIH, Бетесда, MD 20205 ] та із схвалення Інституційного комітету з догляду та використання тварин Inotek.
Мишей протягом усього експерименту годували 5% DSS, молекулярна маса 30–40 кДа, розчинена у дистильованій воді ad libitum (31). Інозин вводили або перорально, або інтраперитонеально двічі на день. Контрольних мишей обробляли носієм, який був або водою для перорального протоколу експерименту з інозином, або сольовим розчином для протоку експерименту з внутрішньочеревинним інозином. Для відкладених експериментів з обробкою інозину мишам давали носій до дня початку обробки інозином. Інозин вводили в дозах від 25 до 200 мг · кг −1 · день -1, і він базувався на нещодавніх дослідженнях тестування інозину на моделях запалення гризунів (14, 18, 25). Прийом розчину DSS контролювався протягом експериментів і виявилося незмінним серед експериментальних груп (дані не наведені).
Оцінка тяжкості коліту та впливу наркотиків.
Параметрами, зафіксованими в експериментах, були маса тіла, довжина товстої кишки, летальність та кровотеча з прямої кишки, визначені очним оглядом. Мишей зважували дні 1 і 10з подальшою індукованою колітом зміною ваги, вираженою у відсотках від початкової ваги. Мишей вбивали вивихом шийки матки, а товсту кишку резекували між ілеоцекальним з’єднанням і проксимальною прямою кишкою, близько до її проходу під малим тазом. Товсту кишку розміщували на невсмоктуючій поверхні і вимірювали лінійкою. Біопсії товстої кишки брали для гістологічного та біохімічного аналізу. Одну біопсію фіксували у 15% формальдегіді, вкладали у парафін та розрізали (зрізи 4 мкм). Потім зрізи фарбували гематоксиліном та еозином та переглядали дослідником (сліпим) та оцінювали ступінь тяжкості запалення (0 = відсутність, 1 = легка, 2 = середня та 3 = важка) та ступінь (0 = відсутність, 1 = слизова, 2 = слизова і підслизова, і 3 = трансмуральна), а також пошкодження крипти (0 = відсутні, 1 = базальна 1/3, 2 = базальна 2/3, 3 = крипти, що втратили наявний епітелій, і 4 = крипти та поверхневий епітелій втрачено), тут представлені репрезентативні розділи.
Діяльність MPO.
Біопсії товстої кишки гомогенізували (50 мг/мл) у 0,5% гексадецилтриметиламонію броміду в 10 мМ MOPS і центрифугували при 15000 g протягом 40 хв. Потім суспензію тричі обробляли ультразвуком протягом 30 с. Аликвоту надосадової рідини (20 мкл) змішували з розчином 1,6 мМ тетраметилбензидину та 1 мМ перекису водню. Активність вимірювали спектрофотометрично як зміну поглинання при 650 нм при 37 ° С, використовуючи зчитувач мікропланшетів Spectramax (Molecular Devices, Саннівейл, Каліфорнія). Результати виражаються як міліодиниці активності MPO на міліграм білка, які визначали за допомогою аналізу Бредфорда.
Аналіз малондіальдегіду.
Освіта малондіальдегіду використовували для кількісного визначення перекисного окислення ліпідів у товстій кишці та вимірювали як речовину, що реагує на тіобарбітурову кислоту. Тканини гомогенізували (100 мг/мл) у 1,15% буфері KCl. Потім двісті мікролітрів гомогенатів додавали до реакційної суміші, що складається з 1,5 мл 0,8% тіобарбітурової кислоти, 200 мкл 8,1% додецилсульфату натрію, 1,5 мл 20% оцтової кислоти (рН 3,5) та 600 мкл дистильованої H2O. Потім суміш нагрівали при 90 ° С протягом 45 хв. Після охолодження до кімнатної температури зразки очищали центрифугуванням (10000 g, 10 хв) і їх поглинання вимірювали при 532 нм, використовуючи 1,1,3,3-тетраметоксипропан в якості зовнішнього стандарту. Рівень пероксидів ліпідів виражали у вигляді наномолей MDA на міліграм білка (аналіз Бредфорда).
Рівні цитокінів товстої кишки.
Третю біопсію товстої кишки видалили та заморозили у рідкому азоті, а потім зразок гомогенізували у 700 мкл буфера Tris · HCl, що містить інгібітори протеази. Зразки центрифугували протягом 30 хв і супернатант заморожували при -80 ° C до аналізу. Рівні цитокінів визначали за допомогою ІФА.
Статистичний аналіз.
Результати представлені як середні значення ± SE; статистичний аналіз проводився з використанням одностороннього ANOVA з подальшим множинним порівнянням Стьюдента-Ньюмена-Кельса після спеціального аналізу, точного тесту Фішера, Манна-Уітні U-тест, або аналіз виживання Каплана-Мейєра, за необхідності, з a P значення –1 · день –1 інозину внутрішньочеревно, відповідно. Подібним чином ректальна кровотеча була значно зменшена з 60 до 10 та 0%. Ми також досліджували рівні MPO та MDA в товстій кишці; в обох випадках інозин значно знижував рівень порівняно з тваринами, які отримували лікування. Рівні MPO знижувались з 337 ± 60 до 101 ± 21 та 69 ± 16 мО/мг білка при обробці інозином 100 або 200 мг · кг −1 · день -1. Подібним чином, рівні MDA знижувались з 3,5 ± 0,5 до 1,9 ± 0,3 нмоль/мг білка з 200 мг · кг −1 · день –1 інозину. Рівень МДА в товстій кишці після 100 мг · кг −1 · день –1 іп інозину становив 2,5 ± 0,4 нмоль/мг білка, що статистично не відрізнялося статистично від товстої кишки, обробленої носієм.
Таблиця 1. Доза інозину залежно послаблює ознаки експериментального коліту
Дані виражаються як середнє значення ± SE від 10–20 тварин. Самців мишей Balb/c піддавали дії лібіту розчином декстрану сульфату натрію (DSS) (5% мас./Об.). Інозин (25, 50, 100 або 200 мг · кг -1 добу -1) вводили перорально двічі на день, починаючи з день 1 і далідень 10 експеримент було припинено. Товсту кишку розсікли та виміряли. Статистичний аналіз проводився з використанням одностороннього ANOVA з подальшим множинним порівнянням Стьюдента-Ньюмана-Кілса після спеціального аналізу або точного тесту Фішера, де P * P † P ‡ P F1-153 P 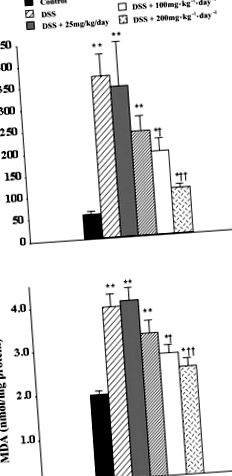
Рис. 1.Інозин залежно від дози знижує рівні МРО (A) і малоновий диальдегід (MDA) (B) в товстій кишці мишей з гострим запаленням товстої кишки, індукованим декстрансульфатом натрію (DSS). Мишей піддавали дії DSS ad libitum протягом 10 днів, лікування інозином (25, 50, 100 або 200 мг · кг -1 кг/день -1, два рази на день) починали з день л. Результати виражаються як середнє значення ± SE від 8–20 тварин, статистичний аналіз проводився за допомогою одностороннього аналізу ANOVA з подальшим багаторазовим порівнянням Стьюдента-Ньюмана-Кілса після спеціального аналізу, P
Рис.2.Вплив інозину (200 мг · кг -1 добу -1) на морфологічні зміни, що спостерігаються в товстій кишці мишей, які отримували DSS протягом 10 днів. Інозин вводили перорально, починаючи здень 1. Увімкнено день 10, мишей вбивали, а біопсію товстої кишки брали і фіксували в 10% розчині формаліну. Зразки вкладали у парафін та розтинали (зрізи 3 мкм). Зрізи фарбували гематоксиліном та еозином та переглядали при збільшенні × 100 або × 400. Представлені розділи представляють секції з 10 мишей. Збільшення перших двох стовпців становить × 100, а третього стовпця × 400.
Таблиця 2. Гістологічний аналіз зрізів товстої кишки з, транспортного засобу, DSS+ миші та DSS +, оброблені інозином
Бали представлені як середні значення ± SE від 10 тварин. Самців мишей Balb/c піддавали дії розчину DSS (5% мас./Об.) У вільному режимі. Інозин (200 мг · кг −1 · день -1) вводили перорально двічі на день, починаючи з день 1. Увімкненодень 10, мишей забивали і відбирали біопсію товстої кишки та фіксували у 10% розчині формаліну. Зразки вкладали у парафін та розтинали (ділянки 3 мкм). Зрізи фарбували гематоксиліном та еозином, переглядали при збільшенні × 400 і оцінювали сліпо за ступенем тяжкості запалення (0 = немає, 1 = легким, 2 = середнім та 3 = важким) та ступенем (0 = немає, 1 = слизова, 2 = слизової та підслизової та 3 = трансмуральної), а також пошкодження крипти (0 = відсутність, 1 = базальна 1/3, 2 = базальна 2/3, 3 = крипти втратили наявний епітелій та 4 = крипти та поверхневий епітелій втрачені). Статистичний аналіз проводили за допомогою Манна-Уітні U-тест, де
* = двостороннійP значення 0,0524,
† = двосторонній P значення 0,0068, та
‡ = двохвостий P значення 0,036 порівняно з групою лікування DSS +.
Інозин частково послаблює симптоми захворювання при встановленому коліті. Миші, які отримували 200 мг · кг −1 · день –1 інозину, починаючи з день 4 або 7 після початку DSS мали збільшену довжину товстої кишки, але не впливали ні на коліт-опосередковану втрату маси тіла, ні на частоту ректальних кровотеч (Таблиця 3). Лікування мишей на день 4 з інозином також мав нижчий рівень товстої кишки як MPO, так і MDA (табл. 3). У експериментах з довготривалим виживанням миші, які отримували 5% DSS протягом 30 днів, демонстрували 100% смертність до 20 днів (рис. 3). На відміну від цього, мишей, які отримували інозин (200 мг · кг -1 добу -1), починаючи з день 1, 4, або 7 показали помітне збільшення виживання при 100, 70 та 30%, відповідно, мишей, живих далі день 20, і навіть далі день 30, 60, 20 і 10% мишей були ще живими (рис. 3).
Таблиця 3. Інозин послаблює ознаки захворювання при встановленому експериментальному коліті
Дані є середніми ± SE від 10–12 тварин. Інозин (200 мг · кг −1 · день -1) вводили перорально двічі на день, починаючи з день 1, 4, або 7 після початку лікування DSS. Увімкненодень 10, експеримент припинили, а тварин принесли в жертву. Товсту кишку розсікли та виміряли. Для визначення рівня мієлопероксидази в товстій кишці (MPO) та малонового діальдегіду (MDA) були взяті біопсії. Статистичний аналіз проводився з використанням одностороннього ANOVA з подальшим множинним порівнянням Стьюдента-Ньюмана-Кілса після спеціального аналізу або точного тесту Фішера, де P
Рис.3.Лікування інозином значно покращує виживання мишей з гострим запаленням товстої кишки. Мишей піддавали дії DSS ad libitum протягом 30 днів, лікування інозином (200 мг · кг -1 кг/день -1 разів на день) розпочали днів л, 4, і7. Було зафіксовано кількість мишей, які виживали щодня. Результати виражаються як% виживання 20 тварин. Статистичний аналіз проводили за допомогою аналізу виживання Каплана-Мейєра, деP
Вплив інозину на цитокіновий профіль товстої кишки.
Миші, які отримували DSS, значно збільшили рівень запальних хемокінів та цитокінів у товстій кишці (рис. 4, A іB). У нелікованих мишей були невизначені рівні хемокінів або цитокінів у товстій кишці (дані не наведені). Інозин (200 мг · кг −1 · день -1) значно знижував рівень хемокінів у товстій кишці (рис.4A) основний внутрішній білок (MIP) -1 і -2 та прозапальні цитокіни (рис.4B) IL-1, IL-6 та IL-12. Інозин також зміг послабити рівень TNF в товстій кишці (рис. 4B).
Рис.4.Вплив інозину на хемокіни товстої кишки (A) і цитокіни (B) рівні після коліту. Рівні цитокінів визначали у біопсіях товстої кишки у мишей, які отримували лікування протягом 10 днів DSS ± інозином (200 мг · кг −1 · день -1). Результати виражаються як середнє значення ± SE від 10 тварин. Статистичний аналіз проводили за допомогою одностороннього аналізу ANOVA з подальшим багаторазовим порівнянням Стьюдента-Ньюмана-Кілса після спеціального аналізу, деP
Також було показано, що інозин інгібує фермент полі (АДФ-рибоза) синтетазу (PARS), хоча і у високих концентраціях (41). Показано, що пригнічення PARS є корисним при багатьох запальних захворюваннях (37), включаючи експериментальний коліт у мишей (44) та щурів (29). Інозин може також посилювати ендогенні антиоксидантні системи, оскільки розщеплення інозину дає урат, поглинач оксирадикалів та пероксинітрит (1, 4, 20, 39), обидва з яких були залучені до патогенезу коліту (36, 43). Ми також дослідили ефективність специфічного каталізатора розкладання пероксинітриту при колітах і виявили, що він захисний (23). Однак ефекти поглинача пероксинітриту на інфільтрацію імунних клітин та рівень цитокінів/хемокінів у товстій кишці колітичних мишей були мінімальними і не порівнюються з тим, що ми спостерігали при лікуванні інозином, додаткові докази системного протизапального механізму дії інозину при коліті.
Посттранскрипційний характер дії інозину як на вивільнення цитокінів, інгібування PARS, так і на вироблення уратів можна вважати кращим, оскільки можна очікувати збільшення вікна терапевтичних можливостей, тобто інозин може залишатися ефективним у парадигмі після лікування. Дійсно, наші дані свідчать про те, що інозин здатний послабити встановлений коліт. Було також показано, що пурини сприяють загоєнню виразок тонкої кишки при експериментальному ентероколіті (40), і це теж може зіграти певну роль у захисних ефектах інозину при лікуванні коліту. Сприяння відновленню пошкодженої слизової оболонки інозином може пояснити зменшення запальних клітин, інфільтруючих товсту кишку.
На закінчення ми продемонстрували ефективність інозину як захисної терапії на експериментальній моделі мишачого коліту. Інозин не тільки зміг запобігти розвитку коліту, але й сприятливо вплинув на встановлене захворювання. Сучасні дані у поєднанні з відмінними показниками безпеки інозину свідчать про те, що концепція тестування та розробки інозину як терапії коліту у людей може бути виправданою.
Це дослідження було підтримане Національними інститутами охорони здоров’я R43-DK-57379 (А. Л. Зальцману) та RO1-GM-66189-01 (Г. Хаско).
СНОПКИ
Лікарі Дж. Г. Мейблі, П. Пачер та А. Мартон - співробітники Inotek Pharmaceuticals; Лікарі C. Szabó та A. L. Salzman є працівниками, власниками та акціонерами Inotek Pharmaceuticals.
Адреса для запитів на передрук та іншої кореспонденції: J. G. Mabley, Inotek Pharmaceuticals, Suite 419E, 100 Cummings Center, Beverly, MA 01915 (E-mail: [email protected] com).
- Мотиваційна профілактика від моркви та паличок до “Моркви” та “Паличок” Американський журнал етики
- Інтегрований захоплення CO2 на основі гідроксиду з повітря та перетворення в американський журнал метанолу
- Статус заліза та фізичні вправи Американський журнал клінічного харчування Oxford Academic
- Математична модель процесу схемної зарядки адсорбційної системи зберігання метану
- Я спробував 2019-10-09 15 кг до кам’яних таблеток для схуднення Безкоштовний зразок з високою якістю - ARK JOURNAL