Індукована імуносупресією клональна Т-клітинна лімфопроліферативна хвороба, що викликає важку діарею, що імітує целіакію після трансплантації нирки: випадок захворювання
Анотація
Передумови
Лімфопроліферативна хвороба після трансплантації є визнаним ускладненням після трансплантації твердих органів. Це, як правило, В-клітинна хвороба і часто асоціюється з інфекцією вірусу Епштейна Барра, хоча може спостерігатися і PTLD Т-клітин. Т-клітинний PTLD, як правило, є мономорфним, лімфоматозним захворюванням, пов’язаним із несприятливим прогнозом.
Звіт про справу
Ми повідомляємо про 52-річного реципієнта чоловічої превентивної трансплантації нирки, у якого розвинулася важка діарея з втратою ваги після посилення його імуносупресії через опосередковану антитілами відторгнення через 3 роки після трансплантації. Дуоденальна біопсія продемонструвала моноклональний CD8 + Т-клітинний дуоденіт, що призводить до збільшення внутрішньоепітеліальних лімфоцитів та загальної атрофії ворсинок, що імітує целіакію. Целіакію виключили негативними антитіловими антитілами до трансглутамінази, тестуванням HLA-DQ2 та HLA-DQ8. Не було жодних доказів наявності лімфоми ні під час біопсії, ні при КТ-ентерографії, а також жодної хвороби FDG на ПЕТ. Симптоми не покращились із зменшенням імуносупресії, але повністю зникли після повної відміни лікування. Трансплантація не вдалася, і його встановили на діаліз. Діагноз - рання ПТЛД.
Висновки
Езофагогастродуоденоскопія з біопсією тонкої кишки є корисним дослідженням для встановлення причини діареї у пацієнтів з трансплантацією нирки, коли виключені більш загальні причини. Це перший звіт, про який ми знаємо про клональну Т-клітинну PTLD, що імітує целіакію, яка пройшла лише після повної відміни імуносупресії. Оскільки лікування лімфоми є агресивним, воно починається лише у злоякісній фазі, а лікування ранньої стадії ЛПНЩ полягає в мінімізації ризику прогресування шляхом зменшення імуносупресії. Будь-які плани повторної пересадки повинні враховувати можливість повторної терапії ЛПНЩ.
Передумови
Термін посттрансплантаційна лімфопроліферативна хвороба (PTLD) був вперше введений в 1984 р. [1] і описує ряд патологій, що виникають як наслідок імуносупресії від реактивної лімфоїдної гіперплазії до лімфоми. Частота ЛПНЩ після трансплантації нирки становить
3% [2] і збільшується за рахунок більш інтенсивної імуносупресії. PTLD може бути як мономорфним, так і поліморфним, і B-клітинні PTLD часто асоціюються з інфекцією вірусу Епштейна Барра (EBV) або реактивацією з клітинами, що демонструють чіткий характер експресії антигену EBV. Т-клітинна PTLD зустрічається рідше і становить 4% випадків у ранньому періоді після трансплантації та 15% випадків пізньої PTLD (> 2 роки після трансплантації) [3]. PTLD Т-клітин є гетерогенною групою захворювань, які лише у 30% випадків асоціюються з EBV-інфекцією [4, 5]. Вони найчастіше мономорфні, хоча описується поліморфна хвороба і пов’язана з поганим прогнозом.
У пацієнтів з нирковими алотрансплантатами існує багато потенційних причин стійкої діареї, включаючи такі, що пов'язані з імуносупресією, такі як побічні ефекти мікофенольної кислоти та ПТЛК кишечника, а також ті, що викликають діарею у пацієнтів, які не страждають імунітетом. Целіакія вражає близько 1% дорослих, може вплинути на реципієнтів трансплантатів і повинна бути включена в список диференціальних діагнозів. Целіакія, внаслідок імунної відповіді на дієтичну клейковину, як правило, спричиняє шлунково-кишкові симптоми, але також асоціюється з низкою проявів, що не мають шлунково-кишкового тракту. Аутоантитіла до тканинної трансглютамінази (анти-ТТГ) виявляються у 95% пацієнтів з целіакією, проте біопсія дванадцятипалої кишки залишається наріжним каменем діагностики. Як правило, це свідчить про наявність лімфоцитарного інфільтрату, гіперплазії крипти, запалення власної пластинки та атрофії ворсинок [6]. Лікування проводиться безглютеновою дієтою, хоча рідко зустрічається рефрактерне захворювання.
Ми повідомляємо про пацієнта, у якого розвинулася важка діарея з багатим на Т-клітини лімфоцитарним інфільтратом дванадцятипалої кишки, що імітує целіакію, але через моноклональну Т-клітинну ПТЛД. Захворювання вирішено після відміни імуносупресії.
Презентація справи
Чоловік у віці 52 років отримав превентивну трансплантацію нирки від своєї дружини для лікування термінальної стадії ниркової недостатності через аутосомно-домінантну полікістоз нирок (невідповідність HLA 1-1-1, невідповідність CMV D +/R-, EBV IgG не виявлено ). Він отримував алемтузумаб під час індукції (30 мг підшкірно на 0-й та 1-й день) з подальшою підтримуючою імуносупресією такролімусом, мофетиламікофенілатом (ММФ) та преднізолоном. Оскільки він був залучений до клінічного випробування, використання алемтузумабу для індукції визначалося групою, до якої він був рандомізований. Він продовжував приймати такролімус, перш ніж був рандомізований через 6 місяців, щоб перейти на сиролімус як частину клінічного дослідження [7]. Через рік йому довелося залишити дослідження, оскільки він проходив операцію по посіченню грижі, яка повернулася до імунодепресії на основі такролімусу.
Через три роки після трансплантації функція нирок почала знижуватися. При трансплантації ниркової біопсії було виявлено хронічне відторгнення антитіл (CAMR) та виявлено нові донор-специфічні антитіла проти HLA класу II. Дози такролімусу та MMF були збільшені, і він знову почав приймати 5 мг преднізолону. Загальну добову дозу такролімусу збільшили з 3 мг до 5 мг із підвищенням рівня з 5,4 мкг/л до 7,0 мкг/л, а добову дозу MMF подвоїли з 1000 мг до 2000 мг. Через місяць після цієї зміни він звернувся до первинної медичної допомоги, пропустивши у нього кал відвертої крові, а також тижневий анамнез болю в животі та терміновості фекалій. У відповідь на ці симптоми ММФ перейшов на мікофенольну кислоту, але діарея тривала, і його двічі приймали через погіршення функції нирок.
Через п’ять місяців після підтвердження CAMR біопсією ритуксимаб розпочинали у дозі 200 мг із запланованою частотою кожні 6–8 місяців, а мікофенольну кислоту відміняли. Хоча ректальна кровотеча дозволила діарею продовжувати, і він пережив 4 кг втрати ваги протягом 2 місяців із загальною втратою ваги близько 14 кг протягом року.
Дослідження причини його діареї включали ПЛР CMV та EBV та посіви калу, які були негативними на початковому етапі. Еластаза фекалій також була нормальною, а тестування на тім’яні клітини парієтальних клітин та ентероцитів було негативним. Флексісігмоідоскопія показала геморой без кровотечі, а колоноскопія була нормальною. Дослідження жовчі на радіонуклеотиді SeHCAT для оцінки мальабсорбції жовчних кислот також було нормальним явищем. Візуалізаційні дослідження, включаючи ПЕТ, КТ грудна клітка-живіт-таз, КТ-ентерографію та МРТ тонкої кишки, не показали жодних ознак злоякісної пухлини або іншої патології кишечника.
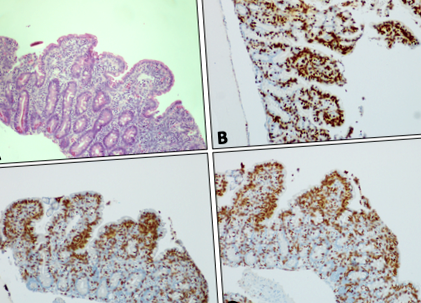
ДНК EBV не було виявлено в сироватці крові за допомогою ПЛР на початку діареї, а IgG EBV залишався негативним. Однак через 6 тижнів після початку діареї ДНК EBV була виявлена в титрах 1612 МО/мл, а потім коливалась між не виявленими та 6770 МО/мл протягом усього періоду діареї. ДНК EBV була виявлена на низьких рівнях (рис. 1
Слизова оболонка дванадцятипалої кишки, що виявляє субтотальну атрофію ворсинок, гіперплазію крипти та збільшення інтраепітеліальних лімфоцитів на (a) Фарбування H&E. Імуногістохімічне фарбування (показано коричневим кольором) слизової оболонки дванадцятипалої кишки для (b) TCR, (c) CD8 та (d) CD3. Усі зображення × 10 збільшення
Повторення OGD після 6-місячної безглютенової дієти виявило клональну популяцію Т-клітин. Внутрішньоепітеліальні Т-клітини мали нормальну імуногістохімію, оскільки вони експресували антигени CD3 та CD8, але відтворювані клональні клональні рецептори Т-клітин (TCR) бета та TCR гамма-перестановки були виявлені за допомогою мультиплексного аналізу ПЛР [8]. Перегрупування генів важких ланцюгів імуноглобуліну було поліклональним, виключаючи проліферацію клональних В-клітин. Не було жодних доказів наявності лімфоми ні під час біопсії, ні при КТ-ентерографії, а також жодної хвороби FDG на ПЕТ.
Після подальшого зменшення повторних такролімусових біоптатів дванадцятипалої кишки було виявлено стійкість популяції клональних Т-клітин та пошкодження слизової з субтотальною атрофією ворсинок та припущення про гіперплазію крипти. Майже через 3 роки з моменту епізоду CAMR та початку діареї вся імуносупресія була відмінена і розпочато перитонеальний діаліз. Діарея поліпшилася протягом декількох днів після припинення імунодепресії, і пацієнт залишається на діалізі без діареї, і він успішно відновив вагу, яку втратив при нездужанні.
Обговорення та висновки
Ми повідомляємо про дуоденіт із серонегативною атрофією ворсинок та незлоякісною клональною проліферацією Т-клітин, вторинною внаслідок імуносупресії у реципієнта ниркової трансплантації. Діагноз ранньої ЛПНЩ підтверджується повним зникненням симптомів відміни імуносупресії. Наскільки нам відомо, немає інших повідомлень про випадки, що описують цей набір висновків.
Лімфома, включаючи ЛПНЩ, є визнаним ускладненням після трансплантації твердих органів. У цьому випадку клональна проліферація Т-клітин була попередньо злоякісною з високим ризиком прогресування до пов'язаної з ентеропатією Т-клітинної лімфоми (EATL). На момент презентації у нашого пацієнта було високе імунодепресивне навантаження, оскільки його терапія була збільшена для лікування CAMR, і він отримував алемтузумаб при введенні. Як агент, що руйнує лімфоцити, алемтузумаб викликає тривалу імуносупресію з повним відновленням В-клітин, що займає 12 місяців, а Т-клітини досягають 50% нормального рівня через 36 місяців [9]. Лікування лімфоми є агресивним, тому їх розпочинають лише у злоякісній фазі, а лікування ранньої стадії ЛПНЩ полягає в мінімізації ризику прогресування шляхом зменшення імуносупресії. Гістологічні висновки при лімфомі є різними, але можуть включати морфологічні дані про пошкодження слизової оболонки аномальною лімфоцитарною популяцією з аномальним лімфоцитарним фенотипом та втратою щонайменше одного з Т-клітинних антигенів. На візуалізації характерно наявність поглиблених FDG уражень на ПЕТ [10]. Жодна з цих особливостей не мала місце у нашому випадку.
Інші відмінності при серонегативній атрофії ворсинок включають целіакію та аутоімунну ентеропатію. Аутоімунна ентеропатія - рідкісне захворювання, частіше зустрічається у дітей, і діагноз тут не підтримувався, оскільки всі тести на антитіла були негативними, а стан лікували за допомогою імуносупресії [11].
Целіакія, яка не реагує на безглютенову дієту і має клональні Т-клітини під час біопсії, називається рефрактерною целіакією II типу (RCD II). У цьому стані інтраепітеліальні лімфоцити є CD3 + і CD8-, тому є фенотипово ненормальними, і пов'язаний із цим підвищений ризик трансформації в EATL сприятиме зменшенню імуносупресії [12]. Тестування проти TTG важливо для діагностики целіакії з чутливістю> 90% та специфічністю> 95%. TTG - це фермент, який видаляє амідну групу з пептидів глютену, щоб збільшити їх зв'язування з HLA-DQ2 та DQ8 на антиген-презентуючих клітинах, стимулюючи запальну реакцію. HLA-DQ2 і DQ8 тісно пов'язані з целіакією, оскільки 95% хворих із цим захворюванням позитивні на HLA-DQ2, а інші 5% позитивні на HLA-DQ8, але 30-40% здорових людей також будуть позитивними на одну з ці алелі. Тестування HLA корисно для виключення целіакії, оскільки негативне прогнозне значення наближається до 100%. Ми можемо бути впевнені, що наш випадок не був целіакією, оскільки він був негативним щодо анти-TTG та HLA-DQ2/DQ8 [13, 14].
Наш пацієнт повністю вирішив свої симптоми після відміни імуносупресії. Дуоденальна біопсія не повторювалась, але припускають, що дуоденіт і атрофія ворсин зникнуть, відображаючи поліпшення симптомів. Ми не знаємо, чи був повністю зруйнований Т-клітинний клон, чи зараз він контролюється, і тому не можемо передбачити, чи повториться хвороба при повторному впровадженні імуносупресії. Пацієнтам проводили повторну трансплантацію після успішного лікування ПТЛД [15, 16], але будь-які плани повторної трансплантації цього пацієнта повинні враховувати можливість того, що це повториться.
Клональний Т-клітинний PTLD є рідкісною причиною важкої діареї у реципієнтів ниркової трансплантації. Клінічно він імітує целіакію, і як тільки були виключені більш загальні причини, може бути проведена ОГД з біопсією тонкої кишки та імуногістохімією для пошуку клональної популяції Т-клітин, специфічної для Т-клітинного ЛПНЩ. Оскільки лікування передбачає скасування імуносупресії, це матиме наслідки для поточного трансплантата, і може знадобитися випробування імунодепресивних препаратів на відповідні варіанти, перш ніж розглядати можливість повторної трансплантації.
Наявність даних та матеріалів
Обмін даними не застосовується до цієї статті, оскільки під час поточного дослідження набори даних не створювались та не аналізувались.
- Чи викликає мексиканська дієта нестримну хворобу серця
- Відсутність цієї поживної речовини може спричинити вашу хворобу ясен! Гуд-Ясна
- Цілющий інтерстиціальний цистит, природно - моя мама; s Історія хронічної хвороби
- Чи викликає ваша стоматологічна робота запалення та аутоімунні симптоми
- Гіпертонічна хвороба нирок, можливо, більше не Американське товариство нефрології