Індивідуальна хіміотерапія при метастатичному недрібноклітинному раку легенів (НМРЛ)
Jia Wei 1, Teresa Moran 2, Zhengyun Zou 1, Xiaoping Qian 1, Lifeng Wang 1, Carlos Camps 3, Wenjing Hu 1, Imane Chaib 2, Belén Sanchez 2, Lixia Xu 1, Niki Karachaliou 4, María Sanchez-Ronco 5, Баруї Лю 1, Рафаель Розелл 2,4
Ключові слова: Недрібноклітинний рак легенів; індивідуальна хіміотерапія; Вираз BRCA1 та RAP80 (BREC); BRCA1; RAP80; КОЛЬЦОВИЙ пальцевий білок 8 (RNF8)
Подано 18 січня 2013 р. Прийнято до друку 19 лютого 2013 р.
Вступ
Рівні мРНК RAP80 та BRCA1 при налаштуванні хіміотерапії в BREC
Дослідження BREC були побудовані на основі індивідуального дослідження фази II групи іспанського раку легенів (SLGC) (NCT00883480) та інформації, виявленої у 2007 році щодо комплексу BRCA1-A (BRCA1, RAP80, ABRAXAS). Як коментувалось, інформація, яка відтоді повідомлялася, під час нарахування BREC дає обгрунтування для вивчення рівня мРНК інших генів у пацієнтів BREC - перш за все, RNF8 може зіграти вирішальну роль, оскільки, коли BRCA1 та RAP80 є низький, якщо RNF8 все ще виражений, це нейтралізує прогнозну модель. Інші цікаві гени та асоціації пояснюються нижче.
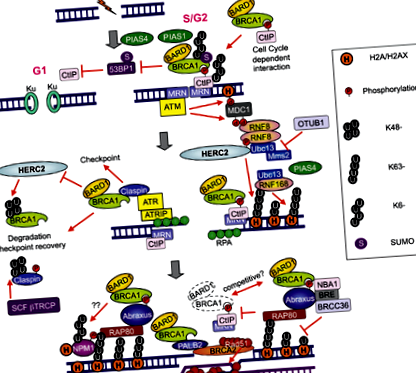
Дволанцюгові розриви (DSB), викликані хіміотерапією, призводять до реакції на пошкодження ДНК (DDR): пов'язана з ATM або тирозинкіназа
ДНК DSB, спричинені хіміотерапією, відновлюються двома основними системами: негомологічним кінцевим приєднанням (NHEJ) та гомологічною рекомбінацією (HR). Після введення ДНК DSB відбуваються такі процеси: гістон H2AX фосфорилюється мутацією атаксії телеангіектазії (ATM); медіатор контрольної точки 1 для пошкодження ДНК (MDC1) зв’язується з фосфорильованим H2AX (H2AX); АТМ фосфорилює MDC1 в області, що оточує DSB. Білок пальця 8 убіквітин-лігази E3 RING (RNF8) зв'язується з фосфорильованим MDC1 на сайтах DSB і сприяє рекрутингу іншої лібіази убикітину E3 RNF168; RNF8 і RNF168 кон'югують Lys 63-зчеплені ланцюги убиквітину з гістоном H2A з їх спорідненим ферментом, кон'югуючим убиквітин E2 UBC13, і індукують ремоделювання хроматину. UBC13-RNF8/RNF168-залежне убіквітінування сприяє рекрутингу BRCA1 та р53-зв’язуючого білка 1 (53BP1) до DSB (5) (рис. 2). Важливо, що велика частка BRCA1, яка локалізується на сайтах DSB, є складовою комплексу BRCA1-A, що складається з гетеродимера BRCA1/BARD1, убіквітин взаємодіючого мотиву (UIM), що містить RAP80, та адаптерного білка ABRAXAS (6-9).
На основі цієї інформації ми провели дослідницький аналіз рівнів мРНК RAP80 та ABRAXAS у попередньому індивідуальному дослідженні фази II. Хоча інформація, надана ABRAXAS, була подібною до інформації, наданої RAP80, RAP80 була більш значущою (10). Механічно, втрата RAP80 пригнічує вербування комплексу BRCA1 до місць пошкодження ДНК і скасовує процес відновлення пошкодження ДНК у DSB (11). З тих пір було виявлено, що комплекс BRCA1-A також включає деубіквітуючий фермент BRCC36, а також BRCC45/BRE та MERIT40/NBA1 (5). Інші групи також продемонстрували, що BRCA1 утворює біохімічно різні комплекси з деякими іншими білками, що відповідають на пошкодження ДНК [комплекси BRCA1-B та BRCA1-C; Малюнок 3 (6)] у відповідь на DSB. Одночасна наявність у DSB декількох різних комплексів BRCA1 припускає перехресні перешкоди між комплексами та підвищує рівень складності; наприклад, комплекс BRCA1/RAP80 може пом'якшити надмірну резекцію за допомогою CtIP (12). Хоча велика частка BRCA1 не вдається утримати в DSB після втрати RAP80, можливо, може відбутися переміщення невеликої кількості BRCA1 до DSB через асоціацію з іншими білковими комплексами.
Крім того, BRCA1 можна завербувати до DSB шляхом прямого зв'язування з фосфорильованим CtIP, утворюючи комплекс BRCA1-C (6) [Рисунок 3 (6)]. Важливо, що CtIP здатний генерувати обмежену кінцеву резекцію DSB без BRCA1, щоб сприяти зміненому NHEJ, пошкодженню помилок у фазі G1 клітинного циклу [Рисунок 2 (5)]. Цікаво, що кінцева резекція DSB, яку сприяє CtIP, інгібується 53BP1, а BRCA1 перекриває 53BP1 для виконання резекції (13,14). Крім того, 53BP1 блокує HR і підтримує зупинку росту, спричинену виснаженням BRCA1. Однією з основних функцій комплексу BRCA1 та BRCA1-C є придушення 53BP1 та подовження активності CtIP для кінцевої резекції DSB, щоб генерувати довжину ssDNA, достатньо довгу для HR [Рис.
RAP80 взаємодіє з ланцюжком, пов'язаним з Lys63, який генерується UBC13-RNF8/RNF168 і переносить BRCA1 на сайти DSB. Надмірна експресія деубіквітуючого ферменту OUT-домену, зв’язування альбігіду убихітину 1 (OTUB1) пригнічує залежне від пошкодження ДНК ускладнення хроматину шляхом інгібування активності UBC13, таким чином пригнічуючи HR (15) [Рисунок 2 (5)].
Однією з основних труднощів у дослідженні BREC є те, що пухлинні клітини мають різні системи відновлення ДНК, крім HR. Ці системи працюють надлишково, кожна працює з відновленням ДНК у випадку, якщо інші системи відновлення виявляються неефективними. Нещодавно було продемонстровано, що інгібування активності RNF8 або RNF168 може пригнічувати BRCA1 незалежно від HR у клітинах пухлини з низьким рівнем 53BP1. RNF8 необхідний для стійкості як до опромінення, так і до цитотоксичних препаратів (16). RNF8 може сприяти збірці RAD51 на сайтах DSB у виснажених клітинах BRCA1/53BP1 (17). Модель показує, що в нормальних клітинах ланцюг убиквітину з RAP80, BRCA1, 53BP1 та RAD51 збирається на сайтах DSB. У виснажених BRCA1 клітинах RAP80 і 53BP1, але не RAD51, збираються на сайтах DSB. У виснажених RAP80 клітинах невелика підмножина білка BRCA1, 53BP1 і RAD51 збирається на сайтах DSB. Однак у виснажених клітинах RNF8/BRCA1 або в виснажених клітинах RNF8/BRCA1/53BP1 RAD51 і RAP80 не збираються в місцях DSB (17) (рис. 4).
RNF8 проявляє подвійні некаталітичні та каталітичні дії, що відповідають за деконденсацію хроматину та повсюдне поширення гістону. Димер RNF8 рекрутується до DSB шляхом зв'язування з фосфорильованим MDC1. Набраний димер RNF8 зв'язується з хромодоменним геліказним ДНК-зв'язуючим білком 4 (CHD4) фосфонезалежним чином, що призводить до локальної деконденсації хроматину, що дозволяє посилити кон'югацію убиквітину в DSB та асоціацію RNF168 та BRCA1 (18). Крім того, селективний убіквітин-валозин-вмісний білок (VCP) набирається RNF8 і відіграє вирішальну роль у посередництві при наборі факторів відновлення за течією. VCP стимулює набір 53BP1 (18).
Функція RNF8 може бути життєво важливою для хіміорезистентності. Лігаза E3 типу HECT (HERC2), великий 4834-амінокислотний білок, взаємодіє з FHA-доменом RNF8 залежно від фосфорилювання, полегшуючи складання комплексу RNF8/UBC13 (19) [Рисунок 2 (5)]. Отже, аналіз HERC2 та RNF8 може мати потенційне значення для інтерпретації результатів BREC. Цікаво, що HERC2 може погіршити BRCA1 (19). Крім того, нуклеофосмін (NPM1) рекрутується до DSB таким чином, що залежить від опосередкованих RNF8/RNF168 кон'югатів убиквітину (20).
PIAS1 та PIAS4 набираються до DSB. Виснаження PIAS1 або PIAS4 зменшує частку клітин, що демонструють накопичення BRCA1, і збільшує інтенсивність фарбування BRCA1 у DSB, збільшуючи чутливість до опромінення або цисплатину (21,22). Набір RNF168 порушений лише у PIAS4-, але не в клітинах, виснажених PIAS1. 53BP1 набір не вимагає BRCA1 або PIAS1, але вимагає PIAS4 (21,22) [Рисунок 2 (5)]. Ця важлива знахідка вказує на важливість вивчення рівнів BRCA1 разом з рівнями PIAS1, а також 53BP1 разом з рівнями PIAS4. Високий рівень PIAS4, PP2A/C та BRCA1mRNA були незалежними маркерами коротших PFS у хворих на недрібноклітинний рак легенів з мутантним EGFR (NSCLC), які отримували ерлотиніб (23). У той же спосіб низькі рівні BRCA1, PIAS1 та PIAS4 були незалежними маркерами поганої виживаності у хворих на рак шлунка, які отримували доцетаксел як другу лінію лікування (24). Встановлено, що BRCA1 є диференціальним модулятором хіміочутливості, індукуючи 10-1000-кратне збільшення стійкості до декількох ДНК-пошкоджуючих агентів, особливо тих, що спричиняють DSB. На відміну від цього, BRCA1 спричинив більш ніж у 1000 разів збільшення чутливості до паклітакселу, доцетакселу та винорелбіну (25, 26).
PPP2R2A також є критичним ефектором HR через модуляцію фосфорилювання ATM. Виснажені PPP2R2A клітини різко підвищують чутливість до інгібіторів PARP. Цікаво, що мРНК PPP2R2A зазвичай не регулюється в НДКРЛ (33). Раніше ми спостерігали, що у пацієнтів з мутантними EGFR НДКРЛ, які отримували ерлотиніб, високий рівень мРНК PP2A/C суттєво підвищував коефіцієнт ризику для PFS у багатоваріантній моделі (23).
Контрольний пункт пошкодження ДНК (DDC), сигналізуючи про реплікацію ДНК
На додаток до гомологічної рекомбінації та NHEJ, генотоксичний стрес, викликаний хіміотерапією, також спричинює реплікаційний стрес (38). Цей шлях DDC менш відомий. Білки Slx4 і Rtt107 для відновлення ДНК, що відновлюють, запобігають аберрантній активації сигналізації DDC ураженнями, утвореними під час реплікації ДНК. Під час реплікаційного стресу клітини Saccharomyces cerevisiae, у яких відсутні Slx4 та Rtt107, демонструють гіперактивацію нижчої за ДДК кіназою Rad53. Комплекс Slx4 або Rtt107 протидіє адаптеру контрольної точки Rad9 шляхом фізичної взаємодії з Dpb11 та фосфорильованим гістоном H2A (39). Існує гіпотеза, що модуляція активації Rad53 відбувається за допомогою DAMP (гасить фосфорну сигналізацію, опосередковану адаптером контрольної точки) (39).
Нещодавно було описано, що RNF126 сильно експресується в підмножині клітинних ліній раку молочної залози і негативно корелює з рівнем експресії p21. RNF126 націлений на p21 для деградації, опосередкованої убиквітином (40).
Відповідь на пошкодження ДНК (DDR), незалежно від ATM
Фосфопротеомічний аналіз виявив, що в ДДР можуть брати участь кілька кіназ, що мають великі перехресні перешкоди між ними. Одним з найважливіших може бути c-ABL. c-ABL - це нерецепторна тирозинкіназа, яка регулюється після опромінення, цисплатину та інших препаратів. c-ABL взаємодіє з ATM та DNA-PK. c-ABL, активований опроміненням, опосередковує фосфорилювання PI3K та mTOR, що призводить до інгібування активності кінази (41).
c-ABL є перетворювачем у процесі апоптозу у відповідь на пошкодження ДНК. Він є членом сімейства Src нерецепторних тирозинкіназ. У звичайних умовах c-ABL неактивний і секвеструється в цитоплазму, зв'язуючись з білком 14-3-3. При пошкодженні ДНК активується N-кінцева кіназа c-Jun (JNK), фосфорилюючи 14-3-3 в місці зв'язування з c-ABL, який вивільняє c-ABL, який локалізується в ядрі і активується фосфорилюванням Банкомат. Великий інтерес викликає те, що YAP1 є прямим субстратом c-ABL, а пошкодження ДНК стабілізує YAP1 в залежності від кінази c-ABL. Потім фосфорильований YAP1 зв'язується з p73 і вибірково рекрутується на промотор Bax для індукування апоптозу (42). Сигнальний шлях Бегемота є новим шляхом придушення пухлини, і подальший ефект сигнального каскаду Бегемота полягає у фосфорилюванні та інактивації YAP1 та його паралогу TAZ. Надмірна експресія YAP1 та TAZ спостерігалась при НМРЛ, що дало поганий прогноз (43,44). Цікаво, що YAP1 може індукувати апоптоз (Bax) через c-ABL.
Що цікаво, посилюючи роль c-ABL, нещодавно повідомлялося, що надмірна експресія AXL викликає стійкість до цисплатину, інгібуючи сигнал c-ABL/p73 (45). Це дозволяє нам міркувати, оскільки AXL є ефектором шляху YAP-TAZ (коли HIPPO вимкнено) і може спричинити скасування c-ABL, порушуючи асоціацію з p73β (45). Однак попередня робота продемонструвала, що c-ABL посилює апоптоз за допомогою активації YAP1 (42). Це очевидне протиріччя можна пояснити лише тим, що шлях Wnt повинен бути активним, оскільки бета-катенін тоді зв’язаний з YAP1 і може перешкоджати програмі транскрипції YAP, включаючи активацію AXL. На цих підставах, також нещодавно спостерігалося, що YAP1 і TAZ поєднуються з бета-катеніном, і деградація YAP1 і TAZ уникається, коли активний шлях Wnt, що скасовує комплекс руйнування бета-катеніну (AXIN1, GSK3, APC) (46,47). Зв'язування Внт з їх рецепторами інактивує цей комплекс, що призводить до накопичення та ядерної транслокації бета-катеніну (48). Крім того, як не парадоксально, але при меланомах з BRAF V600E ефективність інгібітора BRAF PLX4720 збільшується, коли присутній бета-катенін, і це досягається усуненням AXIN1 (49).
Не залежні від бета-катеніну сигнальні шляхи
На додаток до рецепторів FZD, рецептори Wnt ROR1 та ROR2 також сприяють проліферації раку (48). Wnt5A є лігандом для ROR1 (50). Репресія ROR1 інгібує аденокарциному легенів незалежно від статусу EGFR. ROR1 скасовує ASK1, що може призвести до скасування BIM (51). У дослідженні EURTAC вищі рівні мРНК ROR1 суттєво корелювали з поганою виживаністю.
Подяки
Розкриття інформації: Автори заявляють, що немає конфлікту інтересів.
- Вживаючи більше йогурту, харчові волокна можуть зменшити ризик раку легенів
- Дієтичні сполуки калангін та мірицетин пригнічують ангіогенез ракових клітин яєчників
- Променева терапія раку шийки матки Променева терапія раку шийки матки
- Вживання дієти з обмеженим вмістом калорій не тільки спалює жир, але й може зменшити шкоду клітинам, рекомендує дослідження
- ДІЄТА, ПИТАННЯ ТА РАК ПРОСТАТИ Щорічний огляд харчування