Дієтичні сполуки калангін та мірицетин пригнічують ангіогенез ракових клітин яєчників
Хайджі Хуан
1 Коледж інженерії біосистем та харчових наук, Інститут харчових наук ім. Фулі, Університет Чжецзян, Китай
2 Коледж наук, технологій та математики, Університет Олдерсона Броддуса, Філіппі, штат Вірджинія, 26416, США
Аллен Ю. Чень
3 Департамент фармацевтичної науки Університету Західної Вірджинії, Моргантаун, штат Вірджинія 26506, США
Йон Роджанасакул
3 Департамент фармацевтичної науки Університету Західної Вірджинії, Моргантаун, штат Вірджинія 26506, США
Сінцянь Є
1 Коледж інженерії біосистем та харчових наук, Інститут харчових наук ім. Фулі, Університет Чжецзян, Китай
Гері О. Ранкін
4 Кафедра фармакології, фізіології та токсикології, Медична школа Джоан К. Едвардс, Університет Маршалла, Хантінгтон, штат Вірджинія, 25755, США
І Чарлі Чен
2 Коледж наук, технологій та математики, Університет Олдерсона Броддуса, Філіппі, штат Вірджинія, 26416, США
Анотація
Галангін та міріцетин - це флавоноїди, виділені з овочів та фруктів, які проявляють антипроліферативну активність у ракових клітинах людини. У цьому дослідженні їх антиангіогенні ефекти досліджували за допомогою моделей in vitro (HUVEC) та in vivo (CAM), які показали, що галангін та мірицетин інгібують ангіогенез, індукований клітинами OVCAR-3. Були також вивчені молекулярні механізми, за допомогою яких галангін та мірицетин пригнічують ангіогенез. Було помічено, що галангін та мірицетин пригнічують секрецію ключового медіатора ангіогенезу фактора росту судинного ендотелію (VEGF) та знижують рівні білків p-Akt, p-70S6K та індукованого гіпоксією фактора-1α (HIF-1α) у A2780/CP70 та Клітини OVCAR-3. Експерименти з транзиторною трансфекцією показали, що галангін та мірицетин пригнічують секрецію VEGF шляхом Akt/p70S6K/HIF-1α. Більше того, було виявлено, що новий шлях, p21/HIF-1α/VEGF, бере участь у інгібуючій дії мірицетину на ангіогенез у клітинах OVCAR-3. Ці дані свідчать про те, що галангін та мірицетин можуть служити потенційними антиангіогенними засобами у профілактиці раку яєчників, що залежить від нових мереж кровоносних судин.
1. Вступ
Недавні дослідження зосереджувались на протираковій активності флавоноїдів, виділених із рослин (Park et al., 2014; Zhang et al., 2014; Zivkovic et al., 2014). Флавоноїди - це природні поліфеноли, присутні в багатьох різних продуктах харчування, особливо в фруктах та овочах. Попередні дослідження припускали, що флавоноїди мають протипухлинні характеристики і можуть бути в змозі зменшити ризик розвитку раку за допомогою механізмів запобігання окислення та запалення, зменшення ангіогенезу та проліферації клітин та індукції апоптозу (Gates et al., 2009; Kandasamy & Ashokkumar, 2013; Li та ін., 2009; Li, Wang, Guo, Zhao, & Ho, 2014; Ma et al., 2014; Yu et al., 2014). Галангін та міріцетин є членами флавонольного підкласу флавоноїдів з антиоксидантною активністю. Калангін виділяли з кореневища калгану та прополісу. Мірицетин є більш поширеним, ніж галангін, і його можна знайти у фруктах, овочах, горіхах, ягодах, чаї та червоному вині (Basli et al., 2012; Ross & Kasum, 2002).
Ангіогенез - це фізіологічний процес, завдяки якому нові кровоносні судини утворюються із вже існуючих судин (Birbrair et al., 2014). Це також основний крок у переході пухлин, включаючи пухлини яєчників, із доброякісного стану в злоякісний. Ангіогенез, як правило, спокійний у нормальних тканинах дорослої людини (Bertl, Bartsch, & Gerhauser, 2006). Мікротумор, що зростає понад 1 до 2 мм2, стикається з обмеженим харчуванням та надходженням кисню і потребує цілої системи крові, щоб підтримувати власний ріст і викидати метаболіти (Bertl, Bartsch, & Gerhauser, 2006). На відміну від них, дорослі без пухлини не потребують ангіогенезу в звичайних ситуаціях (Fotsis et al., 1993; Glade-Bender, Kandel, & Yamashiro, 2003). Як повідомляється, антиангіогенез є можливим для лікування раку людини і став однією з найбільш перспективних стратегій хіміопрофілактики та лікування раку. Ці крихітні пухлини на ранніх стадіях неможливо успішно діагностувати, але їх подальший розвиток вимагає нової мережі кровоносних судин (Sanchez-Munoz, Perez-Ruiz, Mendiola, Alba, & Gonzalez-Martin, 2009). Попередні дослідження повідомляли, що галангін та мірицетин зменшують ангіогенез в ендотеліальних клітинах пуповинної вени людини (HUVEC) (Kim, Liu, Guo & Meydani, 2006). Міріцетин також інгібував ангіогенез у моделі безволосих пухлин шкіри миші SKH-1, індукованій УФВ (Jung et al., 2010).
Ендотеліальний фактор росту судин (VEGF) відіграє центральну роль у опосередкуванні розвитку та підтримки судин пухлини (Hefler et al., 2007). Тому терапія проти VEGF є важливою при лікуванні раку. Ген VEGF безпосередньо регулюється індукованим гіпоксією фактором 1α (HIF-1α), гетеродимерним основним білком спіралі-спіралі (Forsythe et al., 1996). Стабілізація та підвищення регуляції HIF-1α сприяє експресії VEGF шляхом зв'язування з HIF-реагуючими елементами (HRE) у промоторах. Рибосомна білкова S6-кіназа (p70S6K), серин/треонінкіназа, яка діє нижче за течією шляху PI3K/Akt, контролює ангіогенез, регулюючи білки HIF-1α та VEGF (Bian, Shi, Meng, Jiang, Liu, & Jiang, 2010). Akt є посередником VEGF, який підсилює патологічний ангіогенез і ріст пухлини, пов'язаний з аномаліями матриксу в шкірі та судинах (Chen et al., 2005; Somanath, Razorenova, Chen, & Byzova, 2006). P21, відомий як регулятор прогресування клітинного циклу, також негативно регулює білок VEGF в деяких ракових клітинах, включаючи клітини OVCAR-3 (Farhang, Goossens, & Haigh, 2013; Luo, Rankin, Juliano, Jiang, & Chen, 2012).
У цьому дослідженні ефекти галангіну та мірицетину на зменшення ангіогенезу вивчались у двох стійких до платини клітинних лініях раку яєчників: A2780/CP70 та OVCAR-3. Були також досліджені механізми впливу галангіну та мірицетину на ангіогенез.
2. Матеріали та методи
2.1. Культура клітин та реагенти
2.2. Розмноження клітин
Інгібування росту клітин визначали за допомогою набору «CellTiter 96 AQueous One Solution Cell Proliferation Assay» від Promega (Madison, WI, USA). Клітини висівали в 96-лункові планшети при щільності 2 × 10 4/лунку та інкубували при 37 ° С. Клітинам дозволяли прикріпитися до дна протягом ночі, а потім обробляли різними концентраціями калангіну/мірицетину. Контрольні клітини отримували рівний об'єм лише DMSO. Через 24 години до кожної лунки додавали 100 мкл розведеного розчину реагенту CellTiter 96 AQueous One Solution (80 мкл PBS + 20 мкл реагенту CellTiter 96 AQueous One Solution). Потім клітини інкубували при температурі 37 ° С ще 1 год і вимірювали при 490 нм. Життєздатність клітин виражали у відсотках від контролю у трьох незалежних експериментах.
2.3. ІФА для VEGF
Рівні VEGF у супернатантах клітинних культур аналізували за допомогою імуноаналітичного набору Quantikine Human VEGF (R&D Systems, Міннеаполіс, Міннесота, США). Клітини A2780/CP70 та OVCAR-3 (2 × 10 4/лунка) висівали в 96-лункові планшети та інкубували протягом ночі. Згодом клітини обробляли калангіном/мірицетином або ДМСО протягом 24 годин у вільному від сироватки середовищі. Були зібрані супернатанти культури. Кількості VEGF вимірювали відповідно до вказівок виробника, нормалізували до загального рівня білка і виражали у відсотках від необробленого контролю.
2.4. Аналіз ангіогенезу in vitro
Ракові клітини OVCAR-3 висівали в 96-лункові планшети при 2 × 10 4/лунку та інкубували протягом ночі перед обробкою різними концентраціями калангіну/мірицетину протягом 24 годин. Кондиційне середовище збирали. Матрицели зі зниженим фактором росту (BD Biosciences, Сан-Хосе, Каліфорнія, США) додавали в 96-лункові планшети при 50 мкл/лунку та інкубували при 37 ° С протягом 30 хв для гелеутворення. Клітини HUVEC збирали в базальному середовищі судинних клітин і висівали в шари Matrigel у концентрації 1,5 × 10 4/90 мкл середовища. Потім до кожної лунки додавали 10 мкл зібраного кондиціонованого середовища, а потім інкубували при 37 ° С протягом 6 годин. Кожна лунка була сфотографована під мікроскопом. Кожне зображення розміром 1388 × 1040 пікселів було додатково розділено на 6 прямокутних областей лініями сітки, щоб отримати довжину трубки за допомогою програмного забезпечення NIH ImageJ. Ангіогенез оцінювали шляхом нормалізації довжини трубки до довжини контрольної.
2.5. Аналіз ангіогенезу in vivo
Специфічні фертильні курячі яйця без патогенів (лабораторії Чарльз-Рівер, штат Північний Франклін, штат Коннектикут, США) інкубували при температурі 37,5 ° С і повільно обертали за допомогою автоматичного токаря яєць (G.Q.F. Manufacturing Company, Savannah, GA, USA). Клітини OVCAR-3 (1,2 × 106 клітин у середовищі, що не містить FBS, 20 мкл) змішували з 80 мкл Matrigel (BD Bioscience), доповненого різними концентраціями галангіну/мірицетину, попередньо желированного на автоклавному силіконовому килимку 30 хв і імплантується в хоріолантоїсну мембрану (CAM) 9-денного курячого ембріона. Після інкубації ще 5 днів, троє дослідників, сліпих до лікування, сфотографували пухлинні імплантати та судини. Ангіогенез оцінювали шляхом нормалізації кількості розгалужених судин до кількості контрольної САМ.
2.6. Вестерн-блот
Клітини раку яєчників (106) висівали в 60-міліметрові посудини та інкубували протягом ночі перед обробкою калангіном/мірицетином або ДМСО протягом 24 годин. Клітини промивали PBS, лізували в 100 мкл реагенту для екстракції білка ссавців, включаючи 1 мкл зупиненої протеази, 1 мкл інгібітора фосфатази та 2 мкл етилендіамінтетраоцтової кислоти (EDTA) (M-PER, Pierce, Rockford, IL, USA), відповідно до виробника інструкції. Загальний рівень білка визначали за допомогою набору BCA Protein Assay Kit (Pierce). Клітинні лізати відокремлювали 10% SDS-PAGE і блотували на нітроцелюлозну мембрану за допомогою системи Mini-Protean 3 (Bio-Rad, Hercules, CA, USA). Мембрани блокували в 5% знежиреному молоці в солі трис-буферного розчину, що містить 0,1% Твін-20, протягом 1 год при кімнатній температурі. Мембрани інкубували з відповідними розведеннями первинних антитіл та вторинних антитіл. Після промивання TBST комплекс антиген-антитіло візуалізували за допомогою субстрату пролонгованої тривалості дії SuperSignal West Dura (Pierce). Кількості білків визначали кількісно за допомогою програмного забезпечення NIH ImageJ, нормалізованого за допомогою відповідного GAPDH для аналізу.
2.7. Трансфекція за допомогою невеликої заважаючої РНК (siРНК)
Клітини OVCAR-3 висівали в 60-міліметрові посудини при 5 × 10 5/блюдо та інкубували протягом ночі перед трансфекцією р21 міРНК або контрольною сиРНК (Санта Круз Біотехнологія) з використанням реактиву ДНК jetPRIME ™ та реагенту трансфекції міРНК (VWR International, Radnor, PA США) згідно з протоколом виробника. Через 24 години клітини обробляли мірицетином або ДМСО. Клітинні лізати збирали для вестерн-блот для тестування білків p70S6K, Akt та HIF-lα.
2.8. Аналіз плазмідної трансфекції та люциферази
Клітини OVCAR-3 висівали в 96-лункові планшети по 10000 клітин/лунку та інкубували протягом ночі. Клітини OVCAR-3 трансфікували плазмідами Akt, p70S6K/HIF-lα або SR-α (як транспортний засіб) та репортером люциферази HIF-1α/VEGF, використовуючи jetPRIME ™ ДНК та реагент трансфекції siRNA (VWR International) відповідно до виробника протокол. Через чотири години після трансфекції середовища видаляли, після чого проводили 24-годинну обробку галангіном/мірицетином. Клітини збирали та аналізували на активність люциферази за допомогою системи аналізу люциферази ONE-Glo (Promega) та виявляли Lumat LB9507 (Berthold Technologies, Bad Wildbad, Німеччина). Загальний рівень білка аналізували за допомогою BCA Protein Assay Kit (Pierce), а діяльність репортера нормалізували за відповідними рівнями загального білка для статистичного аналізу.
2.9. Аналіз невеликої заважаючої РНК (siRNA) трансфекції люциферази
Клітини раку яєчників OVCAR-3 (5000 клітин/лунка) висівали в 96-лункові планшети та інкубували протягом ночі. Клітини трансфікували siRNA p21 або контрольну siRNA, а потім трансфікували репортером люциферази HIF-1α/VEGF протягом 24 годин, використовуючи ДНК jetPRIME ™ та реагент для трансфекції siRNA (VWR International) згідно з протоколом виробника. Середовища видаляли, після чого проводилась 24-годинна обробка калангіном/мірицетином. Клітини збирали та аналізували на активність люциферази за допомогою системи аналізу люциферази ONE-Glo (Promega) та виявляли Lumat LB9507 (Berthold Technologies). Загальний рівень білка аналізували за допомогою BCA Protein Assay Kit (Pierce), а діяльність репортера нормалізували за відповідними рівнями загального білка для статистичного аналізу.
2.10. Статистичний аналіз
Всі експерименти проводились щонайменше тричі незалежно. Результати були виражені як середнє значення ± стандартна помилка середнього значення (SEM) за допомогою Microsoft Excel (2007). Статистичну оцінку проводили за допомогою програмної системи SPSS (версія 18.0 для Windows). Результати аналізували, використовуючи односторонній дисперсійний аналіз (ANOVA) та пост-hoc тест (двосторонній тест Даннета), щоб перевірити як загальні відмінності, так і специфічні відмінності між кожним лікуванням та контролем. Значення р менше 0,05 вважалося значущим.
3. Результати
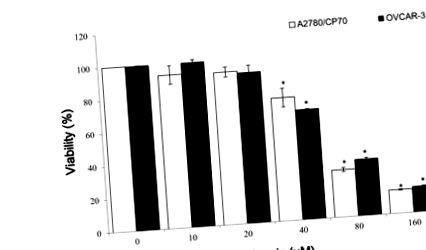
3.1. Вплив калангіну та мірицетину на життєздатність ракових клітин яєчників
Клітини OVCAR-3 висівали (2 × 10 4), обробляли різними концентраціями калангіну або мірицетину протягом 24 годин, а потім збирали середовища. Клітини HUVEC збирали, підраховували і висівали на гельовані шари Matrigel. Додані зібрані кондиціоновані середовища культури клітин і клітини інкубували протягом 6 годин.
3.4. Галангін та мірицетин інгібують ангіогенез in vivo, індукований клітинами OVCAR-3
(A) Галангін знижував рівні HIF-1 α, фосфор-Akt, фосфор-P70S6K і не впливав на NFκB та PTEN в A2780/CP70 та OVCAR-3. (B) Мірицетин знижував рівні HIF-1α, фосфору-Akt, фосфору-p70S6K і не впливав на NFκB та PTEN у A2780/CP70 та OVCAR-3. Білкові смуги нормалізували за відповідними смугами GAPDH (p-Akt/p-p70S6K нормували за t-Akt/t-p70S6K) і виражали у відсотках контролю. * p # p Рисунок 5C). Далі клітини OVCAR-3 трансфікували репортером HIF-1α разом з плазмідами p70S6K та Akt. Лікування галангіном суттєво пригнічувало транскрипційну активність HIF-1α; однак це пригнічення суттєво послаблювалось надмірною експресією білків p70S6K та Akt (рис. 5С). Подібним чином міріцетин також суттєво пригнічував транскрипційні дії HIF-1α та VEGF у клітинах OVCAR-3. Надмірна експресія білків p70S6K та Akt, що залежить від концентрації, суттєво змінила це гальмування (рис. 5D). Ці результати вказують на те, що галангін та мірицетин пригнічують ангіогенез у клітинах OVCAR-3, принаймні частково, через зниження рівня HIF-1α, Akt та p70S6K.
3.6. Роль p21 в інгібованому мірицетином ангіогенезі в клітинах OVCAR-3
Повідомлялося, що P21, як регулятор прогресування клітинного циклу, інгібує експресію VEGF в клітинах OVCAR-3 (Luo, Rankin, Juliano, Jiang, & Chen, 2012). Тому деякі білки, які асоціюються з p21, були досліджені, щоб з'ясувати, чи інгібує мірицетин життєздатність у клітинах OVCAR-3 через білок p21 (рис. 6А). Було встановлено, що мірицетин регулює рівень білків p21 та p53 та знижений рівень білка cmyc онкогену.
(A) Мірицетин знижував рівень cmyc та підвищував експресію p21 та p53 в OVCAR-3. Білкові смуги нормалізували за відповідними смугами GAPDH і виражали у відсотках контролю. * p # p На малюнку 6B показано збиття p21 специфічною siРНК (50 нМ), що призвело до скасування інгібування мірицетином активності HIF-1α та транскрипції VEGF. Як показує результат вестерн-блот, трансфекція р21 міРНК підвищувала рівень білка HIF-1α в клітинах OVCAR-3, оброблених мірицетином та без нього. З цих результатів було зроблено висновок, що p21/HIF-1α/VEGF є одним із шляхів, пов'язаних з інгібованим мірицетином ангіогенезом у клітинах OVCAR-3. Однак результати вестерн-блот-показу показали, що нокдаун p21 не скасовував вплив мірицетину на рівні білків p-Akt та p-p70S6K у клітинах OVCAR-3 (рис. 6C).
4. Обговорення
Пухлинам потрібна неушкоджена система крові для забезпечення поживними речовинами та киснем і пролиття метаболітів (Bertl, Bartsch, & Gerhauser, 2006). Ангіогенез - це фізіологічний процес, завдяки якому нові кровоносні судини утворюються із вже існуючих судин (Birbrair et al., 2014). Це необхідна умова стійкого росту пухлини і відіграє центральну роль у розвитку та прогресуванні раку. Пухлини яєчників рясно васкуляризовані, і ступінь неоваскуляризації та ангіогенезу пов'язані з біологічною агресивністю (Alvarez, Krigman, Whitaker, Dodge, & Rodriguez, 1999). У цьому дослідженні галангін та мірицетин ефективно пригнічують формування мереж кровоносних судин, індукованих раковими клітинами яєчників. У моделі CAM лікування галангіном та мірицетином значно зменшило кількість кровоносних судин, підтверджуючи їх ефективність у протидії ангіогенезу.
- Дієтичний жир змінює легеневі метастазування раку молочної залози через автономний рак
- Харчові волокна, цільні зерна та ризик колоректального раку систематичний огляд та відповідь на дозу
- Дієтичні фітохімікати, орієнтовані на стовбурові клітини раку - PubMed
- Дієтичний сироватковий протеїн захищає від індукованих азоксиметаном пухлин товстої кишки у раків самців щурів
- Вживаючи більше йогурту, харчові волокна можуть зменшити ризик раку легенів