Індекс маси тіла та базальний андростендіон є незалежними факторами ризику викидня при синдромі полікістозу яєчників
Анотація
Передумови
Існує обмежена кількість літератури, що досліджує вплив індексу маси тіла (ІМТ) та рівня андрогену на результати запліднення in vitro із застосуванням протоколу антагоністів гонадотропін-рилізинг-гормону (GnRH) при синдромі полікістозних яєчників (СПКЯ). Зміни, пов’язані з андрогенами, впливу індексу маси тіла (ІМТ) на результати ЕКО залишаються невідомими.
Методи
У цьому ретроспективному дослідженні було включено 583 безплідних жінок із СПКЯ, які перенесли ЕКО за допомогою звичайного протоколу GnRH-антагоніста. Пацієнтів розподілили на чотири групи за ІМТ та рівнем андрогенів: група із надмірною вагою - гіперандрогенія (НА), n = 96, група з надмірною вагою, яка не має ГК, n = 117, група людей із надмірною вагою HA, n = 152, і група з надмірною вагою та без HA, n = 218.
Результати
Було вилучено значно більшу кількість ооцитів, а загальне споживання Gn, а також споживання Gn на день було значно нижчим, у групах із надмірною вагою, ніж у групах із надмірною вагою. Кількість доступних ембріонів було значно вищим у групах HA, ніж у групах, що не є HA. Клінічна частота вагітності не мала суттєвої різниці серед чотирьох груп. Рівень народжуваності в групах із надмірною вагою був значно нижчим, ніж у групах із надмірною вагою та без ГА (23,9, 28,4% проти 42,5%, P 2 та 10,95 нмоль/л відповідно.
Висновки
У циклах ЕКО за протоколом GnRH-антагоніста спостерігалася економічна вигода у пацієнтів із СПКЯ, що не страждають від надмірної ваги, з меншою вартістю Gn та більшою кількістю ооцитів. ІМТ та базальний І були суттєво впливовими факторами з помірною прогностичною здатністю на частоту викиднів. Прогностичне значення базального І при викидні було трохи сильнішим, ніж ІМТ.
Вступ
Для безплідних жінок із синдромом полікістозних яєчників (СПКЯ), які не втручаються у спосіб життя та індукційну терапію овуляції або мають додаткові фактори безпліддя, може застосовуватися запліднення in vitro (ЕКЗ). Помірні дані свідчать про те, що протокол антагоніста гонадотропіну (Gn) -вивільняючого гормону (GnRH) може значно зменшити частоту синдрому гіперстимуляції яєчників (OHSS) [1,2,3], і використання протоколу GnRH-антагоніста поступово прийнятий клініцистами. Фенотипові вираження СПКЯ включають олігоовуляцію/ановуляцію, гіперандрогенію (ГК), полікістоз яєчників, надмірна вага/ожиріння та інсулінорезистентність/метаболічний синдром [4]. Існує обмежена кількість літератури, що вивчає клінічний фенотип пацієнтів із СПКЯ, котрі можуть отримати найбільшу користь від протоколу GnRH-антагоніста під час ЕКО.
У Китаї 34,63% пацієнтів із СПКЯ мають індекс маси тіла (ІМТ) понад 23 кг/м 2 [5]. Існують різні думки щодо ролі ІМТ у результатах ЕКО. У 2016 році Провост та ін. [6] проаналізував в цілому 239127 свіжих циклів ЕКО та продемонстрував прогресивне та статистично значуще погіршення результатів у групах із більш високим ІМТ, включаючи цикли, які виконувались спеціально для СПКЯ або чоловічого фактора безпліддя. Бейлі та ін. [7] також вказав, що жінки з ожирінням, які страждають на СПКЯ, мали менші шанси на клінічну вагітність та живонародження, ніж худорляві жінки з СПКЯ, тоді як спостерігалася тенденція до зменшення рівня захворюваності на СГЯ із збільшенням ІМТ серед жінок із СПКЯ. Однак Dechaud et al. [8] показали, що пацієнтам з ожирінням потрібна більша доза рекомбінантного фолікулостимулюючого гормону (r-FSH), але це не мало жодного негативного впливу на ЕКО, включаючи частоту скасування, частоту імплантації та частоту вагітності. Метваллі та ін. [9] виявив, що ожиріння негативно вплинуло на якість ембріонів у молодих жінок, які перенесли ЕКО/інтрацитоплазматичну ін’єкцію сперми, тоді як якість ооцитів не впливало.
Поширеність біохімічної НА у пацієнтів із СПКЯ становить 78,2% [10]. Дослідження ролі ГК у результатах ЕКО обмежені. Недавнє дослідження повідомило, що HA у жінок із СПКЯ не компрометував результати ЕКО, навпаки, сприяв отриманню значно більшої кількості ооцитів [11]. У нашому недавньому дослідженні HA також позитивно впливав на кількість вилучених ооцитів, де це також пов'язано із частотою викиднів [12]. І навпаки, в іншому дослідженні було зроблено висновок, що поєднання НА та хронічної ановуляції асоціювалося з негативним впливом на клінічний рівень вагітності у пацієнтів із СПКЯ [13]. Ендокринні порушення ускладнені у пацієнтів із СПКЯ. HA та ожиріння взаємодіють між собою та сприяють прогресуванню СПКЯ. Однак на сьогодні мало досліджень досліджували ІМТ та рівень андрогенів разом. Отже, це дослідження було покликане оцінити, чи змінюється вплив ІМТ на результати ЕКО залежно від рівня андрогену при СПКЯ за протоколом GnRH-антагоніста.
Матеріали і методи
У період із січня 2013 року по грудень 2015 року в Центр репродуктивної медицини Третьої лікарні Пекінського університету було пройдено скринінг та включено до дослідження 583 безплідних пацієнтів із СПКЯ, які отримували звичайний протокол антагоністів GnRH. Були включені пацієнти з СПКЯ у віці від 20 до 35 років, які проходили перший цикл ЕКО. Критерії виключення включали ендометріоз, попередній хірургічний анамнез яєчників, гідросальпінкс, важку олігоастеноспермію або азооспермію та системні захворювання, такі як цукровий діабет та гіпо- або гіпертиреоз. Це ретроспективне когортне дослідження було схвалено Інституційною комісією з огляду акушерства та гінекології Третього госпіталю Пекінського університету, Пекін, Китай.
У всіх випадках СПКЯ діагностували згідно з критеріями Роттердама 2003 р. [14]. ІМТ розраховували за такою формулою: ІМТ = вага/зріст 2 (кг/м 2). HA діагностували за рівнем тестостерону ≥ 2,2 нмоль/л або за рівнем AND ≥ 12 нмоль/л. Рівні тестостерону та І були отримані в результаті оцінки базальних статевих гормонів. Це когортне дослідження включало чотири групи пацієнтів із СПКЯ: ІМТ ≥ 25 кг/м 2 з ГК (група із надмірною вагою ГК, n = 96), ІМТ ≥ 25 кг/м 2 із нормальним вмістом андрогену (група із надмірною вагою, яка не має ГК, n = 117), ІМТ 2 з HA (група, що не має надміру ваги HA), n = 152) та ІМТ 2 із нормальним андрогеном (група, що не має зайвої ваги та не має HA), n = 218).
Всім пацієнтам стимулювали комбінацію антагоніста GnRH (цетрорелікс; SeronoMunich, Німеччина) та препарату r-FSH (Gonal-f; Merck Serono, Мюнхен, Німеччина) для розвитку множинних фолікулів. Контрольована гіперстимуляція яєчників була розпочата з 2-го дня менструального періоду, коли за допомогою УЗД не було виявлено фолікула діаметром> 10 мм, а рівень естрадіолу в сироватці крові був
Результати
Базові характеристики пацієнтів наведені в таблиці 1. Істотних відмінностей у віці, базальному ФСГ та кількості антральних фолікулів між групами не виявлено. Тривалість безпліддя була значно вищою у групах із надмірною вагою, ніж у групах із неповною вагою. Базальний рівень лютеїнізуючого гормону (ЛГ) був значно вищим у групах ГК, ніж у групах, що не входили до ГА.
Характеристики реакцій яєчників серед чотирьох груп пацієнтів наведені в таблиці 2. Кількість вилучених ооцитів та рівень естрадіолу в день введення ХГЧ були значно вищими у групах, що не мали надмірної ваги, ніж у групах із надмірною вагою, хоча загальне споживання Gn, а також споживання Gn на день, було значно нижчим у групах, що не мають надлишкової ваги. Незважаючи на вплив ІМТ, споживання Gn на кілограм було значно нижчим у групах HA. Як і у випадку кількості вилучених ооцитів, швидкість скасування переносу ембріонів для запобігання СГЯ була значно вищою в групах із надмірною вагою, ніж у групах із надмірною вагою. На відміну від базових рівнів ЛГ, які були пов’язані з базальним рівнем андрогену, рівні ЛГ у день введення ХГЧ були значно нижчими в групах із надмірною вагою, ніж у групах із надмірною вагою. Кількість доступних ембріонів була вищою в групі, що не страждає від надмірної ваги, ніж у групі, що не має надмірної ваги. Рівень прогестерону (Р4) та товщина ендометрію на день введення ХГЧ не відрізнялися серед чотирьох груп. Аналогічно, швидкість запліднення та швидкість розщеплення були порівнянними серед чотирьох груп.
Результати вагітності представлені в таблиці 3. Частота викиднів була значно вищою у групі із надмірною вагою ГК, ніж у групі, що не страждала від надмірної ваги. Рівень живонародженості був значно нижчим у групах із надмірною вагою, ніж у групах із надмірною вагою та без HA. У групах ГА позаматкової вагітності не було. Не було виявлено відмінностей у показниках клінічної вагітності, передчасної вагітності, близнюкової вагітності або кесаревого розтину серед досліджуваних груп.
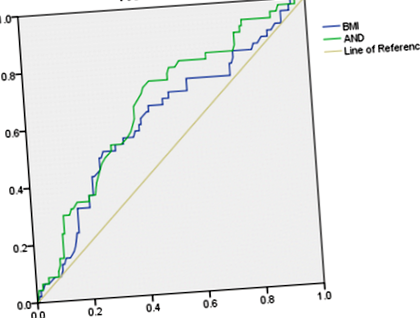
Багатовимірний логістичний регресійний аналіз та аналіз ROC були проведені для визначення прогностичних факторів частоти викиднів. Параметрами, які можуть негативно вплинути на частоту викиднів, були вік, ІМТ, базальний тестостерон, базальний І, споживання Gn/кг/добу та кількість отриманих ооцитів. Ці параметри, а також рівні ЛГ (як базальний ЛГ, так і ЛГ в день введення ХГЧ), були обрані для багатовимірного логістичного регресійного аналізу. Після корекції впливу інших параметрів ІМТ та базальний І показали незалежно значущі відмінності у прогнозуванні частоти викиднів (табл. 4). Для визначення оптимальних граничних значень ІМТ та базального І було проведено аналіз ROC (рис. 1). Площі під кривою (AUC) для ІМТ та базального І становили 0,607 (P = 0,029) та 0,657 (P = 0,001) відповідно (табл. 5). Було продемонстровано, що ці два параметри мають помірну прогностичну здатність при викидні, чутливість 0,511-0,723 та специфічність 0,584-0,737. Порогові значення були такими: ІМТ, 25,335 кг/м 2; і базальний І, 10,95 нмоль/л.
Аналіз кривих робочої характеристики приймача (ROC) індексу маси тіла (ІМТ) та андростендіону (AND) на прогнозування частоти викиднів. Зелена лінія та синя лінія представляють І та ІМТ відповідно, а бежева лінія є посиланням
Обговорення
Близько 70–80% випадків ановуляторного безпліддя спричинені СПКЯ [15]. Як терапію ЕКО можна безпечно застосовувати у безплідних жінок із СПКЯ, особливо за протоколом антагоністів GnRH. На сьогоднішній день є мало досліджень, які досліджували параметри ІМТ та андрогену разом із використанням антагоністів GnRH. У цьому дослідженні метою було оцінити зміни, пов’язані з андрогеном, впливу індексу маси тіла (ІМТ) на результати ЕКО.
Одним з обмежень нашого дослідження є його ретроспективний дизайн. Ефекти ІМТ та HA оцінюються в когортному дослідженні за допомогою логістичного регресійного аналізу та аналізу ROC, показуючи оптимальні граничні значення ІМТ та базального І. Незважаючи на те, що AUC в аналізі ROC значно відрізняються, прогнозована здатність обох параметрів на викидень є помірною, через відносно обмежений обсяг вибірки. У майбутньому необхідні перспективні дослідження з більшим обсягом вибірки, поряд із дослідженнями наслідків гіперінсулінемії.
Висновки
На закінчення, надмірна вага була фактором ризику як для неякісних ембріонів, так і для викидня. Однак HA був позитивно впливовим фактором для якісних ембріонів, але фактором ризику викидня. Багатовимірний логістичний регресійний аналіз показує, що ІМТ та базальний І були суттєво впливовими факторами на частоту викиднів із помірною прогностичною здатністю. Прогностичне значення базального І при викидні було трохи сильнішим, ніж ІМТ.
Список літератури
Balen AH, Morley LC, Misso M, et al. Лікування ановуляторного безпліддя у жінок із синдромом полікістозних яєчників: аналіз доказів на підтримку розробки глобальних вказівок ВООЗ. Оновлення Hum Reprod. 2016; 22 (6): 687–708.
Kollmann M, Martins WP, Lima ML, et al. Стратегії покращення результатів допоміжної репродукції у жінок із синдромом полікістозу яєчників: систематичний огляд та мета-аналіз. Ультразвуковий акушер-гінекол. 2016; 48 (6): 709–18.
Сяо Дж., Чень С., Чжан С. та ін. Ефективність антагоніста GnRH у лікуванні пацієнтів із синдромом полікістозних яєчників, які перенесли ЕКО: систематичний огляд та мета-аналіз. Гінеколь Ендокринол. 2013; 29 (3): 187–91.
Fauser BC, Tarlatzis BC, Rebar RW та ін. Консенсус щодо аспектів здоров’я жінок при синдромі полікістозних яєчників (СПКЯ): третя група з питань консенсусу, яка фінансується Амстердамом ESHRE/ASRM. Фертил Стерил. 2012; 97 (1): 28–38.
Chen X, Ni R, Mo Y, et al. Відповідні рівні ІМТ для пацієнтів із СПКЯ на півдні Китаю. Hum Reprod. 2010; 25 (5): 1295–302.
Provost MP, Acharya KS, Acharya CR та ін. Результати вагітності знижуються із збільшенням індексу маси тіла: аналіз 239127 свіжих аутологічних циклів запліднення in vitro із реєстру Товариства допоміжних репродуктивних технологій 2008-2010 років. Фертил Стерил. 2016; 105 (3): 663–9.
Бейлі А.П., Хокінс Л.К., Місмер С.А. та ін. Вплив індексу маси тіла на результати запліднення in vitro у жінок із синдромом полікістозу яєчників. Am J Obstet Gynecol. 2014; 211 (2): 163 – e1.
Dechaud H, Anahory T, Reyftmann L, et al. Ожиріння не робить негативного впливу на результати у пацієнтів, які перебувають на заплідненні in vitro та перенесенні ембріонів. Eur J Obstet Gynecol Reprod Biol. 2006; 127 (1): 88–93.
Metwally M, Cutting R, Tipton A, et al. Вплив підвищеного індексу маси тіла на якість ооцитів та ембріонів у хворих на ЕКО. Reprod BioMed Online. 2007; 15 (5): 532–8.
Alexiou E, Hatziagelaki E, Pergialiotis V, et al. Гіперандрогенемія у жінок із синдромом полікістозних яєчників: поширеність, характеристики та зв'язок з індексом маси тіла. Horm Mol Biol Clin Investig. 2017; 29 (3): 105–11.
Gaddas M, Chaouache N, Ajina M, et al. Чи перешкоджає гіперандрогенний закон при синдромі полікістозу яєчників успіху запліднення in vitro? J Gynecol Obstet Biol Reprod. 2016; 45 (9): 1091–8.
Ян В, Ян Р, Ян С та ін. Пацієнти з безплідним полікістозом яєчників, які піддаються заплідненню in vitro за протоколом антагоністів вивільнення гонадотропіну: роль гіперандрогенії. Гінеколь Ендокринол. 2018 серп .; 34 (8): 715–8.
Ramezanali F, Ashrafi M, Hemat M, et al. Допоміжні репродуктивні результати у жінок з різними фенотипами синдрому полікістозних яєчників: прогностичне значення анти-мюллерівського гормону. Reprod BioMed Online. 2016; 32 (5): 503–12.
Роттердам ESHRE/ASRM-спонсорована група з питань консенсусу СПКЯ. Переглянутий консенсус 2003 року щодо діагностичних критеріїв та довгострокових ризиків для здоров’я, пов’язаних із синдромом полікістозних яєчників (СПКЯ). Hum Reprod. 2004; 19 (1): 41–7.
Brassard M, AinMelk Y, Baillargeon JP. Основне безпліддя, включаючи синдром полікістозу яєчників. Med Clin North Am. 2008; 92 (5): 1163–92.
Лірі С, Ліз Х.Г., Стурмі Р.Г. Людські ембріони жінок із надмірною вагою та ожирінням виявляють фенотипові та метаболічні відхилення. Hum Reprod. 2015; 30 (1): 122–32.
Valckx SD, De Pauw I, De Neubourg D, et al. ІМТ-пов’язаний метаболічний склад фолікулярної рідини жінок, які проходять допоміжне репродуктивне лікування, та наслідки для якості ооцитів та ембріонів. Hum Reprod. 2012; 27 (12): 3531–9.
Kimura S, Matsumoto T, Matsuyama R, et al. Функція рецепторів андрогенів у фолікулогенезі та його клінічне значення при передчасній недостатності яєчників. Тенденції Ендокринол Метаб. 2007; 18 (5): 183–9.
Nekoonam S, Naji M, Nashtaei MS, et al. Експресія AKT1 разом з AKT2 у гранульозно-лютеїнових клітинах пацієнтів з гіперандрогенною СПКЯ. Arch Gynecol Obstet. 2017; 295: 1041–50.
Freis A, Renke T, Kammerer U, et al. Вплив гіперандрогенемічного стану на потенціал проліферації та децидуалізації в стромальних клітинах ендометрія людини. Arch Gynecol Obstet. 2017; 295: 1005–13.
Cermik D, Selam B, Taylor HS. Регулювання експресії HOXA-10 тестостероном in vitro та в ендометрії пацієнтів із синдромом полікістозних яєчників. J Clin Ендокринол Метаб. 2003; 88: 238–43.
Подяка
Автори дякують Дослідницькому центру клінічної епідеміології, Третя лікарня Пекінського університету, за підтримку в статистичному аналізі. Автори дякують Розеллі, досвідченому редактору, першою мовою якого є англійська, за ретельний перегляд статті.
Фінансування
Ця робота була підтримана Національним фондом природничих наук Китаю [81550022].
Наявність даних та матеріалів
Набори даних, використані та/або проаналізовані під час поточного дослідження, доступні з бази даних Центру репродуктивної медицини Третьої лікарні Пекінського університету на обґрунтований запит.
Інформація про автора
Приналежності
Центр репродуктивної медицини, кафедра акушерства та гінекології, Третя лікарня Пекінського університету, 49 N Garden Rd, район Хайдянь, Пекін, 100191, Китай
Ван Ян, Руй Ян, Мінгмей Лін, Ян Ян, Сюелінг Сонг, Цзяцзя Чжан, Шуо Ян, Ін Сон, Цзя Лі, Тяньшу Панг, Фен Ден, Ін Ван, Ронг Лі і Цзе Цзяо
Дослідницький центр клінічної епідеміології, Третя лікарня Пекінського університету, Пекін, Китай
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Внески
WY розроблені дослідження. WY, RY, MML, SY, JJZ, YY, SLS, YS та TSP зібрали дані. WY, FD, JL, HZ аналізували дані. WY, YW, RL та JQ написали та переглянули рукопис. Усі автори прочитали та схвалили остаточний рукопис.
Відповідний автор
Декларації про етику
Схвалення етики та згода на участь
Це дослідження було схвалено Інституційною комісією з огляду акушерства та гінекології Третьої лікарні Пекінського університету. Оскільки це ретроспективне дослідження, пацієнтів не просили брати участь у цьому дослідженні.
Згода на публікацію
Конкуруючі інтереси
Автори заявляють, що у них немає конкуруючих інтересів.
Примітка видавця
Springer Nature залишається нейтральним щодо юрисдикційних вимог в опублікованих картах та інституційних приналежностей.
- Індекс маси тіла, жирність живота та ризик раптової серцевої смерті систематичний огляд та
- Індекс маси тіла та ризик післяопераційного витоку ліквору після транссфеноїдального
- Асоціація дисфункціональних маткових кровотеч з високим індексом маси тіла та ожирінням як основною
- Зв'язок між індексом маси тіла та сечокам'яною хворобою
- Індекс маси тіла (bmi), що це, симптоми, причини, профілактика та лікування Найкращі лікарі