Хронічна дієта з високим вмістом жиру порушує збір функції лімфатичних судин у мишей
Катрін С. Блюм
1 Інститут фармацевтичних наук, Швейцарський федеральний технологічний інститут, ETH Цюріх, Цюріх, Швейцарія,
Синем Караман
1 Інститут фармацевтичних наук, Швейцарський федеральний технологічний інститут, ETH Цюріх, Цюріх, Швейцарія,
Стівен Т. Проулкс
1 Інститут фармацевтичних наук, Швейцарський федеральний технологічний інститут, ETH Цюріх, Цюріх, Швейцарія,
Олександра М. Оксенбейн
1 Інститут фармацевтичних наук, Швейцарський федеральний технологічний інститут, ETH Цюріх, Цюріх, Швейцарія,
Паола Лучані
1 Інститут фармацевтичних наук, Швейцарський федеральний технологічний інститут, ETH Цюріх, Цюріх, Швейцарія,
Жан-Крістоф Леру
1 Інститут фармацевтичних наук, Швейцарський федеральний технологічний інститут, ETH Цюріх, Цюріх, Швейцарія,
Крістіан Вольфрум
2 Інститут харчування, харчування та здоров'я, Швейцарський федеральний технологічний інститут, ETH Цюріх, Шверценбах, Швейцарія,
Майкл Детмар
1 Інститут фармацевтичних наук, Швейцарський федеральний технологічний інститут, ETH Цюріх, Цюріх, Швейцарія,
Задумав і спроектував експерименти: KSB SK STP CW MD. Виконував експерименти: КСБ СК СТП. Проаналізовано дані: KSB SK STP MD. Внесені реагенти/матеріали/інструменти для аналізу: AMO PL JCL. Написав папір: KSB SK STP MD.
Пов’язані дані
Анотація
Вступ
Ми мали на меті дослідити, як і як ожиріння, спричинене дієтою, впливає на морфологію та функцію лімфатичної судини. З цією метою мишей годували дієтою з високим вмістом жиру (HFD), а потім ми проводили морфометричні оцінки лімфатичних судин і використовували візуалізацію ближнього інфрачервоного випромінювання з високою роздільною здатністю для кількісного дослідження функції збору лімфатичних судин у задній частині мишей in vivo. У трьох різних штамах мишей ми виявили, що HFD асоціюється з порушенням функції збору лімфатичних судин. Ці результати свідчать про те, що дисфункція лімфатичної системи може бути спричинена розширенням жирової тканини.
Матеріали і методи
3.1 Моделі тварин - Заява про етику
Самці C57BL/6J: мишей ICR (n = 20), мишей FVB (n = 16) та мишей K14-VEGF-C [13] (n = 8) утримували в звичайних умовах SPF. Для кожного штаму, починаючи з 4-тижневого віку, половині мишей був наданий доступ до стандартного чау (чау; 11% ккал від жиру, 31% ккал від білка та 58% ккал від вуглеводів; Provimi-Kliba, Kaiseraugst, Швейцарія), а друга половина - до дієти з високим вмістом жиру (HFD; 60% ккал від жиру, 20% ккал від білка та 20% ккал від вуглеводів; Research Diets Inc., New Brunswick, NJ, USA) протягом 17 тижнів або 31 тиждень. Мишей знеболювали i.p. ін’єкція 0,2 мг/кг медетомідину та 80 мг/кг кетаміну для візуалізації. Мишей жертвували передозуванням анестезії (1000 мг/кг кетаміну/3,5 мг/кг медетомідину) з подальшим вивихом шийки матки. Всі експерименти проводились відповідно до протоколів на тваринах, затверджених Kantonales Veterinäramt Zürich.
3.2 Аналіз вмісту води
Вміст води аналізували, як описано раніше [9]. Коротко, зразки шкіри спини збирали за допомогою біопсійних штампів 6 мм (Acuderm, Fort Lauderdale, FL, USA). Зразки зважували після збору і висушували ліофілізацією протягом 24 годин. Після цього зразки знову зважували і обчислювали втрату ваги. Оскільки ця процедура видаляла воду з тканин, втрата ваги представляла вміст води в тканині.
3.3 Гістологічний та імунофлуоресцентний аналізи
Кріосекції хвостів (7 мкм) фіксували протягом 2 хв в ацетоні (–20 ° C) і протягом 5 хв у 80% метанолі (4 ° C), промивали в PBS і інкубували протягом ночі (4 ° C) з хом'ячком проти -подопланінові антитіла (клон 8.1.1, Дослідження розвитку Hybridoma Bank, Університет Айови) та антитіла до Meca32 щурів (1-200, BD Pharmingen, Allschwil), або кролячі анти-LYVE-1 (1-600, AngioBio) та щурячий анти-CD31 (1∶200, BD Pharmingen). Потім зразки інкубували протягом 30 хв з кон’югованими Alexa488- і Alexa594 вторинними антитілами (1∶200) та Hoechst 33342 (1∶1000; усі з Invitrogen, Базель, Швейцарія). Регулярне фарбування гематоксиліном застосовували для фарбування парафінових зрізів (8 мкм) хвоста.
3.4 Морфометричний та морфологічний аналізи
Імунофлуоресцентні плями зрізів шкіри хвоста для позитивних до подопланіну лімфатичних судин та судин, позитивних до Meca32, досліджували на мікроскопі Axioskop 2 mot plus (Carl Zeiss, Фельдбах, Швейцарія), а також зображення 3 - 5 окремих полів зору на секцію були придбані за допомогою камери AxioCam MRc із об'єктивом Plan-APOCHROMAT 10 ×/0.45 NA та програмним забезпеченням AxioVision 4.7.1 (Carl Zeiss, Feldbach, Швейцарія). Товщину епідермісу, дерми та жирової тканини визначали на парафінових зрізах шкіри хвоста, пофарбованих гематоксиліном. Морфометричний аналіз судин та товщини тканин проводили за допомогою програмного забезпечення ImageJ [14].
3.5 Імунозабарвлення цілого кріплення
3.6 Візуалізація функції лімфатичних судин in vivo
Для лімфатичної візуалізації був використаний стереомікроскоп Zeiss StereoLumar.V12, пристосований для візуалізації NIR [15]. Відео записували під час внутрішньошкірного введення лімфоспецифічних індикаторів P20D680 або P40D680 у стопу [15]. Додаткові відеозаписи для візуалізації скоротливості збору лімфатичних судин, що дренують нижню кінцівку, були отримані до і після механостимуляції місця ін'єкції. Механостимуляцію проводили за допомогою ватного тампона, який обережно натискали на місце ін’єкції один раз на секунду протягом десяти секунд, щоб стимулювати початкове поглинання лімфосигналізатора та продемонструвати здатність лімфатичної системи реагувати на раптове навантаження рідини [15]. Для оцінки частоти накопичення скорочень лімфатичних судин проводили аналіз інтенсивності флуоресценції (ROI). Реакцію на механостимуляцію оцінювали, визначаючи кратну зміну середньої інтенсивності флуоресценції протягом 30 с періоди безпосередньо перед механостимуляцією і починаючи з 30 с після механостимуляції.
3.7 Аналіз перфузійної ділянки шкіри
Два-три NIR-зображення задньої кінцівки поєднувались разом, щоб отримати огляд всієї ноги - включаючи щиколотку і дистальну третину верхньої частини ноги - за допомогою програмного забезпечення Photoshop v 5.0 (Adobe Systems). Прямокутний ROI шириною 6 мм і висотою 15 мм розміщували на знімку NIR, приймаючи за орієнтир середню точку дуги спинного лімфатичного судини, і зображення обрізали. Потім загальну площу шкіри та проникну фарбою ділянку на обрізаному зображенні вимірювали вручну, використовуючи інструмент полігонального ласо в програмному забезпеченні Photoshop. Потім зону перфузії розраховували як відсоток від загальної площі шкіри.
3.8 Статистичний аналіз
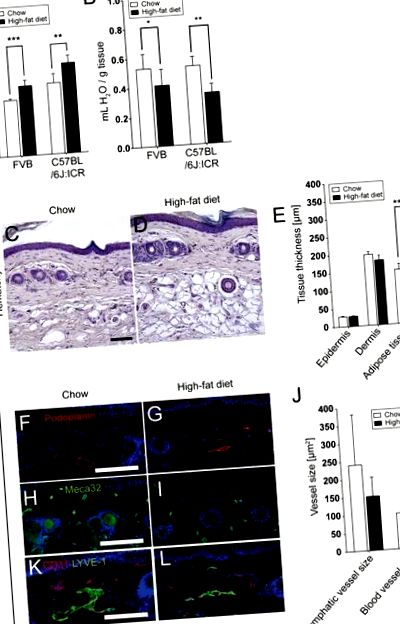
Усі дані відображаються як середнє значення ± SD. Засоби груп порівнювали за допомогою t-критерію Стьюдента; Корекція Уелча застосовувалась у випадку неоднакових дисперсій, а для порівняння ненормально розподілених даних використовувався U-тест Манна-Уітні. P Рисунок 1A). Вміст води в шкірі спини зменшився через 17 тижнів при HFD (FVB: HFD, 0,41 ± 0,11 мл/г проти чау, 0,53 ± 0,10 мл/г; P = 0,0405; C57BL/6J: ICR: HFD, 0,34 ± 0,06 мл/г проти чау, 0,53 ± 0,06 мл/г; Р = 0,0013; Малюнок 1В). У хвостах було виявлено значне збільшення жирової тканини з гіпертрофічними адипоцитами (малюнки 1С та D) (товщина підшкірного шару в HFD, 269,5 ± 18,4 мкм проти чау, 150,8 ± 15,9 мкм; P Рисунок 1E).
Значно збільшилася маса тіла (A) та зменшився вміст води у шкірі в спині (B) після 17 тижнів HFD. Фарбування гематоксиліном (C, D) та кількісний аналіз зображень (E) виявили значно збільшену товщину жирової тканини, але не епідермісу або дерми, в шкірі хвоста мишей C57BL/6J: ICR HFD. Імунофлуоресцентні плями для подопланіну (F, G; червоний; лімфатичні судини) та Meca32 (H, I; зелений; кровоносні судини) та кількісний аналіз зображень (J) виявили зменшення середнього розміру шкірних лімфатичних судин, але не розміру кровоносних судин, після HFD. Шкала шкал = 100 мкм. Дані представляють середнє значення ± SD. * P≤0,05, ** P≤0,01, *** P≤0,001.
4.2 Порівняльна початкова щільність лімфатичних судин у шкірі
Імунофлуоресцентні плями для судин та лімфатичних судин проводили з використанням антитіл проти подопланіну та Meca32. Морфометричний аналіз судин і лімфатичних судин в дермі хвоста показав, що миші, яких годували HFD, мали тенденцію до зменшення середнього розміру шкірних лімфатичних судин (151,0 ± 53,3 мкм 2) порівняно з мишами, що годувались чау (240,2 ± 140,4 мкм 2; NS), тоді як кровоносні судини залишались незахищеними (HFD, 95,8 ± 8,8 мкм 2 проти чау, 99,9 ± 28,0; NS; Рисунок 1F-J). Ця тенденція також спостерігалася, коли хвости фарбували на LYVE-1 та CD31 (рис. 1К та L).
4.3 Порушення функції збору лімфатичних судин у мишей, що харчуються HFD
Потім ми оцінили функцію збірного судини в кінцівці мишей за допомогою NIR-зображень (рис. 2А). Спочатку ми візуалізували та кількісно визначили частоту скорочення аферентного збору лімфатичних судин біля входу в підколінну ЛН. Ми також визначили реакцію на гостре рідинне навантаження - за допомогою механостимуляції - аферентних колекторів у нижній кінцівці під час механостимуляції до місця ін’єкції.
NIR-візуалізацію (A) проводили після внутрішньошкірного введення 5 мкл 25 мкМ P20D680, індикатора, специфічного для поглинання в лімфатичні судини. Аналіз скоротливості лімфатичних судин проводили на аферентних судинах поблизу підколінної ЛН, а реакцію на механостимуляцію місця ін'єкції ватним тампоном оцінювали на лімфатичних судинах нижньої кінцівки. Нормальні (B) та нерегулярні (C) моделі скорочення у мишей чау та HFD відповідно. Аналіз лінійної регресії (D) показує значну негативну кореляцію між вагою та частотами скорочень. Нормальна (E) та порушена реакція (F) на механостимуляцію. Миші на HFD демонстрували знижену реакцію на механостимуляцію (G) порівняно з мишами на дієті чау. ** Р≤0,01.
Ми виявили, що скорочуваність збору лімфатичних судин на задніх лапах мишей, яких годували чау, здавалася нормальною, із частотою скорочень приблизно 9 на хвилину (Малюнок 2B, Рисунок S1A та Відео S1). На відміну від цього, скорочення збору лімфатичних судин у мишей HFD проходили без певної закономірності (Рисунок 2C, Рисунок S1A та Video S2,), а частоти скорочень значно зменшувались (чау: 9,0 ± 1,7 скорочень/хв проти HFD: 4,2 ± 1,1 скорочення/хв, Р = 0,0002). Існувала значна зворотна кореляція між вагою мишей та частотами скорочень як у FVB (r 2 = 0,68, P = 0,001; малюнок 2D), так і у C57BL/6J: ICR (r 2 = 0,52, P = 0,028; малюнок S1A ) штами.
Ми також виявили знижену відповідь на механостимуляцію у мишей на HFD. Звичайні миші демонстрували типову картину негайного збільшення сигналу в лімфатичних судинах, що збирають за течією, під час механостимуляції місця ін’єкції з подальшим повільним зменшенням сигналу з часом (рис. 2Е). На відміну від цього, у більшості мишей із HFD спостерігалося зменшення збільшення сигналу під час механостимуляції та явного зменшення сигналу з часом (рис. 2F). Ми оцінили цю відповідь, використовуючи складчасту зміну середньої інтенсивності флуоресценції збираючих лімфатичних судин від до і після механостимуляції. Використовуючи цю оцінку, ми виявили значне зменшення збільшення сигналу після механостимуляції при збиранні лімфатичних судин під HFD в обох FVB (чау: 2,4 ± 1,3 рази проти HFD: 1,5 ± 0,5 рази, P = 0,0079; малюнок 2G) і C57BL/6J: ICR миші (чау: 2,9 ± 0,1 рази проти HFD: 1,2 ± 0,2 рази, P = 0,0159; малюнок S1B).
4.4 Збільшення збору лімфатичних судин у нижній кінцівці
Фарбування CD31 (A, зелений) та αSMA (B, червоний) збору лімфатичних судин у мишей, що годували чау, порівнювали з забарвленнями CD31 (D) та αSMA (E) збору лімфатичних судин у мишей, що харчувались HFD. Спостерігалось збільшення лімфатичних судин, що збирали, у мишей, які годували HFD. Фарбування CD31 (G, зелений) та αSMA (H, червоний) лімфатичних судин, що не скорочують вуха, від мишей, що харчуються чау-чаєм, порівнювали з забарвленнями CD31 (J, зелений) та αSMA (K, червоний) від мишей, яких годували HFD. Великих відмінностей не спостерігалося. Об'єднані канали відображаються у (C, F, I та L). Шкала шкал = 50 мкм.
4.5 Зниження поширення індикатора в шкірних лімфатичних судинах у мишей K14-VEGF-C після HFD
Миші K14-VEGF-C мають розширену шкірну лімфатичну судинну мережу і демонструють посилене поширення індикаторів через ці судини з місця внутрішньошкірного введення (рис. S2) [13], [17], [18]. Ці миші також мають збільшені лімфатичні судини в шкірі порівняно з мишами дикого типу (дані не наведені). Ми припустили, що індуковане HFD розширення підшкірної жирової тканини може змінити розповсюдження лімфатичного сліду в початкових шкірних лімфатичних судинах мишей K14-VEGF-C. Подібно до результатів у мишей дикого типу, ми виявили нерегулярні частоти скорочення лімфатичних судин у мишей K14-VEGF-C на HFD (рис. 4A-C), зі значною зворотною кореляцією між частотою лімфатичних скорочень та масою тіла (r 2 = 0,75, Р = 0,0053). Миші K14-VEGF-C під час дієти чау виявляли виражене поширення лімфатичного маркера по розширених шкірних лімфатичних судинах (рис. 4D та відео S3). Навпаки, розповсюдження індикатора було зменшено в умовах HFD (рис. 4E та Video S4), що призвело до суттєвої різниці в площі шкіри, яка переливається слідом у шкірних лімфатичних судинах між чау та мишами, що харчуються HFD (чау: 62,1 ± 25,7% проти HFD: 8,5 ± 8,0%, P = 0,0286; Рисунок 4F).
NIR-візуалізацію проводили після внутрішньошкірної ін’єкції 5 мкл 25 мкМ P20D680. Нормальні (A) та нерегулярні (B) моделі скорочення у мишей чау та HFD відповідно. Аналіз лінійної регресії (С) показує значну негативну кореляцію між вагою та частотами скорочень. Високе (D) та низьке (E) поширення індикатора в шкірних лімфатичних судинах у мишей, що годували чау та HFD, відповідно, через 15 хвилин візуалізації. Шкала шкали = 2 мм. Кількісне визначення (F) показує нижчий відсоток перфузованих лімфатичних судин шкіри в нижній кінцівці мишей на HFD порівняно з дієтою чау. * P≤0,05.
Обговорення
У цьому дослідженні виявлено морфологічні та функціональні зміни збору лімфатичних судин на кінцівках мишей із ожирінням. За допомогою NIR лімфатичної візуалізації збору лімфатичних судин ми виявили знижену частоту скорочень та знижену реакцію на механостимуляцію у трьох різних штамів миші, які отримували HFD. Морфологічно скорочувальні лімфатичні судини задньої кінцівки виявилися більшими у мишей, яким годували HFD, порівняно з мишами, що годували чау. У поєднанні з нашими висновками про зменшення поширення індикаторів у шкірних лімфатичних судинах у мишей K14-VEGF-C, що харчуються HFD, ці результати свідчать про те, що посилення розширення підшкірної жирової тканини у відповідь на HFD може бути шкідливим для лімфатичного транспорту. Ці висновки узгоджуються з нещодавньою доповіддю про зменшення лімфатичного транспорту у мишей, які харчуються з високим вмістом жиру з використанням методів візуалізації PET-CT [10]. Наші результати вказують на те, що ця знижена транспортна здатність може бути частково обумовлена впливом на збираючі лімфатичні судини, на додаток до структурних змін у дренуючих лімфатичних вузлах, запропонованих у попередньому дослідженні [10].
Довідкова інформація
Рисунок S1
Порушення збору лімфатичних судин функціонує після 17 тижнів HFD у C57BL/6J: миші ICR. Візуалізацію NIR проводили після внутрішньошкірного введення 5 мкл 25 мкМ P40D680, індикатора, специфічного для поглинання в лімфатичні судини. (A) Нормальні та нерегулярні моделі скорочення у мишей чау (n = 5) та HFD (n = 5) відповідно. Аналіз лінійної регресії показує значну негативну кореляцію між вагою та частотами скорочень. (B) Нормальна та погіршена реакція на механостимуляцію. Відео було розпочато через 15 с після механостимуляції. Миші на HFD демонстрували знижену реакцію на механостимуляцію порівняно з мишами на дієті чау. ** Р≤0,01
Рисунок S2
Поширення індикаторів у шкірних лімфатичних судинах у мишей K14-VEGF-C. Візуалізацію NIR проводили після внутрішньошкірного введення 5 мкл 25 мкМ P20D680 мишам K14-VEGF-C. Через гіперплазію шкірних лімфатичних судин у цього штаму миші індикатор поширюється по всій цій поверхневій сітці судин, а не зливається переважно в глибші збірні лімфатичні судини. Репрезентативна миша через 5 хвилин після ін’єкції (A) та через 10 хвилин після ін’єкції (B). Більше збільшення (С) демонструє, що індикатор міститься в шкірних лімфатичних судинах.
Відео S1
NIR-лімфатична візуалізація аферентного збору лімфатичних судин, що стікають у підколінну ЛН у миші FVB після 17 тижнів дієти чау. Візуалізацію проводили після ін’єкції P20D680 (5 мкл 25 мкМ) у спинну шкіру стопи та спостерігали поглинання в лімфатичні судини. Відео має 10-кратну нормальну швидкість і було отримано за допомогою фільтра Cy5, встановленого на 1 кадр/с.
Відео S2
NIR лімфатична візуалізація аферентного збору лімфатичних судин, що стікають у підколінну LN у миші FVB після 17 тижнів HFD. Візуалізацію проводили після ін’єкції P20D680 (5 мкл 25 мкМ) у спинну шкіру стопи та спостерігали поглинання в лімфатичні судини. Відео має 10-кратну нормальну швидкість і було отримано за допомогою фільтра Cy5, встановленого на 1 кадр/с.
Відео S3
NIR візуалізація лімфатичних судин нижньої кінцівки у миші K14-VEGF-C після 17 тижнів дієти чау. Візуалізацію розпочали через 30 с після ін’єкції P20D680 (5 мкл 25 мкМ) у спинну шкіру стопи. Було помічено поширення лімфатичного індикатора в шкірних лімфатичних судинах. Відео має 10-кратну нормальну швидкість і було отримано за допомогою фільтра Cy5, встановленого на 1 кадр/с.
Відео S4
NIR візуалізація лімфатичних судин, що стікають у нижню кінцівку у миші K14-VEGF-C після 17 тижнів HFD. Зображення розпочали через 30 секунд після ін’єкції P20D680 (5 мкл 25 мкМ) у спинну шкіру стопи. Поширення лімфатичного індикатора в шкірних лімфатичних судинах не спостерігалося. Відео має 10-кратну нормальну швидкість і було отримано за допомогою фільтра Cy5, встановленого на 1 кадр/с.
Подяка
Ми дякуємо Жаннет Шолл за чудову технічну допомогу та Карлосу Очоа за допомогу в експериментах на тваринах.
Заява про фінансування
Ця робота була підтримана грантами Швейцарського національного наукового фонду 31003A_130627 та 310030B_137087, грантом Advanced European Research Council LYVICAM та Transatlantic Netland of Excellence in Cardiovascular Research (для доктора медицини) Фонду Ледук. KSB отримав стипендію від Німецького науково-дослідного фонду (DFG: BL 1136/1-1). Фінансисти не мали жодної ролі у розробці досліджень, зборі та аналізі даних, прийнятті рішення про публікацію чи підготовці рукопису.
- Curdlan запобігає когнітивному дефіциту, викликаному дієтою з високим вмістом жиру у мишей, через вісь кишково-мозку
- Вплив Momordica charantia на резистентність до інсуліну та вісцеральне ожиріння у мишей на дієті з високим вмістом жиру
- Порівняння графіків прийому рапаміцину у мишей на дієті з високим вмістом жиру - PubMed
- Дієта, що обмежує амінокислоту сірки, запускає у мишей утворення судин; Гарвардський вісник
- Хронічна активація протеїнкінази, що активується AMP, і дієта з високим вмістом жиру мають адитивний ефект