Гомогенат
Гомогенати можна отримати шляхом здавлювання та розтирання тканини в поліетиленовому пакеті або за допомогою перистальтичного блендера.
Пов’язані терміни:
- Антитіла
- Фермент
- Білок
- ДНК
- LD50
- Супернатант
- Іон кальцію
Завантажити у форматі PDF
Про цю сторінку
Системи гормональної поведінки не ссавців
Грегорі Ф. Болл, Жак Бальтазарт, у "Гормони, мозок і поведінка" (третє видання), 2017
2.11.6.4.1 Дослідження in vitro
Було показано, що активність ароматази в передоптичних гомогенатах перепелів швидко пригнічується фосфорилюючими умовами (зростає у фізіологічному діапазоні концентрацій АТФ, Mg 2+ та Са 2+), і цей процес блокується у присутності різних інгібіторів протеїнкінази. Це інгібування було скасовано в присутності 1 мМ EGTA, який хелатує вільний Ca 2+, присутній у гомогенатах (Balthazart et al., 2001a, 2003).
Аналіз гена ароматази у різних видів ссавців та птахів, включаючи перепелів, продемонстрував, що в цих послідовностях ароматази присутні кілька консенсусних місць фосфорилювання (залишки тирозину та серину/треоніну) (детально див. У Balthazart et al., 2003; Charlier et al. ., 2011а). Додаткові дослідження продемонстрували, що ці процеси фосфорилювання також знижують ферментативну активність ароматази в яєчнику перепелів та людської ароматази, трансфікованої в різних клітинних лініях, і що знижена активність пов’язана з посиленим фосфорилюванням білка ароматази. Спроби ідентифікувати шляхом сайт-спрямованого мутагенезу специфічні амінокислотні залишки, фосфорилювання яких опосередковує зміни ферментативної активності, проте не мали успіху (Charlier et al., 2011a).
Дослідження з використанням експлантів in vitro POA-гіпоталамуса також показали, що швидкі інгібування (протягом 5 хв) ароматази, імовірно (хоча це формально не демонструється), опосередковані фосфорилюванням, залежним від Ca 2+, також мають місце в інтактних нейронах. Ці інгібування можуть бути викликані деполяризацією, індукованою K +, впливом тапсигаргіну, лактону, відомого своєю здатністю мобілізувати внутрішньоклітинні басейни Са 2+, або впливом агоністів рецепторів глутамату (AMPA (аміно-метил-4-ізоксазол пропіонік кислоти), каїнату та меншою мірою NMDA (N-метил-d-аспарагінова кислота)) і є повністю оборотними (Balthazart et al., 2001a, 2006). Активність ароматази людини, трансфікована в спочатку негативні клітинні лінії, аналогічним чином знижувалася під дією K + -індукованої деполяризації та повністю відновлювалася протягом періоду змиву. Цікаво, що дослідження Вестерн-блот продемонстрували, що знижена ферментативна активність в умовах деполяризації не відповідає зменшенню концентрації ферментативного білка, викликаному, наприклад, розкладанням (Charlier et al., 2011a).
КОНСЕРВАНТИ | Аналіз
Інші консерванти
Біфеніл
Парова дистиляція гомогенатів шкірки цитрусових і екстракція дистиляту гептаном забезпечує зразок, який можна аналізувати на біфеніл методом ТШХ на силікагелі з гептаном як розчинником, що розвивається. Кількісний аналіз проводиться шляхом вилучення біфенілу із середовища ТШХ етанолом та вимірювання поглинання отриманих розчинів при 248 та 300 нм. Поглинання при 300 нм використовується для корекції фонової поглинання. Також доступні методи аналізу GLC.
Тіабендазол
Тіабендазол може бути вилучений з їжі з кислотою (HCl), в якій він згодом відновлюється цинком у 30% гліцерині + фенілендіаміну. Подальше окислення іонами заліза дає синій комплекс, який екстрагується в бутанол для спектрофотометричного вимірювання.
Молочна кислота
Стандартні методи визначення молочної кислоти передбачають її перетворення в комплекс Fe (III) для спектрофотометричного вимірювання або методом ГЖХ після повного метилювання. За допомогою ферментативної процедури молочна кислота перетворюється в піруват за допомогою NAD + (лактатдегідрогенази); продукт потрапляє в пастку, реагуючи з глутаматом (глутамат-піруват-трансаміназа) з метою зміщення рівноваги молочнокислої кислоти та пірувату праворуч. Швидкість використання НАД + використовується для вимірювання концентрації молочної кислоти. Приготування зразків, як правило, описано для карбонових кислот вище.
Перекис водню
Точкові тести на наявність перекису водню в молоці використовують або розчин пентоксиду ванадію в H2SO4 (рожевий або червоний колір) або KI/крохмаль (синій колір).
Кількісний аналіз проводиться за допомогою пероксидази та відповідного субстрату. Часто рекомендований о-діанізидин є канцерогенним, і такі субстрати, як гваякол або 2,2'-азинобіс (3-етилбензтіазолідин-6-сульфонова кислота), є кращими. Випробування на зразках молока проводять після осадження білка шляхом регулювання рН до 4,5 за допомогою HCl.
Нісін
Складність процедур виділення та хімічної кількісної оцінки нізину призвела до розробки мікробіологічних аналізів як звичайних процедур аналізу. Однією з міжнародних одиниць активності нізину є ступінь пригнічення випробовуваного мікроорганізму, спричиненого приблизно 25 нг чистого нізину. Підходящим тестовим мікроорганізмом є Streptococcus agalactiae. Конкретна процедура аналізу - це адаптація тесту відновлення метиленового синього; затримка знебарвлення барвника пропорційна концентрації нізину в 10-кратному діапазоні концентрацій. Новий метод аналізу включає імуноферментний аналіз, який набагато простіший, ніж мікробіологічний, і повинен стати популярним.
Ниркова токсикологія
КГ. Дікман, А.П.Гроллман, у Комплексній токсикології, 2010
7.18.4.2.4 Токсикокінетика
На відміну від мінливої присутності в сечі та крові, ореланін часто виявляють у зразках ниркової біопсії, де токсин може зберігатися у розчинній формі протягом 6 місяців після прийому (Andary et al. 1989; Franz et al. 1996; Holzl et al. 1997; Rohrmoser et al. 1997). Орелін, ди-редукційний метаболіт, також був знайдений у біопсіях нирок у випадках отруєння ореланіном, і, імовірно, походить або від самого гриба, або від поза- або внутрішньониркового метаболізму ореланіну. Продовження присутності ореланіну в корі нирок після гемодіалізу та його стійке перебування в цій тканині протягом декількох місяців за відсутності виявленого ореланіну в сечі чи крові свідчить про те, що токсин секвеструється в нирках у погано обмінній формі. Подібні спостереження були зроблені in vitro, де можна було відновити лише 25% ореланіну, доданого до гомогенату нирок, порівняно з повним відновленням при додаванні до сироватки (Holmdahl et al. 1987).
Спроби збільшити кліренс ореланіну за допомогою гемодіалізу, гемоперфузії або плазмафорезу, як окремо, так і в комбінації, були неефективними у запобіганні прогресуванню до хронічної ниркової недостатності (Busnach et al. 1983; Holmdahl and Blohme 1995; Holmdahl et al. 1984; Монтолі та ін., 1999). Враховуючи уповільнене прояви симптомів, пов’язаних з отруєнням ореланіном, ця недостатня ефективність, як правило, пов’язана із застосуванням цих методів лікування в кінці захворювання, як правило, через кілька днів після поста і в той час, коли гостра ниркова недостатність вже очевидна. Однак це поняття оскаржується висновками Монтолі та співавт. (1999), який повідомив, що плазмообмін розпочався вже через 44 год після постинга, не зумів запобігти розвитку гострої ниркової недостатності через 8 днів. Це свідчить про те, що ореланін швидко накопичується в нирках і що критичні клітинні події, що призводять до гострої ниркової недостатності через кілька днів, починаються незабаром після впливу.
Більшість поточної інформації щодо нефротоксичності ореланіну походить із повідомлень про випадки отруєнь людини та експериментів на тваринах. Через природу цих досліджень невідомо, чи кінцевим нефротоксином є сам ореланін або його метаболіт. Повідомляється, що попередня обробка фенобарбіталом збільшує травмування на моделі токсичності для гризунів, що свідчить про можливу участь біоактивації (Nieminen 1976). Подібним чином попередня біоактивація ореланіну мікросомами печінки була абсолютно необхідною для його інгібуючої дії на синтез білка в аналізі трансляції in vitro (Richard et al. 1991). Природа метаболіту (метаболітів) невідома. У випадках отруєння людиною ні фенотипи ацетилювання, ні гідроксилювання не корелюють із частотою ниркової недостатності (Bouget et al. 1990).
Сказ
Вакцини від нервових тканин (НТВ).
Ці гомогенати зараженого мозку тварин, хоча і поступово припиняються, все ще використовуються в деяких країнах Азії, Африки та Південної Америки. Вакцина проти мозку овець, вперше виготовлена в 1911 році, застосовується в Пакистані. Від 7 до 14 ін'єкцій щодня роблять підшкірно (SC) над передньою черевною стінкою; велика територія, здатна вмістити 2–5 мл дози вакцини. Вакцина проти мозку від грудного молока Фуензаліди застосовується в частинах Південної Америки та Африки. Ефективність НТВ змінюється, і трапляються невдачі у лікуванні. Їх не слід використовувати для попередньої експозиційної профілактики. Хоча поствакцинальний енцефаліт є серйозним ускладненням, лікування після експозиції є терміновим, тому, якщо це єдина доступна вакцина, лікування можна розпочати та замінити на вакцину з тканинних культур у будь-який час.
Нейроендокринні порушення
9.5.2 Процедура
У мікропланшеті для флуоресценції змішайте 40 мкл гомогенату, фракції мітохондрій (краще) або буфера гомогенізації (порожній), 10 мкл тираміну, 20 мкл розчину дихлорфлуоресцеїну діацетат/пероксидаза, 10 мкл амінотріазолу та 20 мкл буфера для аналізу. Амінотріазол запобігає гідролізу H2O2 каталазами. Інкубуйте від 30 до 60 хв при 30 ° C і знімайте показники флуоресцеїну при 485 нм збудження та 525 нм випромінювання через кожні 10 хв інтервалу. В окремих лунках готують заготовку лише з супернатантом, який може містити слідові кількості ендогенної пероксидази та H2O2 без додавання тираміну (замінено аналітичним буфером). Для калібрування в буфері для аналізу готують заготовку буфера та стандарт флуоресцеїну 0,1 мкМ.
Серотонін
Джулі Г. Хенслер, Джулі Г. Хенслер, з Основної нейрохімії (Восьме видання), 2012
Рецептор 5-ht1E
Рецептор 5-ht1E спочатку був ідентифікований у гомогенатах лобової кори людини в людях шляхом досліджень зв'язування радіолігандів із використанням [3 H] -5-HT у присутності 5-CT для блокування ділянок рецепторів 5-HT1A та 5-HT1D. Через відсутність специфічних радіолігандів для рецептора 5-ht1E загальний розподіл цього рецептора в мозку невідомий. МРНК рецептора 5-ht1E була виявлена в корі (особливо в енторіальній корі) та хвостатому путамені. Функція рецептора 5-ht1E в інтактній тканині невідома через відсутність селективних агоністів або антагоністів. У трансфікованих клітинах рецептор 5-ht1E пов'язаний з пригніченням активності аденилілциклази (Zgombick et al., 1992). Рецептор 5-ht1E виявляє вищий ступінь гомології з рецептором 5-HT1D (64%), ніж будь-які інші рецептори 5-HT1D. Незважаючи на те, що в мозку гризунів та людини нанесені іРНК і місця зв'язування рецепторів 5-ht1E, підтвердження справжньої фізіологічної ролі рецепторів 5-ht1E все ще відсутнє; отже, вони зберігають нижчий регістр (Hannon & Hoyer, 2008).
Авторегуляція росту та функцій щитовидної залози йодом
Йодоліпіди щитовидної залози
Йодосполуки, крім гормонів щитовидної залози, були виявлені в гомогенатах щитовидної залози, а йодоліпіди, як відомо, зустрічаються в дослідженнях з включення радіойоду з початку 1950-х (Taurog et al., 1957). Їх фізіологічна роль була невідомою, проте пропонувалось брати участь в авторегуляції щитовидної залози.
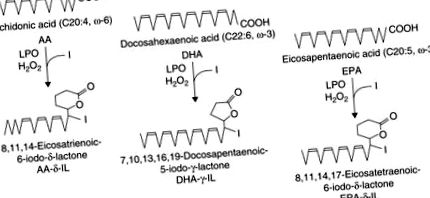
Конкретні сполуки були виявлені при використанні нових високочутливих методів, таких як газова хроматографія-мас-спектрометрія (GC-MS) та ядерний магнітний резонанс. Коли екзогенну жирну кислоту, таку як арахідонова кислота або докозагексанова кислота, доповнювали, утворення йодованих похідних можна було продемонструвати на зрізах щитовидної залози щурів (Boeynaems and Hubbard, 1980). Основним продуктом перетворення з арахідонової кислоти визначено δ-лактон 6-йодо-5-гідрокси-8,11,14-ейкозатрієнової кислоти (δ-йодолактон, формулу див. Рис. 25.2) in vitro у свинячих фолікулах щитовидної залози, а також in vivo в тканинах щитовидної залози людини, отриманих від пацієнтів, які отримували високі дози йоду перед операцією (Dugrillon et al., 1994).
Малюнок 25.2. Формули йодолактонів, отриманих з арахідонової кислоти, докозагексаєнової кислоти та ейкозапентаенової кислоти. Адаптовано за Gärtner et al., (1996).
За даними Перейри та співавт. (1990) 2-йодгексадеканал (2-IHDA) можна визначити як основний йодоліпід у щитовидній залозі коня. Ця основна сполука, мабуть, раніше розглядалася як полярний нефосфатидний ліпід дослідниками за допомогою тонкошарової хроматографії (Taurog et al., 1957). Ця сполука, ймовірно, утворюється внаслідок додавання йоду до групи вінілового ефіру плазмалогенів.
Методи гідрофобних мембранних фільтрів
Забезпечення дійсності MPN
Певні умови щодо розподілу мікроорганізмів у зразку гомогенату та на HGMF повинні бути дотримані, щоб визначення MPN застосовувалось із впевненістю. По-перше, мікроорганізми, призначені для перерахування, повинні розподілятися випадковим чином по всій порції зразка, яку потрібно відфільтрувати. По-друге, кожен окремий мікроорганізм у відфільтрованій порції зразка повинен мати рівні шанси потрапити на будь-який з окремих квадратів сітки. Нарешті, кожен квадрат повинен однаково підтримувати ріст цільових мікроорганізмів.
Перша та друга умови залежать від правильної підготовки та змішування зразка гомогенату, використання належного обладнання для фільтрації та техніки обробки, обережного розміщення фільтраційного апарату на його вакуумній колбі або колекторі та правильного розміщення мембранного фільтра на фільтрації одиниці, як показано на малюнках 2 та 3. Наприклад, якщо блок фільтрації не розташований вертикально, поверхня, на якій лежить HGMF, буде нахилена, що призведе до нерівних обсягів рідини, що фільтрується через кожен з окремих квадратів. Ця ситуація виводить з ладу умову однакової ймовірності розподілу мікроорганізмів серед усіх сіткових квадратів. Третя умова достовірності залежить від повного контакту між поверхнею живильного середовища та нижньою стороною HGMF та від однакової здатності всіх квадратів сітки передавати поживні речовини шляхом капілярної дії з культурального середовища на верхню поверхню квадрата. Наприклад, повітряний пухирець, що потрапив між поверхнею агару та нижньою стороною HGMF, перешкоджав би перенесенню поживних речовин на верхню поверхню фільтра, тим самим стримуючи ріст будь-яких мікроорганізмів-мішеней, які могли б бути на цих квадратах безпосередньо над повітряним бульбашкою.
Малюнок 2. Гідрофобний сітчастий мембранний фільтр розміщений на основі фільтраційного апарату.
Малюнок 3. Після розміщення HGMF фільтрувальну лійку повертають у вертикальне положення і затискають за допомогою щелепного затиску з нержавіючої сталі. Попередній фільтр з нержавіючої сталі (розмір пор 5 мкм), розташований на дні циліндричної частини воронки, відсіває частинки їжі в процесі фільтрації.
- Актори з довгих ніг - огляд тем ScienceDirect
- Метформін - огляд тем ScienceDirect
- Йод - огляд тем ScienceDirect
- Розплавлена ванна - огляд тем ScienceDirect
- Альбумін сироватки людини - огляд тем ScienceDirect