Голодування викликає підшкірно-вісцеральний перемикач жиру, опосередкований мікроРНК-149-3p, і придушення PRDM16
Предмети
Анотація
Ожиріння вісцеральних органів сильно пов'язане з ризиком метаболічних захворювань, тоді як підшкірне ожиріння порівняно доброякісне. Однак їх відносне фізіологічне значення в енергетичному гомеостазі залишається незрозумілим. Тут ми показуємо, що після 24-годинного голодування підшкірна жирова тканина мишей набуває ключових властивостей вісцерального жиру. Під час цієї швидко індукованої «вісцералізації», регуляція miR-149-3p безпосередньо націлена на PR-домен, що містить 16 (PRDM16), ключовий корегулюючий білок, необхідний для «побуріння» білого жиру. У культивованих пахових преадипоцитах надмірна експресія miR-149-3p сприяє вісцеральному типу перемикання під час диференціації клітин. Миші з дефіцитом miR-149-3p демонструють збільшення витрат енергії у всьому тілі з посиленим термогенезом пахового жиру. Однак вісцерально-подібний жировий фенотип спостерігається в пахових депо з надмірною експресією miR-149-3p. Ці результати вказують на те, що на додаток до здатності `` побуріння '' захищатись від переохолодження під час холодного впливу, підшкірно-жирове депо також здатне `` відбілювати '', щоб зберегти енергію під час голодування, імовірно, для підтримки енергетичного балансу, через miR-149-3p -посередне регулювання PRDM16.
Вступ
Нещодавно стало ясно, що підшкірна та вісцеральна ВАТ мають унікальні ознаки експресії генів 1. Більше того, підшкірний жир має значну термогенну здатність у відповідь на стимуляцію холодом у порівнянні з вісцеральними депо 14. Велике скупчення коричнеподібних клітин (їх називають клітинами бежевого/бритового кольору) під час впливу холоду є найбільш помітним у підшкірному паховому депо, тоді як вісцеральні адипоцити менш сприйнятливі до «побуріння» 1. Контролю розвитку бежевих клітин та розвитку транскрипції приділяється велика увага, головним чином через їх потенційну роль у захисті від ожиріння та супутніх розладів.
Як інтегратор енергетичного гомеостазу, багато основних фізіологічних функцій, що забезпечуються жировою тканиною, не враховуються через їх асоціацію з ожирінням. Холод і голод, ймовірно, були базовими станами у людини протягом значної частини еволюційного часу 15. Тому жироспалюючі коричневі/бежеві адипоцити спеціалізуються на підтримці температури тіла, виробляючи тепло в холодному середовищі, тоді як білі адипоцити, що зберігають ліпіди, пристосовані для подолання нестачі їжі 16. Індукована холодом поява коричнеподібних адипоцитів у підшкірній ВАТ свідчить про те, що певні жирові процеси надзвичайно пластичні у відповідь на зміни в екологічних ознаках 17,18. Голодування визначається як скоординований набір метаболічних змін, які економлять споживання вуглеводів і збільшують залежність від жиру як джерела енергії 19. Хоча кілька досліджень повідомляють, що мобілізація підшкірного депо виявляється меншою, ніж мобілізація вісцерального жиру під час голодування, важливою проблемою є розуміння молекулярних механізмів, за допомогою яких фізіологічні зміни регулюють ці різні жирові депо білого кольору 20 .
Домен PR, що містить 16 (PRDM16), є білком цинкового пальця, який функціонує як двонаправлений перемикач долі клітини між скелетними міобластами та сприяє диференціації BAT 2,3. Крім того, ектопічна експресія PRDM16 в адипоцитах сильно індукує термогенну програму в підшкірних депо, але не у вісцеральному жирі 5. Примітно, що рівні мРНК PRDM16 та білка залежать від депо, ймовірно, через різницю в стабільності білка PRDM16 у підшкірних та вісцеральних депо 1,20. Значна увага була зосереджена на ролі мікроРНК (miРНК) у функції адипоцитів. Зокрема, кілька мікроРНК мають переважний ефект на диференціацію та функцію коричневих та бежевих клітин, включаючи деякі, які націлені на PRDM16 (посилання 21, 22, 23, 24, 25).
Тут ми повідомляємо, що через 24 години позбавлення їжі підшкірна пахова пахова (ingWAT) набуває багатьох морфологічних та молекулярних характеристик вісцерального жиру для збереження енергії за допомогою опосередкованого miR-149-3p придушення PRDM16. Ці дані розкривають критичну роль підшкірної ВАТ у регулюванні енергетичного балансу за допомогою мікроРНК-опосередкованої регуляції PRDM16.
Результати
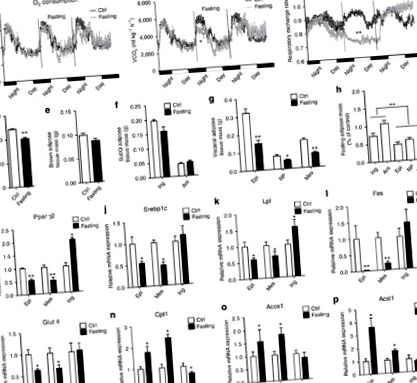
Голодування мобілізує більше вісцерального жиру, ніж підшкірне депо
Голодування веде вісцерально-подібні фенотипні перемикачі в ingWAT
Голодування пригнічує термогенез ingWAT шляхом інгібування PRDM16
miR-149-3p безпосередньо націлений на PRDM16 у підшкірному ingWAT
Інгібування miR-149-3p стимулює побуріння адіпоцитів Ing
miR-149-3p індукує візеральну диференціацію адипоцитів Ing
інгібування ingWAT miR-149-3p підвищує термогенез мишей
miR-149-3p викликає часткову вісцералізацію ingWAT у мишей
Обговорення
Після голодування протягом 24 год підшкірний ingWAT набуває багатьох морфологічних та молекулярних характеристик вісцерального жиру для збереження енергії завдяки опосередкованому miR-149-3p придушенню PRDM16. Навпаки, 24-годинне опромінення холодом знижувало miR-149-3p і призводило до підвищення рівня білка PRDM16 та адаптивного термогенезу в ingWAT. Ці висновки розкривають надзвичайну пластичність підшкірного ВАТ та його критичну роль у регулюванні енергетичного гомеостазу, особливо у відповідь на різні фізіологічні зміни. НЕТ, коричнева жирова тканина; SubQ, підшкірно; VISC, вісцеральний; ВАТ, біла жирова тканина.
miR-149-3p рідко досліджували. Наше дослідження продемонструвало, що miR-149-3p безпосередньо націлюється та негативно регулює Prdm16, а інгібування miR-149-3p сприяє диференціації попередників від підшкірних до бежевих клітин, що призводить до збільшення активності мітохондрій (рис. 4 та 5). Однак жодного з цих змін не спостерігалося в еридидимальних адипоцитах, виснажених miR-149-3p, що припускає, що miR-149-3p може виконувати специфічну для тканин роль. Це може бути тому, що вираз Prdm16 набагато нижчий у epiWAT, ніж у ingWAT 1. Крім того, маніпуляції з жировими запасами є очевидною терапевтичною метою, але порушення нормальної диференціації або розвитку ВАТ викликає ліподистрофію як у людей, так і у експериментальних тварин. Тут ми продемонстрували, що підшкірне гальмування шляхом активації анти-miR-149-3p розвитку бежевих клітин у ingWAT і згодом збільшує витрати енергії всього тіла, не викликаючи дисфункції в інших тканинах, що може бути потенційною стратегією протидії ожирінню (рис. 7 ).
Ми все ще перебуваємо в процесі розуміння подібності та відмінності між підшкірною та вісцеральною жировою тканиною. Тут ми показуємо, що на додаток до здатності `` побуріння '' захищатись від переохолодження під час дії холоду, підшкірна ВАТ набуває багато характеристик вісцеральної ВАТ для збереження енергії під час голодування за допомогою регулювання PRDM16, опосередкованого мікроРНК. Ці дані свідчать про важливу роль підшкірного в регулюванні енергетичного гомеостазу, особливо при зустрічі з різними фізіологічними змінами.
Методи
Реактиви та антитіла
FBS (cat # 16000-044), реагент TRIzol (cat # 15596-018), DMEM/F-12 (cat # 11330-032) і DMEM (cat # 11965-092) були придбані у Invitrogen (Carlsbad, CA, США). Флуоресцентний барвник SYBR-Green (cat # 4368577) та зонди miQNA TaqMan були придбані у Applied Biosystems (Foster City, CA, USA). Колагеназа типу II (cat # c6885), олігоміцин (cat # 75351), FCCP (cat # C2920), ротенон (cat # R8875), індометацин (cat # I-7378), дексаметазон (cat # D-1756), ізобутилметилксантин ( cat # I-5879), розиглітазон (cat # R-2408), T3 (cat # T-2877) та аналіз qPCR MystiCq microRNA (cat # MIRRM02) були придбані у Sigma (Deisenhogfen, Німеччина).
Для вестерн-блоттінгу антитіло проти UCP1 (cat # 14670) було придбано у Cell Signaling Technologies (Danvers, MA, USA), анти-PRDM16 антитіло (cat # AF6295) було придбано у R&D Systems (Tustin, CA, USA) 21, антитіло проти GAPDH (cat # sc-25778) було придбано у компанії Santa Cruz Biotechnology (Санта-Крус, Каліфорнія, США) 38. Для імуногістохімії антитіло проти UCP1 (cat # ab10983) було придбано у Abcam (Кембридж, Массачусетс, США) 39. Антитіла, що використовуються для проточної цитометрії, включаючи анти-CD45 (cat # 103121), CD11b (cat # 101207) та F4/80 (cat # 123115) 26, були придбані у BioLegend (Сан-Дієго, Каліфорнія, США).
Тварини
Усі експериментальні процедури на тваринах проводились відповідно до Керівництва Національного інституту охорони здоров’я щодо догляду та використання лабораторних тварин і були затверджені Комітетом з догляду за тваринами Нанкінського університету (Нанкін, Китай). Самці або самки мишей C57BL/6J (віком 6–8 тижнів) були отримані з Модельного дослідницького центру тварин Нанкінського університету та підтримувались на стандартній дієті (Research Diets cat # D10001, New Brunswick, NJ, USA) з 12- h світловий цикл. Для впливу холоду мишей розміщували індивідуально в інкубаторі при 4 ° C протягом 24 годин з достатньою кількістю їжі та води. Для голодування мишей утримували окремо при температурі 25 ° C лише з водою. Для голодування в поєднанні з холодним впливом мишей розміщували індивідуально в інкубаторі з температурою 4 ° C протягом 24 годин лише з водою. Експерименти проводились принаймні з трьома незалежними когортами.
Культура клітин
Стромально-судинні фракції пахових та епідидимальних жирових подушечок 7–8-тижневих самців мишей C57BL/6J готували та диференціювали протягом 6 днів, як зазначено на додатковій фіг. 5а. Первинні виділені преадипоцити піддавались індукції DMEM/F-12 (Invitrogen cat # 11330-032, Carlsbad, CA, USA), що містить індометацин (125 мкМ; Sigma cat # I-7378), дексаметазон (5 мкМ; Sigma cat # D-1756), інсулін (0,5 мкг мл -1), ізобутилметилксантин (0,5 мМ; Sigma cat # I-5879), розиглітазон (1 мкМ; Sigma cat # R-2408), T3 (1 нМ; Sigma cat # T- 2877) та 10% (об./Об.) FBS. З 4-го дня після індукції клітини витримували в середовищі, що містить інсулін (0,5 мкг мл -1), Т3 (1 нМ), розиглітазон (1 мкМ) і 10% (об/об) FBS, поки їх не збирали.
Експресія генів та вестерн-блот
Загальну РНК із культивованих клітин або тканин виділяли методом TRIzol (cat # 15596-018) (Invitrogen, Carlsbad, CA, USA). Для кількісного аналізу мРНК ПЛР (qPCR) мРНК реверсували транскрипцію за допомогою набору синтезу кДНК високої ємності ABI, а потім використовували для кількісних реакцій ПЛР із флуоресцентним барвником SYBR-Green (ABI cat # 4368577, Foster City, CA, USA). Відносну експресію мРНК визначали після нормалізації до Gapdh рівнях за допомогою ΔΔCt метод. Для вестерн-блот-аналізу клітини або тканини лізували в буфері RIPA (0,5% нонідет Р-40, 0,1% дезоксихолат натрію, 150 мМ NaCl і 50 мМ трис-Cl при рН 7,5). Лізати розчиняли за допомогою SDS-PAGE, переносили на мембрану PVDF (Millipore, Темекула, Каліфорнія, США) та зондували зазначеним антитілом. Антитіло проти UCP1 (1: 2000) (cat # 14670) було придбано у компанії Cell Signaling Technology (Danvers, MA, USA). Антитіло проти PRDM16 (1 мкг мл -1) (cat # AF6295) було придбано у R&D Systems (Tustin, CA, USA). Антитіло проти GAPDH (1: 1000) (cat # sc-25778) було придбане у компанії Santa Cruz Biotechnology (Санта-Крус, Каліфорнія, США) і служило контролем завантаження.
Аналіз експресії мікроРНК
Дихання
Дихання тканин оцінювали за допомогою електрода Кларка (Strathkelvin Instruments, Північний Ланаркшир, Шотландія). Свіжі тканини виділяли від мишей, яких не обробляли, голодували протягом 24 годин або піддавали впливу холоду протягом 24 годин. Тканини подрібнювали і поміщали в дихальне середовище (DPBS, 2 мм глюкози, 1 мм пірувату, 2% бичачого сироваткового альбуміну). Споживання O2 нормалізувалось до маси тканини. Для кожного жирового депо зчитували дані з використанням трьох окремих шматочків тканини еквівалентного розміру. Експерименти повторювались п’ять разів самостійно.
Проточна цитометрія
Підшкірну жирову клітковину вісцеральної та пахової оболонок епідидиму вирізали та перетравили за допомогою колагенази типу II (cat # c6885; Sigma, Німеччина). Суспензії клітин фільтрували через сито 40 мм і SVF збирали після центрифугування при 450 ° Сg протягом 10 хв. Для вимірювання розмірів клітин зазначених тканин адипоцитів кожен раз аналізували 2 × 10 4 зразки клітин. Для кількісної оцінки макрофагів клітини, забарвлені анти-CD45 (cat # 103121), CD11b (cat # 101207) та F4/80 (cat # 123115), були придбані у BioLegend (Сан-Дієго, Каліфорнія, США). Клітини аналізували за допомогою приладу LSRII (BD Bioscience, Нью-Джерсі, США) та програмного забезпечення FlowJo (Одноклітинний аналіз, версія 7.6.1, Ешленд, Орегон).
Фарбування IHC та H&E
Тканини фіксували у 10% формаліні, обробляли та вкладали у парафін. Для морфологічного спостереження готували декілька зрізів (товщиною 10 мкм) і фарбували гематоксиліном та еозином. Для імуноцитохімічного фарбування зрізи жирової тканини інкубували з антитілом проти UCP1 (cat # ab10983; 1: 1000; Abcam, Кембридж, Массачусетс, США) протягом ночі при 4 ° C. Сигнали були виявлені за допомогою біотинільованого козячого анти-кролячого вторинного антитіла (кішка # ba-1000; 1: 1000; Vector Laboratories, Бурлінгейм, Каліфорнія, США) з набором ABC (кішка # PK-4001; Vector Laboratories, Бурлінгейм, Каліфорнія, США) та субстрат DAB (cat # h-2200; Vector Laboratories, Burlingame, CA, USA).
Аденовірусна інфекція та трансфекція мікроРНК
Культури клітин SV при 70% злиття інкубували з аденовірусом (MOI 50), експресуючи sh-Prdm16 або скремблированную shRNA протягом ночі в середовищі росту. Потім середовище замінювали, і клітини підтримували в середовищі для росту протягом додаткових 36 год перед трансфекцією міРНК. Далі клітини SV трипсинізували, збирали центрифугуванням, двічі промивали PBS і ресуспендували в DMEM/F-12. Трансфекцію проводили у концентрації 20 нМ для мімічних або анти-miRs, використовуючи систему електропорації Gene Pulser Xcell (Bio-Rad, Hercules, CA, USA). Потім клітини висівали в 6-лункові планшети. Через 4 год комплекс трансфекції замінили свіжим адипогенним індукційним середовищем. Через 2 дні індукції середовище замінювали адипогенним середовищем підтримки і клітини збирали для аналізу РНК після додаткових 4 днів диференціації. Всі експерименти проводили в три повторних лунках для кожного стану і повторювали п'ять разів незалежно.
Аналіз на люциферазу
Плазміди, що несуть ген люциферази Реніла, зв’язаний з фрагментом Prdm16 3′UTR, що містить міркувані місця зв’язування miR-149-3p, були ко-трансфіковані в клітини HEK293T (Ембріональна нирка людини, придбана у колекції типів культури Китайської академії наук, Шанхай, Китай, автентифікований за допомогою профілювання STR, відсутність забруднення мікоплазмою) разом із контрольованою міРНК або імітацією miR-149-3p (Genepharm, Сучжоу, Китай). Мутант 3'-UTR Prdm16 був сконструйований шляхом мутагенезу miR-149-3p від AGGGAGG до GGAGGGA. Клітини HEK 293T культивували в DMEM (Gibco, Карлсбад, Каліфорнія, США), що містить 10% FBS, і висівали в 12-лункові планшети. Через 24 години після посіву 0,2 мкг репортерної плазміди люциферази світлячка, 0,2 мкг вектора експресії β-галактозидази (cat # 10586-014) (Ambion, Карлсбад, Каліфорнія, США) і рівні кількості (20 пмоль) miR-149 -3p імітаційну або скрембовану негативну контрольну РНК трансфікували в клітини за допомогою ліпофектаміну 2000 (кішка №11668-019) (Invitrogen, Карлсбад, Каліфорнія, США) відповідно до інструкцій виробника. В якості контролю трансфекції використовували вектор β-галактозидази. Через 24 години після трансфекції клітини аналізували за допомогою набору для аналізу люциферази (кішка № E4550) (Promega, Madison, WI, США). Всі експерименти проводили у трьох повторних лунках для кожного стану і повторювали п'ять разів незалежно.
Ін’єкція лентівірусів у пахову паливну тканину в природних умовах
Вимірювання метаболізму
Експерименти проводили з 7-тижневими самцями мишей C57BL6/J, якщо не вказано інше. Витрати енергії аналізували за допомогою комплексної системи домашньої клітки LabMaster (TSE System, Тюрінгія, Німеччина). Після базальних показників у клітках протягом 48 год інфікованим лентивірусом мишам вводили підшкірно NE (1 мг кг -1).
Споживання O2
Первинні клітини SV культивували в 96-лункових планшетах та диференціювали. Норми споживання кисню (OCR) вимірювали на базальному рівні глюкози (Seahorse Bioscience, North Billerica, MA, США), а також за допомогою препаратів, що порушують дихальний ланцюг: олігоміцин (інгібітор АТФ-синтази, 1 мкМ; Sigma-Aldrich cat # 75351) і FCCP (роз'єднувач, 1 мкМ) (Sigma-Aldrich, cat # C2920). Нарешті, дихання мітохондрій було заблоковано 1 мкМ ротенону (Sigma-Aldrich, cat # R8875). Залишковий OCR вважався немітохондріальним диханням. Всі експерименти проводили в три повторних лунках для кожного стану і повторювали п'ять разів незалежно.
Статистика
Дані аналізували за допомогою Prism 6 (програмне забезпечення GraphPad) з двостороннім студентським т-тести. Для результатів енерговитрат середнє значення розраховували для кожної миші для кожної із зазначених тривалостей, а значення використовували для обчислення статистичної значущості між групами. Розміри зразків або експериментів визначали емпірично для досягнення достатньої статистичної потужності. Для попереднього визначення обсягу експериментів не використовувались статистичні тести. P значення від 0,001 до 0,05, або
Додаткова інформація
Коди приєднання: Дані про експресію генів були депоновані в базі даних GEO під кодом приєднання GSE74753.
Як цитувати цю статтю: Дінг, Х., та ін. Голодування викликає підшкірно-вісцеральний перемикач жиру, опосередкований мікроРНК-149-3p, і придушення PRDM16. Нат. Комун. 7: 11533 doi: 10.1038/ncomms11533 (2016).
- Повернення метаболічного перемикача Мій досвід голодування протягом 5 днів
- Подумайте про пісний сталий вибір морепродуктів під час посту
- Емоційні переваги посту All AboutFasting
- Chaitra Navratri 2020 5 продуктів, які ви все ще можете їсти під час посту - Їжа NDTV
- Диференціальні адаптаційні реакції на 1 - або 2-денне голодування в різних тканинах миші виявили