Гломерулосклероз у дієтичній моделі ожиріння корелює з чутливістю до гальмування оксиду азоту, але не з гіперфільтрацією клубочків або гіпертрофією
Аарон Дж. Полічновський
1 Медичний факультет Університету Лойоли та лікарні у справах ветеранів Хайнса, Мейвуд, штат Іллінойс;
Гектор Лісея-Варгас
1 Медичний факультет Університету Лойоли та лікарні у справах ветеранів Хайнса, Мейвуд, штат Іллінойс;
Марія Пікен
3 Кафедра патології Університету Лойоли, Мейвуд, штат Іллінойс
Джанруй Лонг
2 Департамент електротехніки та обчислювальної техніки Іллінойського технологічного інституту, Чикаго, штат Іллінойс; і
Рашмі Бісла
1 Медичний факультет Університету Лойоли та лікарні у справах ветеранів Хайнса, Мейвуд, штат Іллінойс;
Джеффрі А. Вільямсон
2 Департамент електротехніки та обчислювальної техніки Іллінойського технологічного інституту, Чикаго, штат Іллінойс; і
Аніл К. Бідані
1 Медичний факультет Університету Лойоли та лікарня у справах ветеранів Хайнса, Мейвуд, штат Іллінойс;
Карен А. Гріффін
1 Медичний факультет Університету Лойоли та лікарні у справах ветеранів Хайнса, Мейвуд, штат Іллінойс;
Анотація
Модель ожиріння, спричиненого дієтою (DIO), часто використовується для вивчення патогенезу патологій, пов’язаних із ожирінням; однак, лише мінімальний гломерулосклероз (ГС) був зареєстрований через 3 місяці. Ми дослідили, чи розвивається ГС протягом більш тривалих періодів ДІО, і дослідили потенційну роль гемодинамічних механізмів у його патогенезі. Восьмитижневим самцям схильних до ожиріння (OP) та стійких до ожиріння (OR) щурів (річка Чарльз) вводили дієту з помірним вмістом жиру протягом 5 місяців. Оцінювали радіотелеметрично виміряний артеріальний тиск, протеїнурію та ГС. У щурів OP (n = 10) розвинулася поміркована гіпертонія (142 ± 3 проти 128 ± 2 мм рт.ст., P 3 × 10 −6) були подібними між щурами OP (n = 6) та OR (n = 9). Авторегуляція ниркового кровотоку зберігалася як у щурів OP (n = 7), так і OR (n = 7). На відміну від цього, введення N ω-нітро-l-аргініну метилового ефіру (l -NAME) у свідомих, хронічно інструментованих щурах OP (n = 11) призводило до підвищення артеріального тиску та ниркового судинного опору на 15% та 39%, і зниження ниркового кровотоку на 16%. Мінімальні ефекти l -NAME спостерігались у щурів OR (n = 9). Таким чином, DIO-асоційованому GS передує підвищена гемодинамічна чутливість до l -NAME, але не гіпертрофія нирок або гіперфільтрація.
МЕТОДИ
Тварини
Самців щурів OP та OR Sprague-Dawley купували у віці 6–8 тижнів у річки Чарльз, де їх утримували як окремі безпородні колонії та годували стандартною дієтою чау. Як було описано раніше (58), ці колонії щурів OP і OR були отримані з безпородних ліній щурів Спраг-Доулі з річки Чарльз шляхом селективного розведення на основі фенотипу збільшення ваги під час споживання високоенергетичної дієти. Усі щури отримували стандартну дієту чау (13% ккал від жиру, 1% NaCl, LabDiet 5001) після прибуття до лікарні ветеранів Hines. Після базових вимірювань дієту на час експериментів перевели на дієту MHF (32% ккал від жиру, 0,5% NaCl, дослідницькі дієти D12266B). Вода надавалась за бажанням. За всіма тваринами доглядали згідно з Національним керівництвом інститутів охорони здоров’я щодо догляду та використання лабораторних тварин, а всі протоколи були затверджені Комітетом з питань догляду та використання тварин у справах ветеранів Хайнса.
Експериментальні процедури
Чотири експерименти проводили в окремих групах щурів OP та OR. Експеримент 1 досліджував вплив тривалого (5 місяців) прийому дієти із СНВ на радіотелеметрично виміряний артеріальний тиск (АТ) та пошкодження нирок. Експерименти 2–4 проводили через 3 місяці прийому дієти із СНВ, до розвитку значної ниркової травми (26), щоб охарактеризувати потенційні попередні гемодинамічні механізми пов’язаної з ожирінням ниркової травми, що включала 1) швидкість клубочкової фільтрації (ШКФ) вимірювання у свідомих щурів та пов'язаного з ним морфометрично визначеного гломерулярного об'єму, 2) стійкий рівень ниркового кровотоку (RBF) авторегуляторної здатності після поступових змін АТ у анестезованих щурів; 3) взаємозв'язки BP-RBF та динамічна авторегуляція RBF до і під час введення метилового ефіру N ω-нітро-l-аргініну (l -NAME) у щурів, які перебувають у свідомості.
Експеримент 1: Реакції АТ та пошкодження нирок через 5 місяців годування MHF.
Експеримент 2: ШКФ навколишнього середовища та об’єм клубочків через 3 місяці подачі MHF.
Щури OP (n = 6) та OR (n = 9), які годували MHF дієтою протягом 3 місяців, знеболювали [пентобарбітал натрію (50 мг/кг в/в)] та осмотичний міні-насос (2ML1, Durect, Купертіно, Каліфорнія), що містив 10 мг/мл FITC-інуліну (Sigma-Aldrich, Сент-Луїс, Міссурі), розчиненого в 10 мМ PBS (рН 7,4), хірургічно імплантували (підшкірно) в підлопаткову область для визначення СКФ у свідомому стані, як і раніше описані іншими (15, 59). Через три дні після операції щурів поміщали в метаболічні клітини та отримували 24-годинний збір сечі та проби крові хворобової вени. Після 24-годинного збору сечі щурів знеболювали, а нирки проводили перфузію, фіксували для морфометричного аналізу.
Експеримент 3: стаціонарна стадійна ниркова ауторегуляція через 3 місяці годування MHF.
Щурів OP (n = 7) та OR (n = 7), яких годували дієтою MHF протягом 3 місяців, знеболювали [інактин (100 мг/кг в/в)] і хірургічно готували до оцінки здатності нирок до ауторегуляції, як описано раніше (11, 14, 36, 37, 39, 40). Індекси авторегуляції розраховували як дробову зміну RBF/дробову зміну АТ, як описано раніше (1, 11, 14, 36, 37, 39, 40).
Експеримент 4: навколишня гемодинаміка нирок та динамічна авторегуляція через 3 місяці годування MHF.
Щурів OP (n = 11) та OR (n = 9), які годували MHF дієтою протягом 3 місяців, знеболювали [пентобарбітал натрію (50 мг/кг в/в)] і хронічно інструментували радіотелеметричним передавачем АТ та зондом Transonic RBF зліва. ниркової артерії, як описано раніше (1, 11, 34, 35, 37). Після 7 днів відновлення після операції у свідомих щурів були зроблені початкові записи (2–4 год при 200 Гц) АТ і RBF. Після одного-трьох таких записів з інтервалом у 24 години l -NAME вводили у питну воду у дозі 100 мг/л (∼10 мг · кг −1 · день -1). Починаючи щонайменше через 48 год після ініціювання l -NAME, знову отримували записи BP та RBF. Через 4–6 днів та від двох до трьох таких записів дозу l -NAME було збільшено до 250 мг/л (∼25 мг · кг −1 · день -1), а записи BP та RBF отримано у подібному манера. Узагальнені результати за два-три окремі 2–4-годинні записи АТ та RBF у кожного щура до та під час введення обох доз введення l -NAME використовувались для характеристики зовнішньої гемодинаміки нирок та впливу l -NAME на такі вимірювання.
Гістологічні та морфометричні методи
Поперечні зрізи (3 мкм) вбудованих у парафін нирок фарбували гематоксиліном та еозином та періодичною кислотою-Шиффом для гістологічних аналізів. Пошкодження клубочків кількісно визначали сліпо, як загальний відсоток клубочків (принаймні 100 клубочків/секція), що виявляють ураження сегментарних або глобальних ГС, як описано раніше (9, 34–37, 39, 40). Площу поперечного перерізу клубочків вимірювали за допомогою програмного забезпечення для аналізу зображень Image-Pro Premier (версія 9.0, MediaCybernetics, Rockville, MD) з використанням об'єктива × 20 на мікроскопі DMCD Leica (Вецлар, Німеччина), обладнаному цифровою камерою DFC295 Leica в періодичних зрізах, зафарбованих Шиффом, як описано раніше (39–41). Площу поперечного перерізу клубочків у 100 клубочків/переріз нирки оцінювали дві особи, значення яких потім усереднювали. Середній клубочковий об’єм розраховували наступним чином: клубочковий об’єм = β/κ (AG 3/2), де AG - площа поперечного перерізу клубочків, β - коефіцієнт розподілу за розміром (дорівнює 1,38), κ - коефіцієнт форми для клубочків ідеалізовано як сфери (дорівнює 1,1) (62, 79).
Визначення СКФ
Стандарти FITC-інулін виготовляли з 10 мг/мл розчину FITC-інуліну шляхом послідовного розведення в 10 мМ буфері HEPES (рН 7,4, Sigma-Aldrich) у концентраціях від 0,15 до 20 мкг/мл. Зразки сечі попередньо розбавляли у буфері HEPES (1: 100), а зразки, плазму та попередньо розбавлену сечу далі розбавляли у буфері HEPES (1:39). Еталони, зразки та заготовки (буфер HEPES) проводили у трьох примірниках (200 мкл/лунку) на чорній 96-лунковій мікропланшеті (Costar). Для виправлення відмінностей у фоновій флуоресценції були включені плазма та сеча щурів, яким не вливали FITC-інулін. Флуоресценцію вимірювали за допомогою флуоресцентного зчитувача мікропланшетів (Synergy HT, BioTek, Winooski, VT) з фільтрами збудження та випромінювання 485 і 530 нм відповідно. ШКФ розраховували шляхом ділення швидкості виведення FITC-інуліну на його концентрацію в плазмі.
Динамічна автоматична регуляція RBF
Аналіз функції передачі між АТ (вхід) та RBF (вихід) проводили на початковому рівні та в обох дозах l -NAME, використовуючи раніше опубліковані методи (1, 11, 34, 35, 37, 66). Природні частоти міогенного та тубулогломерулярного механізмів зворотного зв'язку визначали на основі їх характерних піків резонансного сигнату при дробовому коефіцієнті посилення від 0,1 до 0,3 Гц та від 0,025 до 0,05 Гц, відповідно, шляхом перевірки окремих записів та усереднювали по кожному запису. Ми використовували кілька інших компонентів аналізу передавальної функції, які розглядались як потенційні показники сили ниркового міогенного механізму, включаючи 1) нахил зменшення величини допуску безпосередньо нижче міогенного піку, 2) пікову фазу, пов'язану з частотою пік резонансного сигналу міогенного механізму; 3) середня когерентність між 0,5 і 1 Гц (34, 66).
Статистичний аналіз
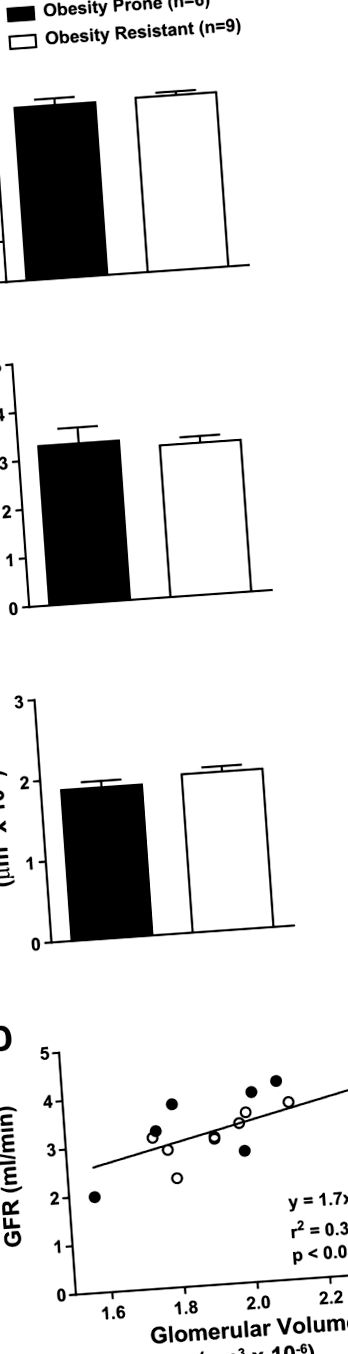
Значення - середні значення ± SE; n = 10 щурів, схильних до ожиріння (OP), та 8 щурів, стійких до ожиріння (OR). MHF, дієта з помірним вмістом жиру.
A – C: не спостерігалось суттєвих відмінностей у масі нирок (A), швидкості клубочкової фільтрації (GFR; B) або обсязі клубочків (C), що спостерігалися між щурами OP та OR після 3 місяців прийому помірно жирного (MHF) дієта. D: відзначена значна кореляція між ШКФ та обсягом клубочків у щурів OP та OR. Значення виражаються як середні значення ± SE.
Стаціонарна стадійна ниркова ауторегуляція у щурів, яка застосовувала дієту MHF протягом 3 місяців
Ці експерименти були проведені для вивчення здатності судин нирок буферувати великі стаціонарні зміни середнього артеріального тиску (МАР) під наркозом, що забезпечує найкращий показник сприйнятливості до індукованого гіпертонічним ураженням нирок (11). Через 3 місяці введення дієти з MHF маса тіла щурів OP (n = 7) була суттєво (P l -NAME у свідомих щурів, що вводили дієту MHF протягом 3 місяців
Таблиця 2.
Трансфертні функції, пов’язані з механізмами авторегуляції міогенного та тубулогломерулярного зворотного зв’язку до та після введення l -NAME у свідомих щурів OP та OR, які годували дієтою MHF протягом 3 місяців
| Щури OP | |||||||
| Базова лінія | 0,26 ± 0,01 | 2,0 ± 0,2 | 113 ± 11 | 0,5 ± 0,05 | 26 ± 3 | 0,04 ± 0,002 | 0,4 ± 0,1 |
| л -ІМЯ | 0,24 ± 0,01 | 2,4 ± 0,2 | 126 ± 6 | 0,5 ± 0,06 | 30 ± 3 | 0,04 ± 0,003 | 0,5 ± 0,1 |
| АБО щури | |||||||
| Базова лінія | 0,23 ± 0,01 | 2,3 ± 0,2 | 92 ± 6 | 0,5 ± 0,03 | 29 ± 2 | 0,04 ± 0,003 | 0,5 ± 0,1 |
| л -ІМЯ | 0,21 ± 0,01 | 3,6 ± 0,6 * † | 116 ± 13 | 0,4 ± 0,04 | 37 ± 5 | 0,03 ± 0,002 | 0,5 ± 0,1 |
| Ефекти ANOVA | |||||||
| Процідити | П л -ІМЕНА | Значення P ω-нітро-l-аргініну метиловий ефір (l -NAME) представляють середнє значення функції переносу при дозуванні 100 і 250 мг/л l -NAME, які не суттєво відрізнялися між собою у щурів OP та OR. NS, не значуще. |
ОБГОВОРЕННЯ
Підсумовуючи, нові аспекти цього дослідження включають 1) демонстрацію того, що значний ГС розвивається у штамі OP моделі DIO, 2) розвиток такого ГС, пов’язаного з ожирінням, відбувається за відсутності гіпертрофії та гіперфільтрації клубочків, і 3) підвищена чутливість до гемодинаміки до введення l -NAME передує розвитку GS, пов’язаного з ожирінням, у щурів OP. Ці дані мають дуже важливі наслідки щодо потенційної ролі зниженого NO у патогенезі GS у цій моделі DIO.
ГРАНТИ
Цю роботу підтримали Управління з досліджень і розробок Департаменту у справах ветеранів Премія за кар'єрний розвиток 1IK2BX001285 (AJ Polichnowski) та нагорода Merit Review Award (KA Griffin) та Національний інститут діабету та хвороб органів травлення та нирок DK-40426; (до А. К. Бідані) та DK-61653 (до К. А. Гріффіна).
РОЗКРИТТЯ
Ніяких конфліктів інтересів, фінансових чи інших, автор не заявляє.
- Наслідки моделі відображення ожиріння - 28 дюймів
- Наркотики блокують ожиріння клітинних рецепторів у мережах з моделями мишей
- Комбіноване лікування кверцетином та ресвератролом послаблює ожиріння, спричинене дієтами, що викликається високим вмістом жиру, та
- Корелати діабету та ожиріння, що зустрічаються одночасно серед учасників програми спільноти з психічного здоров'я
- Ранні стреси зменшують добровільні фізичні вправи та запобігання ожирінню, спричиненому дієтою