Гіпоталамічне ожиріння після краніофарингіоми: механізми, діагностика та лікування
Роберт Х. Лустіг
1 Кафедра педіатрії Каліфорнійського університету Сан-Франциско, Сан-Франциско, Каліфорнія, США
Анотація
Ожиріння є частим ускладненням після терапії краніофарингіомою, яке зустрічається приблизно у 75% тих, хто вижив. Його збільшення ваги на відміну від звичайного ожиріння, оскільки воно відбувається навіть при обмеженні калорій, а спроби зміни способу життя марні для запобігання або лікування ожиріння. Патогенез цього стану включає нездатність трансдурувати аферентні гормональні сигнали ожиріння, фактично імітуючи стан голодування ЦНС. Еферентна симпатична активність падає, що призводить до нездужання та зменшення енергетичних витрат, а вагінальна активність збільшується, що призводить до посилення секреції інсуліну та адипогенезу. Втручання у спосіб життя по суті марне при цьому синдромі, який називають «ожирінням гіпоталамуса». Фармакологічне лікування також ускладнене, воно складається з адренергіків, що імітують симпатичну активність, або придушення секреції інсуліну октреотидом або тим і іншим. Останнім часом також проводились спроби баріатричної хірургії (шлунковий шунтування Roux-en-Y, лапароскопічне перев'язування шлунка, ваготомія стовбура) з різними результатами. Для пом’якшення ожиріння та його негативних наслідків потрібно раннє та інтенсивне лікування.
Вступ
Що стосується пухлин головного мозку, то переважають три закони нью-йоркської нерухомості: “Місцезнаходження, місце розташування”. Краніофарингіоми є менш проблемними для того, чим вони є, ніж для того, де вони є. Гіпоталамус, як і для більшості гормональних систем, є анатомічним центром регуляції периферичної енергії. Коли гіпоталамус пошкоджений, виникає синдром незворотного набору ваги. Цей синдром, який називають «гіпоталамічним ожирінням», спочатку описаний Бабінським (1900) та Фроліхом (1901) на рубежі ХХ століття, підтверджує «органічність» ожиріння. Гіпоталамічне ожиріння може виникнути через саму пухлину, операцію з її винищення або через подальшу променеву терапію (Bray, 1984; Lustig, 2002). Хоча ця супутня захворюваність зазвичай проявляється у дітей через підвищену частоту пухлин, локалізованих у задній ямці (Stahnke et al., 1984; Sorva, 1988; Pinto et al., 2000), дорослі можуть також демонструвати подібний приріст ваги після завершення терапії (Daousi et al., 2005). Краніофарингіома становить половину зареєстрованих випадків, причому інші пухлини задньої ямки, кожна з яких сприяє меншій кількості. Однак синдром також повідомлявся про випадки псевдопухлини головного мозку, травми та інфільтративні або запальні захворювання гіпоталамуса (Bray, 1984).
Фактори захворюваності та ризику
Гіпоталамічне ожиріння може виникнути у відповідь на будь-яке пошкодження гіпоталамуса. Більшість досліджень було проведено серед населення, що пережило гострий лімфобластний лейкоз (ALL) (Lustig, 2002; Rogers et al., 2005), в яких ожиріння може бути обумовлене кількома факторами, включаючи глюкокортикоїди та зміни активності. Тим не менш, більшість цих досліджень зафіксували аномальне збільшення ваги на висоту довгий час після припинення терапії пухлини, і багато з цих досліджень демонструють, що випромінювання черепа є важливим фактором ризику (Lustig, 2002).
Зовсім недавно Мюллер та співавт. (2011) відповідно оцінили дані довгострокових результатів у базі даних Kraniopharyngeom у Німеччині. У цьому аналізі передопераційне залучення гіпоталамуса було специфічно причетне до розвитку післяопераційного ожиріння гіпоталамуса, що знову вказує на те, що розташування пухлини є найважливішим фактором ризику ожиріння.
Шлях негативного зворотного зв'язку енергетичного балансу
Дослідження на тваринах, які розробляють шлях негативного зворотного балансу енергії, передбачали патогенез та симптоматику ожиріння гіпоталамуса. Це найкраще можна описати як “стійкість до органічного лептину”; тобто недостатність сигналізації лептину в аферентній руці через пошкодження гіпоталамуса; призводить до вегетативної дисфункції еферентного плеча, сприяючи неадекватним витратам енергії та надмірному накопиченню енергії.
Аферентна рука
І навпаки, натщесерце шлункова секреція греліну підвищена (Kamegai et al., 2000; Tschöp et al., 2000), тоді як рівень лептину, інсуліну та PYY низький, що призводить до стимуляції орексигенного шляху (NPY/AgRP) та антагонізм анорексигенного шляху (α-MSH/CART). Внаслідок цього відсутність анорексигенного тиску на MC4R призводить до підвищеної поведінки під час годування та енергоефективності (зі зниженим окисленням жиру) з метою накопичення енергетичного субстрату у вигляді жиру. Це досягається за допомогою передачі сигналу в еферентному шляху, що складається з симпатичної нервової системи (SNS) і блукаючого (див. Нижче).
Еферентна рука
З PVN і LHA, еферентні проекції синапсують у локусі кишкової клітини (LC), який контролює SNS; і в дорсальному руховому ядрі блукаючого (ДМВ), який контролює блукаючий нерв, головний вихід парасимпатичної нервової системи.
В енергетичному стані підвищений рівень лептину та інсуліну змушує анорексигенну руку активувати СНС (Muntzel et al., 1994; Vollenweider et al., 1995; Rahmouni et al., 2003). Стимуляція β2-адренергічних рецепторів SNS (Blaak et al., 1993) збільшує експресію численних генів в скелетних м’язах (Viguerie et al., 2004), які сприяють біогенезу мітохондрій, глікогенолізу, термогенезу та посиленню руху (Boss et та ін., 1999; Лоуелл і Шпігельман, 2000), всі пов'язані зі збільшенням витрат енергії (Collins et al., 1996). SNS також активує α2a- і α2c-адренорецептори на β-клітині, які стимулюють Gi та інгібують аденилциклазу, знижують цАМФ і підтримують калієві канали у відкритій конфігурації з негативним потенціалом мембрани спокою (Sharp, 1996), щоб зменшити секрецію інсуліну підшлункової залози і, таким чином, зменшити відкладення енергії в жировій тканині. Нарешті, активація SNS стимулює β3-адренергічний рецептор на адипоциті для сприяння ліполізу (Susulic et al., 1995). Ці координатні симпатичні події служать для зменшення експресії та секреції лептину в жировій тканині; таким чином, це утворює негативну петлю зворотного зв'язку з аферентною системою (рис.
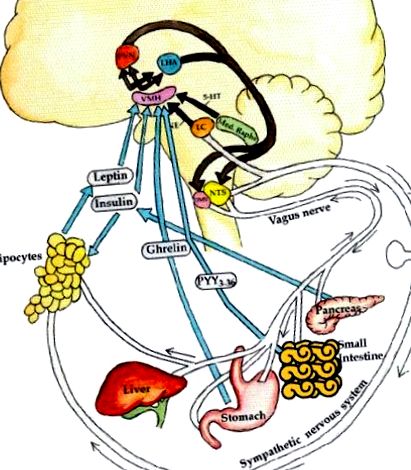
Нейроендокринна регуляція енергетичного балансу. Аферентна система: нервові (наприклад, блукаюча) та гормональні (грелін, інсулін, лептин) сигнали генеруються з печінки, кишечника, підшлункової залози та жирової тканини. Крім того, розробляються норадреналін з локусу кірулею та серотонін (5-НТ) із серединного рафе. Ці сигнали ситості проти голоду та худорлявості проти вгодованості інтерпретуються у вентромедіальному гіпоталамусі (VMH). Потім ці сигнали інтегруються в паравентрикулярне ядро (PVN) та бічний гіпоталамус (LHA). Еферентна система: еферентні сигнали з цих областей, у свою чергу, стимулюють симпатичну нервову систему (СНС) витрачати енергію, активуючи β3-адренергічні рецептори та роз’єднуючи білки в адипоциті, виділяючи енергію у вигляді ліполізу, тепла або фізичної активності. І навпаки, парасимпатична нервова система (еферентна блукаюча) збільшує секрецію інсуліну, внаслідок чого відбувається адипогенез та накопичення енергії, а також підвищує чутливість до інсуліну через прямий вплив на жирову тканину (Lustig, 2006). Від видавничої групи Nature, з дозволу.
І навпаки, у стані голодування лептин та інсулін є низькими, що призводить до зниження тонусу СНС, зниження термогенезу скелетних м’язів та зменшення ліполізу жирової тканини. Крім того, LHA і PVN направляють еферентні проекції, розташовані в медіальному поздовжньому фасцикулюсі, до нерва DMV (Powley and Laughton, 1981). Уповільнюючи серцевий ритм, блукаючий зменшує споживання кисню в міокарді. Впливаючи на шлунково-кишковий тракт, блукаючий стимулює перистальтику та поглинання енергетичного субстрату. Впливаючи на адипоцит, блукаючий стимулює активність ліпопротеїнової ліпази для збільшення кліренсу енергетичного субстрату в жировій тканині (Boden and Hoeldtke, 2003). Нарешті, завдяки впливу на β-клітину (D'Alessio et al., 2001), блукаючий підсилює гіперсекрецію інсуліну після їжі у відповідь на прийом їжі, що сприяє відкладанню енергії в адипоциті (Rohner-Jeanrenaud and Jeanrenaud, 1985; Marin et al., 1988; Peles et al., 1995; Lustig, 2003). Надмірно активна блукаюча нейротрансмісія підвищує секрецію інсуліну за допомогою трьох різних, але перекриваючих механізмів (Gilon and Henquin, 2001; Рисунок Рисунок 2 2):
1. Блукаюче випалювання збільшує доступність ацетилхоліну та зв'язування з мускариновим рецептором М3 на β-клітині, яка пов'язана з натрієвим каналом у мембрані β-клітин підшлункової залози (Miura et al., 1996). Коли глюкоза потрапляє в β-клітину після прийому їжі, фермент глюкокіназа фосфорилює глюкозу, утворюючи глюкозо-6-фосфат. Це збільшує генерацію внутрішньоклітинного АТФ, що індукує закриття АТФ-залежного калієвого каналу β-клітини. Після закриття каналу β-клітина переживає деполяризацію β-клітин, що залежить від концентрації АТФ (Nishi et al., 1987; Zawalich et al., 1989), і відкриття окремого кальцієвого каналу, що залежить від напруги, всередині мембрани. Внутрішньоклітинний приплив кальцію різко збільшується, що призводить до швидкого везикулярного екзоцитозу інсуліну. Одночасне розкриття натрієвого каналу вагусно виведеним ацетилхоліном посилює деполяризацію β-клітин, що збільшує внутрішньоклітинний приплив кальцію, і призводить до гіперсекреції інсуліну (Berthoud and Jeanrenaud, 1979; Komeda et al., 1980; Rohner-Jeanrenaud and Jeanrenaud, 1980 ).
2. Вагально опосередкований ацетилхолін збільшує фосфоліпази А2, С і D всередині β-клітини, яка гідролізує внутрішньоклітинний фосфатидилінозитол до діацилгліцерину (DAG) та інозитолтрифосфату (IP3; Gilon and Henquin, 2001). DAG є потужним стимулятором протеїнкінази С (PKC; Tian et al., 1996), який фосфорилює міристоїльований багатий аланіном субстрат протеїнкінази С (MARCKS), який потім зв’язує актин і кальцій-кальмодулін та індукує везикулярний екзоцитоз інсуліну (Arbuzova et співавт., 1998). IP3 посилює вивільнення кальцію в β-клітинах з внутрішньоклітинних запасів, що також сприяє секреції інсуліну (Blondel et al., 1994).
3. Блукач також стимулює вивільнення глюкагоноподібного пептиду-1 (GLP-1) з кишкових L-клітин, який циркулює та зв’язується з β-клітинним рецептором GLP-1. Активація цього рецептора індукує чутливу до кальцію-кальмодуліну аденил-циклазу з утворенням цАМФ, який активує протеїнкіназу А (РКА), стимулюючи фосфорилювання везикулярних білків, із результатом екзоцитозу інсуліну (Kiefer and Habener, 1999).
Таким чином, аферентна система захоплюється еферентною системою за допомогою складного сервомеханізму для координації центральних та периферійних сигналів або для апетиту та накопичення енергії, або для насичення та витрат енергії.
Патогенез гіпоталамічного ожиріння
Моделі пошкодження гіпоталамуса у щурів, спричинені двосторонніми електролітичними ураженнями або деафферентацією ВМГ, призводять до важкого набору ваги (Berthoud and Jeanrenaud, 1979; Rohner-Jeanrenaud and Jeanrenaud, 1980; Bray et al., 1981; Jeanrenaud, 1985; Satoh та ін., 1997), навіть при обмеженні їжі (Bray and Nishizawa, 1978). Подібним чином у дітей із ожирінням гіпоталамусу спостерігається збільшення ваги навіть у відповідь на примусове обмеження калорій (Bray and Gallagher, 1975). Це здається парадоксальним, оскільки можна було б очікувати, що якби гіперфагія була причиною ожиріння, то обмеження калорій було б ефективним для запобігання подальшому набору ваги. Насправді, аналіз споживання енергії у дітей із ожирінням гіпоталамусу не демонструє різниці в порівнянні з контрольними пацієнтами з простим ожирінням (Harz et al., 2003). Натомість як споживання енергії у спокої (Shaikh et al., 2008), так і добровільне витрачання енергії (Harz et al., 2003) серйозно порушено у цих пацієнтів. Дійсно, найвизначнішою та найнебезпечнішою скаргою у пацієнтів з ожирінням гіпоталамуса є стійка втома, відсутність енергії та відсутність фізичної активності. Це загальне нездужання не зумовлене гіпопітуїтаризмом, оскільки воно зберігається навіть після повної гормональної заміни.
Зменшення витрат енергії опосередковується придушенням активності SNS за рахунок пошкодження гіпоталамуса. Останні звіти демонструють погіршення здатності таких пацієнтів реагувати на відповідь адреналіну на індуковану інсуліном гіпоглікемію (Schofl et al., 2002; Coutant et al., 2003), і підтверджують знижену 24-годинну екскрецію адреналіну (Coutant et al., 2003 ), поряд зі зниженим вмістом гомованілінової кислоти в сечі та ванілілманделінової кислоти (Roth et al., 2007); все вказує на зниження симпатичного тонусу. Існує думка, що це нездужання і зниження симпатичного тонусу можуть спричинити зниження швидкості ліполізу через β3-адренергічний рецептор адипоцитів (al-Adsani et al., 1997), що призводить до зменшення спокою та добровільних витрат енергії.
На додаток до "органічної резистентності до лептину", ці пацієнти також можуть виявляти "органічну резистентність до греліну", оскільки придушення греліну пригнічення голоду може бути послаблене у дітей із ожирінням з гіпоталамусом (O'Gorman et al., 2911). Це може збільшити загальне споживання їжі; хоча зміни у загальному споживанні їжі у цих пацієнтів не відрізняються від інших здорових людей із ожирінням (Harz et al., 2003).
Діагностика
Ретроспективний аналіз записів росту дітей з краніофарингіомою (Muller et al., 2004) вказує на те, що збільшення ваги та збільшення ІМТ очевидне ще до діагностики пухлини. Однак після операції або променевої терапії збільшення ваги відбувається негайно, швидко і сильно перебільшується. Докази аберрантного відкладення енергії очевидні протягом першого місяця. Лікарі іноді плутають цей приріст ваги з глюкокортикоїдним ефектом і зменшують підтримуючу дозу гідрокортизону, яка не впливає на ожиріння, і робить пацієнта ще більшою втомою та нездужанням.
Точковий графік секреції інсуліну (виправлена відповідь інсуліну або CIRgp) порівняно з чутливістю (композитний індекс чутливості до інсуліну, або CISI), побудований логарифмічно у 113 дітей із ожирінням, які не страждають на діабет. Відзначено негативну лінійну кореляцію (r = −0,54, р 2/рік до 4,5 кг/м 2/день), але швидкість приросту все ще досить неприпустимо покладатися (Рахшані та ін., 2010).
Фармакотерапія
Оскільки гіпоталамус не піддається терапії, а аберантна передача аферентного гормонального сигналу не може бути виправлена, натомість фармакотерапія повинна вирішити зміни в еферентних шляхах. Кілька спроб використання інгібіторів зворотного захоплення серотоніну або норадреналіну (наприклад, фен-фен, флуоксетин, сибутрамін) зустрічалися лише з цілющою ефективністю (Molloy et al., 1998). В одному дослідженні оцінювали ефекти сибутраміну 10–15 мг перорально на добу з невеликим, але відтворюваним ефектом при ІМТ (Danielsson et al., 2007); однак сибутрамін вилучено з ринку. Ці ліки працюють централізовано, щоб зменшити споживання їжі, але не працюють периферично, щоб стимулювати скелетні м’язи для збільшення енергетичних витрат, і тому мають обмежену цінність. Мейсон та ін. (2002) використовували декстроамфетамін у дозі 5 мг перорально, який діє як центрально, так і периферично, і досяг стабільності ваги протягом інтервалу 6 місяців. Ми також спостерігали покращення ефекту та настороженості, що є основною перевагою декстроамфетаміну.
Намагаючись зменшити гіперінсулінемію, Гамільтон намагався лікувати пацієнтів комбінацією діазоксиду та метформіну (Hamilton et al., 2011). Збільшення ваги за 6 місяців було зменшено порівняно з попереднім лікуванням; однак побічні ефекти були значними, включаючи набряки, і були деякі припинення лікування.
Намагаючись зменшити гіперінсулінемію і одночасно посилити дію інсуліну, ми дослідили вплив аналога соматостатину октреотиду (агоніста рецептора соматостатину-5 на β-клітину, який інгібує напружений кальцієвий канал; рис. 2). 2). Пілотне відкрите випробування октреотиду 15 мкг/кг/добу підшкірно протягом 6 місяців на восьми суб'єктах (Lustig et al., 1999) продемонструвало втрату ІМТ, пропорційну ступеню придушення інсуліну, разом із зменшенням споживання калорій та суб'єктивною поліпшення спонтанної фізичної активності та якості життя. Подвійне сліпе, плацебо-контрольоване дослідження на 20 суб'єктах (Lustig et al., 2003b) призвело до пригнічення інсуліну та стабілізації ІМТ, зниження лептину, зменшення споживання калорій, збільшення спонтанної фізичної активності та поліпшення якості життя, пропорційного до ступінь придушення інсуліну. Ретроспективний аналіз продемонстрував, що октреотид був найефективнішим у тих пацієнтів, у яких спостерігалась як гіперсекреція інсуліну, так і тривала чутливість до інсуліну (Preeyasombat et al., 2005).
Хірургія
Тяжкість та захворюваність ожирінням у цих пацієнтів та відносна відсутність альтернатив призвели до спроб баріатричної хірургії. Інге та ін. (2007) повідомили про втрату ваги на 25 кг після шлункового шунтування Roux-en-Y у одного суб'єкта, але вага якого стабілізувалась на неприйнятному рівні. Нещодавно Мюллер та співавт. (2007) в абстрактній формі повідомив про свій досвід із чотирма випробуваними, яким проводили лапароскопічну регульовану перев'язку шлунка із зменшенням споживання їжі та повільним зниженням ІМТ. Нарешті, ваготомія може бути ефективною при цьому синдромі (Smith et al., 1983), зменшуючи еферентний вихід як бета-клітин, так і адипоцитів. Нещодавно ми провели лапароскопічну ваготомію тулуба у чотирьох пацієнтів із ожирінням з гіпоталамусом, причому ранні результати підтверджують цю процедуру і мають порівняно мало ускладнень або побічних ефектів (Lustig et al., 2009).
Резюме
Гіпоталамус інтерпретує аферентні сигнали для енергетичного балансу і перетворює їх на вегетативні еферентні сигнали, щоб або витрачати, або зберігати енергію. Коли ця система негативного зворотного зв’язку руйнується, як після терапії краніофарингіомою, настає явище ожиріння гіпоталамуса. Хоча це розлад є дефектом аферентного шляху, лікування зосереджується на еферентному шляху, оскільки воно модулюється за допомогою ліків та хірургічних методів, які доступні в даний час. Лікарі повинні пояснити ризики цього розладу пацієнтам до початку пухлинної терапії, і вони повинні бути готовими діяти швидко і рішуче, як тільки починається важке збільшення ваги, щоб забезпечити інтенсивне лікування, щоб ожиріння не погіршувалось.
Заява про конфлікт інтересів
Автор заявляє, що дослідження проводилось за відсутності будь-яких комерційних або фінансових відносин, які можна трактувати як потенційний конфлікт інтересів.
- Хвороби нирок та ожиріння епідеміологія, механізми та лікування Nature Reviews Нефрологія
- Діагностика ожиріння у пацієнтів, використання хірургічного лікування та супутні витрати за типом платника в
- Гіпоталамічне ожиріння після операції на краніофарингіомі; Лікування глюкагоном тривалої дії
- Гіперальдостеронізм (Conn; s) Симптоми, діагностика та лікування Інститут раку Джона Уейна
- Гіпоталамічне запалення та ожиріння - механістичний огляд SpringerLink