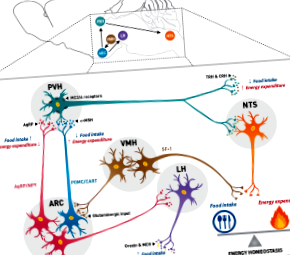
Гіпоталамічне запалення та ожиріння: механістичний огляд
Анотація
Ожиріння є одним із поширених у всьому світі захворювань, спричинених дисбалансом між споживанням їжі та витратами енергії. Протягом 100 років досліджень було продемонстровано, що гіпоталамус є критично важливою областю мозку, що регулює енергетичний гомеостаз, і факти свідчать про участь ненейрональних популяцій, таких як астроцити та мікроглія, в регуляції енергетичного гомеостазу. Нещодавно було виявлено, що дієта, багата жирами, викликає запалення гіпоталамусу, що дерегулює енергетичний гомеостаз, що призводить до інсулінорезистентності, непереносимості глюкози та ожиріння. Запропоновано декілька основних механізмів, проте вагомі докази потребують подальшого з'ясування. У цьому огляді розглядаються сучасні запропоновані механізми, за допомогою яких багата жирами дієта викликає запалення гіпоталамуса та ожиріння.
Це попередній перегляд вмісту передплати, увійдіть, щоб перевірити доступ.
Параметри доступу
Придбайте одну статтю
Миттєвий доступ до повної статті PDF.
Розрахунок податку буде завершено під час оформлення замовлення.
Список літератури
Agrawal NK, Kant S (2014) Орієнтація на запалення при діабеті: новіші терапевтичні варіанти. World J Diab 5: 697–710
Anand BK, Brobeck JR (1951) Локалізація «центру живлення» в гіпоталамусі щура. Proc Soc Exp Biol Med 77: 323–324
Аповіан СМ (2016) Ожиріння: визначення, супутні захворювання, причини та тягар. Am J Manag Care 22: s176–185
Araujo EP, Torsoni MA, Velloso LA (2010) Гіпоталамічне запалення та ожиріння. Гормонна лімбічна система 82: 129–143
Benoit SC, Kemp CJ, Elias CF, Abplanalp W, Herman JP, Migrenne S, Lefevre AL, Cruciani-Guglielmacci C, Magnan C, Yu F, Niswender K, Irani BG, Holland WL, Clegg DJ (2009) Пальмітинова кислота опосередковує гіпоталамус резистентність до інсуліну шляхом зміни субклітинної локалізації PKC-тета у гризунів. J Clin Invest 119: 2577–2589
Borg ML, Omran SF, Weir J, Meikle PJ, Watt MJ (2012) Споживання дієти з високим вмістом жиру, але не регулярне тренування на витривалість, регулює накопичення гіпоталамусних ліпідів у мишей. J Physiol 590: 4377–4389
Cesar HC, Pisani LP (2017) Запалення гіпоталамусу, опосередковане жирними кислотами, та епігенетичне програмування. J Nutr Biochem 42: 1–6
Chavez JA, Summers SA (2012) Церамід-орієнтоване уявлення про резистентність до інсуліну. Cell Metab 15: 585–594
Choi YH, Fujikawa T, Lee J, Reuter A, Kim KW (2013) Перегляд вентрального медіального ядра гіпоталамуса: ролі нейронів SF-1 в енергетичному гомеостазі. Фронт Невроші 7:71
Cintra DE, Ropelle ER, Moraes JC, Pauli JR, Morari J, Souza CT, Grimaldi R, Stahl M, Carvalheira JB, Saad MJ, Velloso LA (2012) Ненасичені жирні кислоти повертають викликане дієтою запалення гіпоталамусу при ожирінні. PLOS ONE 7: e30571
Конус Р.Д. (2005) Анатомія та регуляція центральної системи меланокортину. Nat Neurosci 8: 571–578
Dalvi PS, Chalmers JA, Luo V, Han DY, Wellhauser L, Liu Y, Tran DQ, Castel J, Luquet S, Wheeler MB, Belsham DD (2017) Високий вміст жиру викликає гостре та хронічне запалення в гіпоталамусі: ефект жирова дієта, пальмітат та TNF-альфа на нейронах, що регулюють апетит, NPY. Int J Obes (Лонд) 41: 149–158
Date Y, Ueta Y, Yamashita H, Yamaguchi H, Matsukura S, Kangawa K, Sakurai T, Yanagisawa M, Nakazato M (1999) Орексини, орексигенні гіпоталамічні пептиди, взаємодіють з вегетативною, нейроендокринною та нейрорегуляторною системами. Proc Natl Acad Sci USA 96: 748–753
De Souza CT, Araujo EP, Bordin S, Ashimine R, Zollner RL, Boschero AC, Saad MJ, Velloso LA (2005) Споживання дієти, багатої жирами, активує прозапальну реакцію та індукує резистентність до інсуліну в гіпоталамусі. Ендокринологія 146: 4192–4199
Douglass JD, MD Dorfman, Fasnacht R, Shaffer LD, Thaler JP (2017) Сигналізація про астроцити IKK beta/NF-kappa B необхідна при ожирінні, спричиненому дієтою, та запаленні гіпоталамуса. Mol Metab 6: 366–373
Dragano NRV, Solon C, Ramalho AF, De Moura RF, Razolli DS, Christiansen E, Azevedo C, Ulven T, Velloso LA (2017) Поліненасичені рецептори жирних кислот, GPR40 і GPR120, експресуються в гіпоталамусі та контролюють енергетичний гомеостаз та запалення . J Neuroinflamm 14:91
Fekete C, Legradi G, Mihaly E, Huang QH, Tatro JB, Rand WM, Emerson CH, Lechan RM (2000) альфа-меланоцитостимулюючий гормон міститься в нервових закінченнях, що іннервують синтезуючі тиреотропін-вивільняючий гормон синтезуючі нейрони в гіпоталамічному паравентрикулярному ядрі та запобігає пригніченню експресії гена протіротропін-рилізинг-гормону, спричиненого голодуванням. J Neurosci 20: 1550–1558
Fleming JW, Mcclendon KS, Riche DM (2013) Нові засоби для ожиріння: лоркасерин та фентермін/топірамат. Енн Фармакотер 47: 1007–1016
Fritsche KL (2015) Наука про жирні кислоти та запалення. Adv Nutr 6: 293–301 с
Гао Ю, Білохубі М, Флемінг Т, Грабнер Г.Ф., Фоппен Е, Бернхард З, Гусман-Руїз М, Лайріц С, Легутко В, Зінсер Е, Гарсія-Касерес С, Буййс Р.М., Вудс СК, Калсбік А, Сілі Р.Ж., Наврот PP, Bidlingmaier M, Tschöp MH, Yi CX (2017) Дієтичні цукри, а не ліпіди, викликають запалення гіпоталамуса. Mol Metab 6: 897–908
Gupta S, Knight AG, Gupta S, Keller JN, Bruce-Keller AJ (2012) Насичені довголанцюгові жирні кислоти активують запальний сигнал в астроцитах. J Neurochem 120: 1060–1071
Хенсон П. М. (2005) Зменшення запалення. Nat Immunol 6: 1179–1181
Hill JW (2012) PVN шляхи управління енергетичним гомеостазом. Індійський J Endocrinol Metab 16: S627–636
Hill JO, Wyatt HR, Peters JC (2012) Енергетичний баланс та ожиріння. Тираж 126: 126–132
Holland WL, Brozinick JT, Wang LP, Hawkins ED, Sargent KM, Liu Y, Narra K, Hoehn KL, Knotts TA, Siesky A, Nelson DH, Karathanasis SK, Fontenot GK, Birnbaum MJ, Summers SA (2007) Інгібування кераміду синтез покращує резистентність до інсуліну до глюкокортикоїдів, насичених жирів та ожиріння. Cell Metab 5: 167–179
Горват Т.Л. (2005) Важкість ожиріння: м'який дротовий гіпоталамус. Nat Neurosci 8: 561–565
Hotamisligil GS (2006) Запалення та порушення обміну речовин. Nature 444: 860–867
Hotamisligil GS (2010) Стрес ендоплазматичної сітки та запальна основа метаболічного захворювання. Клітина 140: 900–917
Hotamisligil GS (2017) Запалення, метазапалення та імунометаболічні порушення. Природа 542: 177–185
Huang S, Rutkowsky JM, Snodgrass RG, Ono-Moore KD, Schneider DA, Newman JW, Adams SH, Hwang DH (2012) Насичені жирні кислоти активують TLR-опосередковані прозапальні сигнальні шляхи. J Lipid Res 53: 2002–2013
Kahn BB, Flier JS (2000) Ожиріння та резистентність до інсуліну. J Clin Invest 106: 473–481
Kim MS, Pak YK, Jang PG, Namkoong C, Choi YS, Won JC, Kim KS, Kim SW, Kim HS, Park JY, Kim YB, Lee KU (2006) Роль гіпоталамусу Foxo1 у регулюванні споживання їжі та енергії гомеостаз. Nat Neurosci 9: 901–906
Kim KW, Zhao L, Donato J Jr, Kohno D, Xu Y, Elias CF, Lee C, Parker KL, Elmquist JK (2011). Стероїдогенний фактор 1 керує програмами, що регулюють викликаний дієтою термогенез та дію лептину в вентральному медіальному ядрі гіпоталамуса. Proc Natl Acad Sci USA 108: 10673–10678
Kim KW, Donato J Jr, Berglund ED, Choi YH, Kohno D, Elias CF, Depinho RA, Elmquist JK (2012) FOXO1 у вентромедіальному гіпоталамусі регулює енергетичний баланс. J Clin Invest 122: 2578–2589
Kinyua AW, Yang DJ, Chang I, Kim KW (2016) Стероїдогенний фактор 1 у вентромедіальному ядрі гіпоталамуса регулює вікове залежність ожиріння. PLoS ONE 11: e0162352
Kitamura T, Feng Y, Kitamura YI, Chua SC Jr, Xu AW, Barsh GS, Rossetti L, Accili D (2006) Forkhead protein FoxO1 опосередковує Agrp-залежні ефекти лептину на споживання їжі. Nat Med 12: 534–540
Klockener T, Hess S, Belgardt BF, Paeger L, Verhagen LA, Husch A, Sohn JW, Hampel B, Dhillon H, Zigman JM, Lowell BB, Williams KW, Elmquist JK, Horvath TL, Kloppenburg P, Bruning JC (2011) Годування з високим вмістом жиру сприяє ожирінню через інсуліновий рецептор/PI3 K-залежне інгібування нейронів SF-1 VMH. Nat Neurosci 14: 911–918
Konner AC, Bruning JC (2012) Селективна резистентність до інсуліну та лептину при порушеннях обміну речовин. Cell Metab 16: 144–152
Копельман П.Г. (2000) Ожиріння як медична проблема. Природа 404: 635
Кройцер С, Петерс С, Шульте Д.М., Фангманн Д, Тюрк К, Вольф С, Ван Еймерен Т, Аренс М, Бекман Дж, Шафмайер С, Беккер Т, Кербі Т, Рор А, Рідель С, Хайнсен Ф.А., Дегенхардт Ф, Франк A, Rosenstiel P, Zubek N, Henning C, Freitag-Wolf S, Dempfle A, Psilopanagioti A, Petrou-Papadaki H, Lenk L, Jansen O, Schreiber S, Laudes M (2017) Гіпоталамічне запалення при ожирінні людини опосередковується екологією та генетичні фактори. Діабет 66: 2407
Lancaster GI, Langley KG, Berglund NA, Kammoun HL, Reibe S, Estevez E, Weir J, Mellett NA, Pernes G, Conway JRW, Lee MKS, Timpson P, Murphy AJ, Masters SL, Gerondakis S, Bartonicek N, Kaczorowski DC, Dinger ME, Meikle PJ, Bond PJ, Febbraio MA (2018) Докази того, що TLR4 не є рецептором насичених жирних кислот, а опосередковує індуковане ліпідами запалення шляхом перепрограмування метаболізму макрофагів. Cell Metab 27: 1096–1110.e1095
Le Thuc O, Stobbe K, Cansell C, Nahon JL, Blondeau N, Rovere C (2017) Гіпоталамічне запалення та порушення енергетичного балансу: прожектор на хемокінах. Передній ендокринол (Лозанна) 8: 197
Lee JY, Sohn KH, Rhee SH, Hwang D (2001) Насичені жирні кислоти, але не ненасичені жирні кислоти, індукують експресію циклооксигенази-2, опосередковану через Toll-подібний рецептор 4. J Biol Chem 276: 16683–16689
Lu XY, Barsh GS, Akil H, Watson SJ (2003) Взаємодія між альфа-меланоцитостимулюючим гормоном та кортикотропін-рилізинг-гормоном у регуляції харчування та гіпоталамо-гіпофізарно-надниркової реакції. J Neurosci 23: 7863–7872
Luquet S, Perez FA, Hnasko TS, Palmiter RD (2005) NPY/AgRP-нейрони необхідні для годування у дорослих мишей, але можуть бути абляційними у новонароджених. Наука 310: 683–685
Mayer CM, Belsham DD (2010) Пальмітат послаблює інсулінову сигналізацію та індукує стрес ендоплазматичного ретикулума та апоптоз у нейронах гіпоталамусу: порятунок резистентності та апоптозу за допомогою активації аденозин 5 ′ монофосфатом активованої протеїнкінази. Ендокринологія 151: 576–585
Міланскі М, Дегаспери Г, Коопе А, Морарі Дж, Денис Р, Чінтра Д.Е., Цукумо ДМЛ, Анхе Г, Амарал МЕ, Такахасі Х.К., Курі Р, Олівейра Х.К., Карвальейра Дж.Б.К., Бордін С., Саад М.Дж., Веллосо Л. Насичені жирні кислоти виробляють запальну реакцію переважно завдяки активації сигналів TLR4 в гіпоталамусі: наслідки для патогенезу ожиріння. J Neurosci 29: 359–370
Мортон Дж. Дж., Каммінгс Д. Е., Баскін Д. Г., Барш Г. С., Шварц М. В. (2006) Контроль центральної нервової системи вживання їжі та маси тіла. Nature 443: 289–295
Nascimento LF, Souza GF, Morari J, Barbosa GO, Solon C, Moura RF, Victorio SC, Ignacio-Souza LM, Razolli DS, Carvalho HF, Velloso LA (2016) n-3 жирні кислоти індукують нейрогенез переважно експресуючих POMC клітин в гіпоталамусі. Діабет 65: 673–686
Obici S, Zhang BB, Karkanias G, Rossetti L (2002) Сигналізація про гіпоталамічний інсулін необхідна для інгібування вироблення глюкози. Nat Med 8: 1376–1382
Posey KA, Clegg DJ, Printz RL, Byun J, Morton GJ, Vivekanandan-Giri A, Pennathur S, Baskin DG, Heinecke JW, Woods SC, Schwartz MW, Niswender KD (2009) Гіпоталамічні прозапальні накопичення ліпідів, запалення та резистентність до інсуліну у щурів, що харчуються дієтою з високим вмістом жиру. Am J Physiol Endocrinol Metab 296: E1003–1012
Puig J, Blasco G, Daunis-I-Estadella J, Molina X, Xifra G, Ricart W, Pedraza S, Fernández-Aranda F, Fernández-Real JM (2015) Пошкодження гіпоталамуса пов'язане із запальними маркерами та гіршими когнітивними показниками у ожиріння предметів. J Clin Endocrinol Metab 100: E276 – E281
Ropelle ER, Flores MB, Cintra DE, Rocha GZ, Pauli JR, Morari J, De Souza CT, Moraes JC, Prada PO, Guadagnini D, Marin RM, Oliveira AG, Augusto TM, Carvalho HF, Velloso LA, Saad MJ, Carvalheira JB (2010) Протизапальна активність IL-6 та IL-10 пов'язує вправу з чутливістю до гіпоталамусу до інсуліну та лептину через пригнічення стресу IKKbeta та ER. PLoS Biol 8: e1000465
Рот CL (2015) Гіпоталамічне ожиріння у пацієнтів із краніофарингіомою: порушений енергетичний гомеостаз, пов’язаний із ступенем пошкодження гіпоталамуса та його наслідком для втручання в ожиріння. J Clin Med 4: 1774–1797
Schwartz MW, Woods SC, Porte D Jr, Seeley RJ, Baskin DG (2000) Контроль центральної нервової системи вживання їжі. Nature 404: 661–671
Sergi D, Morris AC, Kahn DE, Mclean FH, Hay EA, Kubitz P, Mackenzie A, Martinoli MG, Drew JE, Williams LM (2018) Пальмітинова кислота викликає запальні реакції в культивованих клітинах гіпоталамусу N42 частково через синтез кераміду, але не через TLR4 . Nutr Neurosci. https://doi.org/10.1080/1028415X.2018.1501533
Singhal G, Jaehne EJ, Corrigan F, Toben C, Baune BT (2014) Запалення при нейрозапаленні та зміни функції мозку: цілеспрямований огляд. Передні Невроски 8: 315
Сміт КБ, Сміт МС (2016) Статистика ожиріння. Prim Care 43 (121–135): ix
дугоподібні ядра мікросхем і "/>
Стернсон С.М., Шеперд Г.М., Фрідман Дж.М. (2005) Топографічне картографування VMH -> мікросхем дугоподібного ядра та їх реорганізація натщесерце. Nat Neurosci 8: 1356–1363
Stienstra R, Van Diepen JA, Tack CJ, Zaki MH, Van De Veerdonk FL, Perera D, Neale GA, Hooiveld GJ, Hijmans A, Vroegrijk I, Van Den Berg S, Romijn J, Rensen PCN, LaB Joosten, Netea MG, Kanneganti TD (2011) Inflammasome є центральним гравцем в індукції ожиріння та резистентності до інсуліну. Proc Natl Acad Sci USA 108: 15324–15329
Sumithran P, Prendergast LA, Delbridge E, Purcell K, Shulkes A, Kriketos A, Proietto J (2011) Тривала стійкість гормональних адаптацій до втрати ваги. N Engl J Med 365: 1597–1604
Саттон А.К., Майєрс М.Г. молодший, Олсон Д.П. (2016) Роль схем ПВХ у дії лептину та енергетичному балансі. Annu Rev Physiol 78: 207–221
Tak PP, Firestein GS (2001) NF-kappaB: ключова роль при запальних захворюваннях. J Clin Invest 107: 7–11
Thaler JP, Yi CX, Schur EA, Guyenet SJ, Hwang BH, Dietrich MO, Zhao XL, Sarruf DA, Izgur V, Maravilla KR, Nguyen HT, Fischer JD, Matsen ME, Wisse BE, Morton GJ, Horvath TL, Baskin DG, Tschop MH, Schwartz MW (2012) Ожиріння асоціюється з пошкодженням гіпоталамуса у гризунів та людей. J Clin Invest 122: 153–162
Timper K, Bruning JC (2017) Гіпоталамічні схеми, що регулюють апетит та енергетичний гомеостаз: шляхи до ожиріння. Dis Models Mech 10: 679–689
Valdearcos M, Robblee MM, Benjamin DI, Nomura DK, Xu AW, Koliwad SK (2014) Мікроглія диктує вплив споживання насичених жирів на запалення гіпоталамуса та функцію нейронів. Клітинне представництво 9: 2124–2138
Valdearcos M, Douglass JD, Robblee MM, Dorfman MD, Stifler DR, Bennett ML, Gerritse I, Fasnacht R, Barres BA, Thaler JP, Koliwad SK (2017). . Cell Metab 26: 185
Williams KW, Liu T, Kong X, Fukuda M, Deng Y, Berglund ED, Deng Z, Gao Y, Liu T, Sohn JW, Jia L, Fujikawa T, Kohno D, Scott MM, Lee S, Lee CE, Sun K, Chang Y, Scherer PE, Elmquist JK (2014) Xbp1 s у нейронах Помка пов’язує стрес ER з енергетичним балансом та гомеостазом глюкози. Cell Metab 20: 471–482
Won JC, Jang PG, Namkoong C, Koh EH, Kim SK, Park JY, Lee KU, Kim MS (2009) Центральне введення індуктора стресу ендоплазматичного ретикулума пригнічує анорексигенні ефекти лептину та інсуліну. Ожиріння (Срібна весна) 17: 1861–1865
Woods SC, Seeley RJ, Porte D, Schwartz MW (1998) Сигнали, що регулюють споживання їжі та енергетичний гомеостаз. Наука 280: 1378–1383
Woods JA, Wilund KR, Martin SA, Kistler BM (2012) Вправи, запалення та старіння. Старіння Dis 3: 130–140
Xu B, Goulding EH, Zang K, Cepoi D, Cone RD, Jones KR, Tecott LH, Reichardt LF (2003) Нейротрофічний фактор, що походить від мозку, регулює енергетичний баланс за рецептором меланокортину-4. Nat Neurosci 6: 736–742
Xu AW, Ste-Marie L, Kaelin CB, Barsh GS (2007) Інактивація перетворювача сигналу та активатора транскрипції 3 у нейронах проопіомеланокортину (Pomc) спричиняє зниження експресії Pomc, легке ожиріння та дефекти компенсаторного харчування. Ендокринологія 148: 72–80
Yi CX, Al-Massadi O, Donelan E, Lehti M, Weber J, Ress C, Trivedi C, Muller TD, Woods SC, Hofmann SM (2012) Вправа захищає від запалення гіпоталамусу, спричиненого дієтою. Фізіол Бехав 106: 485–490
Youm YH, Nguyen KY, Grant RW, Goldberg EL, Bodogai M, Kim D, D'agostino D, Planavsky N, Lupfer C, Kanneganti TD, Kang S, Horvath TL, Fahmy TM, Crawford PA, Biragyn A, Alnemri E, Dixit VD (2015) Кетоновий метаболіт бета-гідроксибутират блокує NLRP3, опосередковану запальним захворюванням. Nat Med 21: 263–269
Zhang X, Zhang G, Zhang H, Karin M, Bai H, Cai D (2008) Гіпоталамічний IKKbeta/NF-kappaB та ER стрес пов'язують переїдання з енергетичним дисбалансом та ожирінням. Клітина 135: 61–73
Zhao Y, Li G, Li Y, Wang Y, Liu Z (2017) Збиття Tlr4 в дугоподібному ядрі покращує метаболічні розлади, пов’язані з ожирінням. Sci Rep 7: 7441
Подяки
Ця робота була підтримана Національним науковим фондом (2016R1C1B3012748 та 2016R1A5A2008630 - К.В.К.), Корейським інститутом розвитку індустрії охорони здоров’я (HI17C0745 - К.В.К.) та Стоматологічним коледжем університету Йонсей (2018-32-0007).
Інформація про автора
Приналежності
Кафедра усної біології, стоматологічний коледж університету Йонсей, BK21 PLUS, Сеул, 03722, Корея
Джичан Сонг, Чжун Юн Кан, Джи Су Сун і Кі Ву Ким
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Відповідний автор
Декларації про етику
Конфлікт інтересів
Автори заявляють, що не існує конфлікту інтересів.
Додаткова інформація
Примітка видавця
Springer Nature залишається нейтральним щодо юрисдикційних вимог в опублікованих картах та інституційних приналежностей.
- Гіпоталамічне ожиріння після операції на краніофарингіомі; Лікування глюкагоном тривалої дії
- Ставлення медичних працівників до ожиріння Інтегративний огляд - ScienceDirect
- Медичне управління ожирінням SpringerLink
- Методи оцінки природних експериментів при систематичному перегляді доказів ожиріння - Книжкова полиця NCBI
- Методи оцінки природних експериментів при ожирінні Систематичний огляд має значення медицина