Геномна реакція нирки миші на дієту з низьким вмістом фосфатів змінюється при Х-зчепленій гіпофосфатемії
Лабораторія ортопедичних досліджень, Медичний центр Каролінас, Шарлотта, Північна Кароліна 28232-2861
Лабораторія ортопедичних досліджень, Медичний центр Каролінас, Шарлотта, Північна Кароліна 28232-2861
Лабораторія ортопедичних досліджень, Медичний центр Каролінас, Шарлотта, Північна Кароліна 28232-2861
Анотація
Механізм адаптації нирок до дієти з низьким вмістом фосфатів недостатньо вивчений. Чи то Хіп мутація Phex ген блокує цю адаптацію також незрозуміло. Щоб отримати подальше розуміння цього, 5-тижневий нормальний і Хіп мишей годували контрольною (1,0% Р) або низькофосфатною дієтою (0,03% Р) протягом 3-5 днів. Ниркову РНК гібридизували з мікрочипами Affymetrix U74Av2 (5 масивів/група). З 5719 виявлених генів у кожному масиві 290 значно відповіли (P нирка ссавців має змінну швидкість реабсорбції фосфату в нирках, що реагує на зміну рівня фосфатів у їжі (33). Низьке споживання фосфату з дієтою стимулює реабсорбцію (канальцевий максимум, Tm) фосфату та підвищує нирковий синтез 1,25-дигідроксивітаміну D3 (16, 26). Хоча багато відомо про білки, які транспортують фосфатні іони через клітинну мембрану (27), менше відомо про гормони та цитокіни, які регулюють цей процес. Інша область невизначеності - процес, за допомогою якого реабсорбований фосфат перетинає внутрішню клітину.
Для вивчення цієї системи доступні два експериментальні протоколи. Низькофосфатні дієти стимулюватимуть гомеостатичні механізми збереження фосфатів (16, 26). Крім того, мутації втрати функції Phex ген блокує цю адаптацію та пригнічує збереження фосфатів (26). Відомо, що мутації цього гена трапляються у пацієнтів із Х-зчепленою гіпофосфатемією (33) та у Хіп і Gy мутації мишей (8, 13, 37).
У цьому проекті експресію гена мРНК у нирках миші вивчали за технологією мікрочипів ДНК. Ми припустили, що гени, що беруть участь у реакції нирок на зміну споживання фосфатів у їжі, реагуватимуть на стимуляцію дієтою з низьким вмістом фосфатів та/або пригнічення Хіп мутація. 1
1 Американське фізіологічне товариство спонсорувало зустріч у готелі Riverfront Augusta в місті Аугуста, штат Джорджія, 1–4 жовтня 2003 р., Під назвою „Розуміння функції нирок та серцево-судинної системи через фізіологічну геноміку”, організовану Девідом Поллоком з Медичного коледжу штату Джорджія (див. звіт про засідання Морено С та Поллок Д.М. Фізіольна геноміка 16: 178–179, 2004; 10.1152/фізіолгеноміка.00195.2003. http://physiolgenomics.physiology.org/cgi/content/full/16/2/178).
Цей протокол був схвалений Інституційним комітетом з догляду та використання тварин Медичного центру Каролінаса. Нормальна та Х-зв’язана гіпофосфатемічна, Хіп, мишей виводили в нашій колонії на фоні C57BL/6J із запасів, що походять з лабораторії Джексона, Бар-Харбор, штат Мен, як описано раніше (18). Селекціонерів годували Teklad Mouse Breed Diet (W) No. 8626 (Harlan, Madison, WI) та водопровідна вода ad libitum. Дитинчат відлучили у віці 3 тижнів і перевели на дієту для гризунів Teklad (W). 8604 (Харлан). У віці 5 тижнів миші, Хіп [напівжиготний самець (Хіп/ Y) і гетерозиготна самка (Хіп/ +)] та нормальних (дикого типу) мишей самців і самок годували контрольною (1,0% Р, Teklad 86129) або низькофосфатною дієтою (0,03% P, Teklad 86128) протягом 3-5 днів.
Потім тваринам знеболювали, одну капілярну трубку (70 мкл) крові відбирали з орбітальної пазухи та збирали обидві нирки. Нирки заморожували у рідкому азоті та зберігали при -75 ° C. Потім нирки зважували та гомогенізували, а загальну РНК екстрагували TRIzol (GIBCO-BRL; Invitrogen, Gaithersburg, MD) (15). Неорганічний фосфат плазми вимірювали методом Chen et al. (5).
Експериментальний дизайн.
Рівні кількості РНК від трьох мишей, що відповідали генотипу, статі, дієті та часу на дієті, були об’єднані для створення кожної проби для аналізу мікрочипів. Було проведено чотири групи лікування: 1) Звичайні миші годували контрольну дієту, 2) нормальних мишей годували низькофосфатною дієтою, 3) Хіп мишей, які годували контрольну дієту, або 4) Хіп миші годували низькофосфатною дієтою. Було зроблено п’ять повторень з кожним повторенням, що містило по одному зразку з кожної з чотирьох оброблених груп, загалом для 20 незалежних зразків (всього 60 мишей). Кожна копія була підібрана для односемейних дітей, статі (3 копії самців мишей та 2 самки мишей), часу на дієті (3 копії через 5 днів та 2 через 3 дні) та паралельна обробка.
Аналіз мікрочипів.
Зразки обробляли, як описано в Технічному посібнику з аналізу виразів Affymetrix GeneChip (Affymetrix, Санта-Клара, Каліфорнія; Rev. 1, частина № 701021, http://www.affymetrix.com). Підготовка зразка описана тут коротко. Зразки з 30 мкг РНК очищали на колонках RNeasy від Qiagen (Валенсія, Каліфорнія; продукт No 74104), а потім перетворювали на дволанцюгові кДНК за допомогою набору синтетичних кДНК SuperScript з дволанцюговим набором (продукт № 11917-010; Invitrogen, Carlsbad, Каліфорнія). Потім кДНК експресували як мічену біотином кРНК шляхом транскрипції in vitro (IVT) за допомогою набору для маркування транскриптів РНК Enzo (Affymetrix, номер продукту 900182). Кожен зразок додавали bioB, bioC, bioD та cre (Affymetrix, продукт № 900299). Мічена біотином кРНК була фрагментована неферментативно. Фрагментовану кРНК з 20 незалежних зразків гібридизували до 20 мікрочипів мишей U74Av2 (Affymetrix, продукт № 900343) у буфері гібридизації Affymetrix протягом 16 год при 45 ° C. Гібридизовані масиви промивали і фарбували на станції Affymetrix Fluidics 400 для прикріплення флуоресцентних міток до біотину, потім антитіл, мічених біотином, а потім другого фарбування флуоресцентним маркуванням біотину. Кожен масив сканувався двічі сканером Agilent GeneArray G2500A (Agilent Technologies, Пало-Альто, Каліфорнія).
Аналіз даних.
Дані аналізували за допомогою програмного забезпечення Affymetrix Microarray Suite 5.0 та Affymetrix Data Mining Tool 3.0. Набір Microarray Suite був використаний для масштабування експресії мРНК (значення сигналу) усіх генів до середнього рівня для кожного масиву. Дані для всіх генів для 20 зразків були передані в електронну таблицю Excel (Microsoft, Redmond, WA). Дані були об’єднані в копії. В парі т-Потім були розраховані тести, щоб перевірити ефект від Хіп мутація шляхом порівняння нормальних мишей з Хіп мишей, яких годували контрольною дієтою (табл. 1). Ефект дієти з низьким вмістом фосфатів був перевірений порівнянням мишей, які годували контрольну дієту, та мишей, які годувались низькофосфатною дієтою для мишей того самого генотипу (таблиці 2 та 3). Дані виражали як середнє значення ± SE для п’яти повторень.
Таблиця 1. Порівняння експресії генів мРНК у нормальних мишей та мишей Hyp, які годували контрольну дієту
Дані є середніми значеннями ± SE для п’яти зразків на групу. Рівні мРНК знаходяться у довільних одиницях флуоресценції.
Таблиця 2. Нормальні миші: контроль проти дієти з низьким вмістом фосфатів
Дані є середніми значеннями ± SE для п’яти зразків на групу. Рівні мРНК знаходяться у довільних одиницях флуоресценції.
Таблиця 3. Миші Hyp: контроль проти дієти з низьким вмістом фосфатів
Дані є середніми значеннями ± SE для п’яти зразків на групу. Рівні мРНК знаходяться у довільних одиницях флуоресценції.
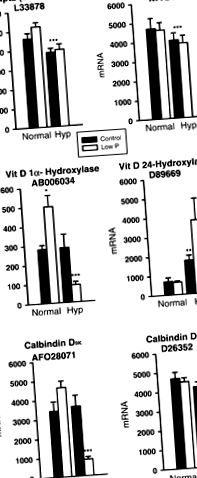
Гени, раніше пов’язані із збереженням фосфатів, були відібрані для представлення на рис. 1. Інструмент аналізу даних був використаний для ідентифікації генів з великою реакцією на лікування. Вони показані на рис. 234. Інші гени були обрані з GenMAPP "Процес на основі Mm_microtubule" для представлення на рис. 5.
Рис. 1.експресія гена мРНК в нормі і Хіп мишей, яких годували контролем або дієтою з низьким вмістом фосфатів для генів, які раніше вивчались у фосфатному гомеостазі. Кожен стовпчик є середнім значенням ± SE середнього значення для п’яти зразків. Зірочками позначені суттєві відмінності при *P
Рис.2.Експресія гена мРНК для генів, що реагують на Хіп мутація. Дані представлені як на рис. 1.
Формули дисперсійного аналізу 2 × 2 із повними блоками (48) були вставлені в один рядок і скопійовані до всіх генів. Потім таблицю сортували за статистикою F для взаємодії між дієтою (контроль або низький рівень Р) та генотипом (нормальний або Хіп). Це було використано для виявлення генів, для яких реакція на дієту з низьким вмістом фосфатів відрізнялася від нормальної та Хіп мишей (табл. 4). Гени називаються за номером приєднання до GenBank (http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=Nucleotide) та найновішим функціональним найменуванням із бази даних NetAffx (http: //www.affymetrix .com).
Таблиця 4. Генотип за дієтою
2 Додатковий матеріал до цієї статті (Додаткові таблиці 5–8) доступний в Інтернеті за адресою http://physiolgenomics.physiology.org/cgi/content/full/00210.2003/DC1.
Далі для вибраних генів додатково аналізували алгоритм GLM за допомогою тесту множинного порівняння Тукі системою SAS для Windows, випуск 8.02 (SAS Institute, Cary, NC).
GenMAPP.
«Hs-Mm-Rn-Affy_database» (http://www.GenMAPP.org; лабораторія Конклін, Інститут Дж. Девіда Гладстона, Каліфорнійський університет у Сан-Франциско, Сан-Франциско, Каліфорнія) була використана для перетворення описаної вище таблиці у формат, сумісний з GenMAPP. Результати з парних т-тести та дисперсійний аналіз були передані до програмного забезпечення GenMAPP (Gene Microarray Pathway Profiler, версія 1.0, http://www.GenMAPP.org). Потім MAPPFinder (версія 1.0, http://www.GenMAPP.org) використовувався для виявлення метаболічних шляхів, які найбільше постраждали від лікування.
Цей звіт відповідає стандартам MIAME MGED (http://www.mged.org). Копія повного набору даних мікрочипів була депонована в Омнібус NCBI Gene Expression (http://www.ncbi.nlm.nih.gov/geo) як серія GSE868.
На початку експериментальних дієт нормальні миші складали в середньому 13,5 г, а Хіп миші в середньому складали 11,2 г. У відповідь на підгодівлю експериментальної дієти обидва нормальні [2,7 ± 0,2 (15) г, означають ± SE (с n у дужках), P
Рис.3.Експресія гена мРНК для генів, що відповідають на дієту з низьким вмістом фосфатів у звичайних мишей, але не у Хіп мишей. Дані представлені як на рис. 1.
Хіп миші також реагували на дієту з низьким вмістом фосфатів. Всього 86 генів (значно більше, ніж випадковий ефект 57 генів, P
Рис.4.Експресія гена мРНК для генів, що реагують на дієту з низьким вмістом фосфатів як у нормальному, так і в Хіп мишей. Дані представлені як на рис. 1.
Хіп мутація зменшує збереження фосфатів у нирках, тоді як дієта з низьким вмістом фосфатів стимулює збереження фосфатів. Таким чином, ми висунули гіпотезу про те, що деякі гени будуть збільшені за допомогою дієти з низьким вмістом фосфатів у звичайних мишей, але зменшуватимуться у Хіп миші на контрольній дієті. (Або може статися зворотне: зменшується при низькому вмісті фосфатних раціонів у звичайних мишей, але збільшується на Хіп мутація). Це сталося лише для чотирьох генів (3 зменшився, а 1 збільшився у звичайних мишей на дієті з низьким вмістом фосфатів), що було на рівні випадкової події. Трансфіретин (рис. 2) та дезоксирибонуклеаза I (рис. 4) є прикладами цього.
Генотип за дієтою.
Для подальшого пошуку генів, на які диференційовано впливає дієта з низьким вмістом фосфатів, в нормі та Хіп мишей, статистику взаємодії генотипу за дієтою розраховували шляхом дисперсійного аналізу. Цей аналіз використовував усі чотири засоби групи лікування. Він перевіряв, чи відповідає реакція на низькофосфатну дієту в Росії Хіп миші суттєво відрізнялися від реакції звичайних мишей. Чисельним результатом був F-тест на взаємодію генотипів за дієтою. Найсильніші взаємодії (ті при P
Рис.5.експресія гена мРНК для генів, пов'язаних з мікротрубочками, які реагують на низькофосфатну дієту у звичайних мишей, але не в Хіп мишей. Дані представлені, як на рис. 1, із порівнянням індивідуальних методів лікування за парами т-тест. Значення ймовірності, пов'язане зі значним взаємодією генотип × дієта (PI) в аналізі дисперсія наведена таблиця для кожного гена.
GenMAPP “Mm_antioxidant” вказував на зміни рівня мРНК для генів, пов’язаних з антиоксидантною активністю. Рівні експресії для глутатіонредуктази 1 (AI851983, Додаткова таблиця 8), пероксиредоксину 2 (U20611, Додаткова таблиця 8) та секвестосоми 1 (Рис. 3) підвищувались за допомогою дієти з низьким вмістом фосфатів у звичайних мишей, але не в Хіп мишей.
- Дієтичне рішення для нирок від Duncan Capicchiano, Ласкаво просимо до хвороби нирок та діалізу myDaVita
- Битва жаб і мишей, частина 3 Миша описує свій раціон; SENTENTIAE АНТИКВА
- Поради та рецепти для тривалого перебування вдома - ниркові дієтичні поради
- Дієта з приводу ниркової недостатності Cap’n - серйозне рішення для ниркової недостатності на кінцевому етапі; ДІАБЕТИЧНА ДАРМА
- Всесвітній день нирок Діє та застосовує ниркову кам’яну дієту; Знайте, що їсти і чого уникати