Генетична характеристика основної колекції льону (Linum usitatissimum L.), придатної для досліджень картографування асоціацій та доказів дивергентного відбору між типами клітковини та льону
Брауліо Дж. Сото-Серда
1 Кафедра рослинництва, Університет Манітоби, 66 Dafoe Road, Вінніпег, MB R3T 2N2, Канада
2 Дослідницький центр зернових культур, сільське господарство та сільськогосподарська їжа Канади, 195 Dafoe Rd, Вінніпег, MB R3T 2M9, Канада
4 Присутня адреса: Агрокультурний генетичний центр харчування, CGNA, Геноміка та біоінформатика Unito, км 10 Каміно Кахон-Вілкун, INIA Темуко, Чилі
Аксель Дідеріхсен
3 рослинні генні ресурси Канади, сільське господарство та сільськогосподарська їжа Канади, 107 Science Place, Саскачеван, SK S7N 0X2, Канада
Раджа Рагупаті
1 Кафедра рослинництва, Університет Манітоби, 66 Dafoe Road, Вінніпег, MB R3T 2N2, Канада
2 Дослідницький центр зернових культур, сільське господарство та сільськогосподарська їжа Канади, 195 Dafoe Rd, Вінніпег, MB R3T 2M9, Канада
Сільві Клутьє
1 Кафедра рослинництва, Університет Манітоби, 66 Dafoe Road, Вінніпег, MB R3T 2N2, Канада
2 Науково-дослідний центр зернових культур, сільське господарство та сільськогосподарська продукція Канади, 195 Dafoe Rd, Вінніпег, MB R3T 2M9, Канада
Пов’язані дані
Анотація
Передумови
Льон цінується завдяки клітковині, насіннєвій олії та нутрицевтикам. Нещодавно волокниста промисловість інвестувала у розробку продуктів, виготовлених із льняних стебел, роблячи її культурою подвійного призначення. Одночасне націлювання на геномні регіони, що контролюють ознаки якості стовбурової клітковини та насіння, може дати можливість розвитку сортів подвійного призначення. Однак генетичне різноманіття, структура популяції та моделі нерівноваги зв’язків (LD), необхідні для картографування асоціацій (AM), ще не були оцінені у льоні, оскільки геномні ресурси були розроблені лише нещодавно. Ми охарактеризували 407 глобально розподілених приєднань льону з використанням 448 маркерів мікросупутника. Дані аналізували для оцінки придатності цієї основної колекції для АМ. Геномні сканування для ідентифікації генів-кандидатів, відібраних під час дивергентного процесу розведення волокна льону та льону, проводились із використанням цілої послідовності льону льону.
Результати
Комбінований аналіз генетичної структури відніс усі приєднання до двох основних груп із шістьма підгрупами. Диференціація населення була слабкою між основними групами (FST = 0,094) та для більшості парних порівнянь між підгрупами. Аналіз молекулярного коанцестри показав слабку спорідненість (середнє значення = 0,287) для більшості окремих пар. Рясне генетичне різноманіття спостерігалось у загальній панелі (5,32 алелів на локус), а деякі підгрупи показали високу частку приватних алелів. Середня загальногеномна LD (r 2) становила 0,036, з відносно швидким розпадом 1,5 cM. Геномне сканування між клітковиною льону та лляного насіння виявило гени-кандидати, що беруть участь у біогенезі/модифікації клітинної стінки, ідентифікації ксилеми та біосинтезі жирних кислот, що відповідає генам, раніше ідентифікованим у льону та інших видів рослин.
Висновки
Грунтуючись на великому генетичному різноманітті, слабкій структурі популяцій та спорідненості та відносно швидкому розпаді LD, ми дійшли висновку, що ця основна колекція підходить для досліджень АМ, спрямованих на різноманітні агрономічні та якісні ознаки, спрямовані на поліпшення льону як справжньої культури подвійного призначення. Наші геномні скани надають перші уявлення про регіони-кандидати, на які впливає різнорідний відбір льону. У поєднанні з АМ геномні скани можуть збільшити потужність виявлення локусів, що впливають на складні ознаки.
Передумови
Льон (Linum usitatissimum L.) - однорічний самозапилюваний вид з розміром геному
Початкові оцінки різноманітності льону проводили з використанням морфологічних параметрів [9-12] та ізоферментів [13,14]. В останні роки такі системи молекулярних маркерів, як випадково ампліфікована поліморфна ДНК (RAPD), ампліфікований поліморфізм довжини фрагментів (AFLP), повторення міжпростих послідовностей (ISSR), повторення простих послідовностей (SSR) та поліморфізм, посилений міжретротранспозонами (IRAP). використовувались для вимірювання генетичних варіацій та взаємозв’язків у сортах і ландрасних льонах [15-29]. Однак більшість з цих попередніх досліджень оцінювали або мало локусів маркерів, або декілька генотипів.
Світові банки генів зберігають приблизно 48 000 приєднань зародкової плазми льону [30]. У Канаді колекція культивованого льону, що охоплює близько 3500 порцій, підтримується Канадою рослинних генних ресурсів (PGRC). Цю колекцію традиційно застосовують у льонарстві за допомогою різноманітних традиційних стратегій [3]. У 2009 році в Канаді було започатковано проект Total Utilization льняної геноміки (TUFGEN; http://www.tufgen.ca) з метою генемації ресурсів для льону та їх застосування до масиву ознак з кінцевою метою вдосконалення льону. Проект TUFGEN розробив численні геномічні ресурси, включаючи молекулярні маркери [23,29,31], генетичні карти [32,33], фізичну карту та кінцеві послідовності бактеріальних штучних хромосом [1], виражені теги послідовності [34] та рушницю цілого генома послідовність [35]. Для того, щоб скористатися цими інструментами, була зібрана основна колекція з 407 приєднань льону, що фіксує широту фенотипового різноманіття колекції PGRC.
Кількісні локуси ознак (QTL) та картографування асоціацій (AM) є додатковими підходами для ідентифікації асоціації маркер-ознака. Перший використовує популяції біпарентального картографування для моніторингу спільної сегрегації QTL та локусів маркерів. Другий використовує колекції зародкової плазми для виявлення кореляцій QTL-маркерів на основі LD [36]. QTL-аналіз має обмежену роздільну здатність відображення через накопичення кількох подій мейозу в одному перехресті, але на нього не впливає структура популяції, яка може бути джерелом помилкової асоціації в АМ. І навпаки, AM може досягти більш високої роздільної здатності відображення завдяки великій кількості історичних подій рекомбінації в колекціях зародкової плазми. Ідеальна група асоціацій повинна містити найширше генетичне різноманіття, оскільки це часто корелює із швидким розпадом LD, необхідним для вирішення складних варіацій ознак до одного гена чи нуклеотиду [37]. Також бажані нульова або слабка структура популяції та низький рівень спорідненості серед особин колекції зародкової плазми. Таким чином, генетичне різноманіття, структуру популяції, сімейні спорідненості та закономірності ЛД необхідно оцінити перед аналізом АМ, щоб повністю використати їх переваги для поліпшення льону.
У цьому дослідженні ми генотипували 407 приєднань льону з використанням 448 мікросупутникових локусів. Загальною метою було оцінити корисність цієї колекції льонових стрижнів для досліджень АМ. Нашими конкретними цілями були: (1) дослідити генетичне різноманіття; (2) для оцінки рівня структури населення та оцінки сімейних спорідненостей; (3) виявити закономірності LD; та (4) визначити нейтральні геномні області, які потенційно лежать в основі дивергентного відбору між типами клітковини та льону.
Результати
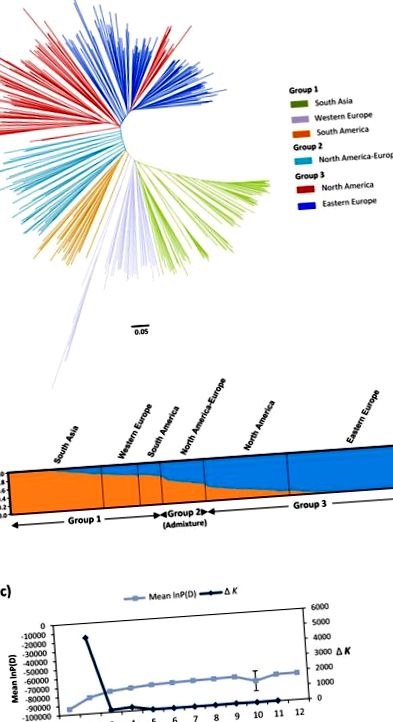
Філогенетичний аналіз
Розподіл попарних оцінок молекулярного співучасті та занепад рівноваги зв'язку. (а) Глобальні парні молекулярні співіснування оцінюють 407 приєднань льону до основної колекції. Показані лише значення спорідненості від 0 до 0,5. (b) Розсіяний графік розпаду LD (r 2) на генетичні відстані (cM) для пар зв'язаних SSR по 15 групах зчеплення. Внутрішня панель показує детальний вигляд розпаду LD для маркерів, розташованих в межах 5 см. Криві розпаду були побудовані за Брезегелло та Сорелсом [75]. Синя лінія представляє пороговий рівень значущості (r 2 = 0,1). Червона лінія являє собою середню загальногеномну LD пов'язаних маркерів. (c) Оцінки парного молекулярного коканстризму [72] в межах кожної з шести підгруп. Значення діагоналі відповідають внутрішньопідгрупі молекулярного співучості. (d) Середні криві розпаду LD по всьому геному для зв’язаних маркерів у кожній з шести підгруп.
Генетичне різноманіття
У колекції ядра 414 нейтральних мікросателітів зберегли виявлені 2202 алелі (Na) (середнє = 5,32/локус), з яких 1187 (54%) мали MAF 1). Параметри Na, Rs, ∏, Ra та PIC у G1 перевершували параметри у G3, хоча чисельність популяції G1 була на 25% меншою, ніж G3. Параметри Ho та FIS у основних колекціях, основних групах та підгрупах відповідають переважно самозапилюваному характеру виду.
Таблиця 1
Параметри генетичного різноманіття основної колекції для двох основних груп (G1 та G3), змішана група (G2) та їх під-групи
| Основна колекція | 407 | 0,427 | 0,023 | 2202 | 5.68 | - | 1187 | 0,946 | 100 | 0,374 |
| Група 1 | 153 | 0,418 | 0,023 | 1978 рік | 4.37 | 547 | 925 | 0,944 | 99,8 | 0,361 |
| Південна Азія | 92 | 0,348 | 0,020 | 1510 рік | 2,85 | 116 | 542 | 0,931 | 95,9 | 0,305 |
| Західна Європа | 37 | 0,448 | 0,017 | 1608 рік | 3.44 | 246 | 418 | 0,961 | 97.1 | 0,393 |
| Південна Америка | 24 | 0,395 | 0,047 | 1135 | 2,70 | 27 | 186 | 0,878 | 91.3 | 0,332 |
| Група 2 | ||||||||||
| Північний Амер./Євро. | 43 | 0,411 | 0,023 | 1341 | 2.91 | 32 | 324 | 0,933 | 96.4 | 0,352 |
| 3 група | 211 | 0,356 | 0,022 | 1613 рік | 3.44 | 183 | 683 | 0,933 | 99.1 | 0,332 |
| Північна Америка | 95 | 0,378 | 0,028 | 1362 | 2,69 | 73 | 424 | 0,932 | 98,6 | 0,334 |
| Східна Європа | 116 | 0,300 | 0,020 | 1487 рік | 2,55 | 45 | 642 | 0,927 | 95,7 | 0,265 |
1 Кількість приєднань.
2 Неупереджена різноманітність генів.
3 Спостерігається гетерозиготність.
4 Кількість алелей.
5 алельне багатство та 6 кількість приватних алелів, оцінені на вибірці збалансованого розміру за допомогою методу розрідження [66].
7 Рідкісні алелі 8 Коефіцієнт інбридингу.
9 Зміст інформації про поліморфізм.
Незбалансованість зв'язків
Таблиця 2
Незбалансованість зв’язків у основній колекції для двох основних груп (G1 та G3), змішана група (G2) та їх шість підп-групи
- Характеристика видів паличок, що використовуються для пероральної бактеріотерапії та бактеріопрофілактики
- Чи працює Wonder Core Smart, як його бачили на телевізорі
- Клейтон Факти здоров’я Насіння льону
- Юна Зоя спостерігає за генетичними розладами тепер легша, щасливіша після битви за ожиріння - Mumbai Mirror
- Єзекіїль 4 9 Огляд льонового пророщеного хліба - просто Стейсі