Резистин: функціональні ролі та терапевтичні міркування при серцево-судинних захворюваннях
Анотація
ПОСИЛАННІ СТАТТІ
Ця стаття є частиною тематичного розділу про реактивність жиру та судин. Щоб переглянути інші статті цього розділу, відвідайте http://dx.doi.org/10.1111/bph.2012.165.issue-3
Вступ
Співвідношення резистину з чутливістю до інсуліну, діабетом та метаболічним синдромом
Коли резистин вперше був описаний в 2001 р. (Steppan et al., 2001b), було повідомлено про декілька основних відкриттів: рівень резистину в плазмі крові збільшувався в індукованих дієтою та генетичних формах моделі ожиріння миші; введення антирезистинового антитіла підвищеної чутливості до інсуліну у ожирілих та резистентних до інсуліну тварин; лікування здорових мишей рекомбінантним резистином, порушеним толерантністю до глюкози та дією інсуліну; і введення резистину погіршувало індуковане інсуліном поглинання глюкози в адипоцитах. З цих спостережень було зроблено висновок, що резистин відіграє важливу роль у резистентності до інсуліну та ожирінні на моделі діабетичної миші.
Проте застосовність цих висновків до досліджень на людях було важко визначити. У мишей резистин виділяється переважно з білої жирової тканини. На відміну від цього, резистин у людини в основному виділяється з моноцитів циркулюючої крові, а низький рівень надходить з білої жирової тканини (Savage et al., 2001). Крім того, людський резистин є лише 59% гомологічним мишачому резистину на рівні aa (Ghosh et al., 2003), що знову підкреслює обмеження використання моделі миші для вивчення метаболізму людини. Зрештою, суперечки тривають щодо патогенної ролі резистину у розвитку інсулінорезистентності та ожиріння у людей.
Кілька досліджень підтверджують позитивну кореляцію між ожирінням, резистентністю до інсуліну та підвищеним рівнем сироваткового резистину у людей. З одного боку, було описано, що резистин експресується в гепатоцитах людини та індукує резистентність до інсуліну (Sheng et al., 2008). Також виявлено, що рівні мРНК резистину легко виявити в PBMC людини і вищі у пацієнтів жіночої статі з DM2 порівняно зі здоровими жінками, що свідчить про роль резистину в патогенезі DM2 людини (Tsiotra et al., 2008). Подібним чином, при дослідженні взаємозв'язку між рівнем сироваткового резистину, ожирінням та резистентністю до інсуліну серед 125 іорданських пацієнтів із DM2 було встановлено, що рівні сироваткового резистину були вищими у пацієнтів із ожирінням із DM2 (індекс маси тіла ≥ 30 кг · м −2) порівняно з контролем ожиріння без діабету; ця кореляція не була статистично значущою між діабетиками та контролерами, які мали нормальну або надмірну вагу (Gharibeh et al., 2010). Ці дані свідчать про те, що резистин відіграє певну роль у патогенезі ожиріння та резистентності до інсуліну у людей, які, як видається, сприяють розвитку DM2.
Встановлено також, що концентрація резистину в середньому вища у пацієнтів з гестаційним діабетом (GDM) (21,9 нг · мл -1), ніж у вагітних з нормальною толерантністю до глюкози (19,03 нг · мл −1) та невагітних жінок (14,8 нг · мл −1, P 14 днів для загоєння - рівні резистину в плазмі та IL-6 були підвищені в порівнянні з пацієнтами з DM2 та відсутністю виразки стопи, знову зв’язуючи резистин, DM2 та запалення (Tuttolomondo et al., 2010).
Існують розбіжності в даних щодо зв'язку між резистином та ожирінням та/або діабетом. У деяких моделях гризунів було продемонстровано, що експресія мРНК резистину в жировій тканині ожирених тварин не корелює з рівнем резистину в сироватці крові, який, у свою чергу, не корелює з сироватковим інсуліном або глюкозою (Lee et al., 2005); в інших дослідженнях виявлено, що резистин фактично регулюється в жировій тканині ожирілих тварин (Le Lay et al., 2001; Milan et al., 2002). У дослідженнях на людях циркулюючий рівень експресії резистину та гена резистину як підвищений, так і незмінний при ожирінні та/або резистентності до інсуліну (Lee et al., 2003; Filippidis et al., 2005; Hasegawa et al., 2005; Ікбал та ін., 2005). Тим часом в іншому дослідженні (Laudes et al., 2010) було встановлено, що експресія резистину значно підвищується у пацієнтів із ожирінням порівняно з контролем, але не має кореляції з DM2. Очевидно, участь резистину (або його відсутність) у патогенезі інсулінорезистентності, пов’язаної з ожирінням, і DM2 вимагає подальшого дослідження; ймовірно, що резистин є біомаркером для та/або сприяє резистентності до інсуліну в певних групах населення.
Асоціація резистину з серцево-судинними захворюваннями
Резистин і макрофаги
Ключовим етапом у формуванні хронічної запальної атеросклеротичної хвороби є міграція циркулюючих моноцитів у субендотеліальний простір, де вони диференціюються в макрофаги. Потім макрофаги поглинають багаті холестерином атерогенні ліпопротеїни Apo-B (ЛПНЩ, ЛПНЩ і ЛПНЩ), утворюючи пінні клітини (Glass і Witztum, 2001). У людини резистин в основному експресується в моноцитах/макрофагах (Savage et al., 2001). Рецептори поглинання макрофагів (SR), такі як клас A SR (SR-AI, SR-AII, SR-AIII) і клас B SR (SR-BI, SR-BII, CD36), відповідають за інтерналізацію окисленого ЛПНЩ ( oxLDL) (Kunjathoor et al., 2002). Клітини піни, отримані з макрофагів, відіграють вирішальну роль у ініціюванні та прогресуванні атеросклерозу (Glass and Witztum, 2001; Li and Glass, 2002). Ці клітини інфільтрують артерії і ініціюють або сприяють атерогенезу, секретуючи різні прозапальні цитокіни (Ross, 1999).
Резистин і цитокіни
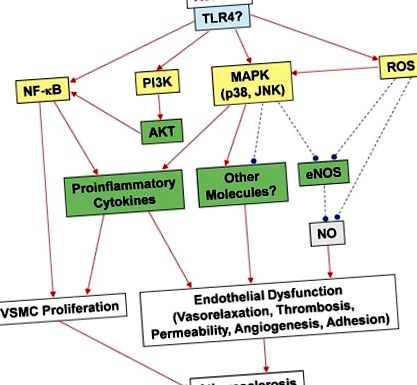
Цитокіни - це малі молекули, що сигналізують про клітини, опосередковують запалення. Цитокіни пов'язують відповідні рецептори клітинної поверхні і запускають внутрішньоклітинні сигнальні шляхи, які, в свою чергу, змінюють клітинні функції. Це може призвести до вищої та/або зниженої регуляції кількох генів та факторів їх транскрипції, що призведе до продукування інших цитокінів, збільшення кількості рецепторів клітинної поверхні для інших молекул або придушення їх власного ефекту шляхом гальмування зворотного зв'язку. Було продемонстровано, що резистин сприяє активації ендотеліальних клітин за рахунок вивільнення ЕТ-1 та регуляції посилення молекули адгезії судинних клітин та молекули міжклітинної адгезії-1; тим часом резистин веде до зниження експресії асоційованого з рецептором фактора некрозу пухлини (TNF) фактора-3 (TRAF-3), інгібітора сигналізації ліганду члена надсемейства рецептора TNF (CD40) (Verma et al., 2003 ). Крім того, було показано, що резистин індукує пентраксин 3, медіатор запалення, який бере участь в атеросклерозі, в ендотеліальних клітинах людини (Kawanami et al., 2004).
Сам резистин є адипокіном, і було встановлено, що він індукує експресію цитокінів та хемокінів у суглобових хондроцитах людини (Zhang et al., 2010). Показано, що резистин індукує експресію мРНК 20 перевірених цитокінів та хемокінів у нормальних хондроцитах людини, а також хондроцитах із збереженої зони остеоартритного хряща; до них належали TNF-α, IL-1α, IL-1β, CCL2, CCL3, CCL3L1, CCL4, CCL5, CCL8, CXCL1, CXCL2 та CXCL3. З метою вивчення потенційних механізмів, завдяки яким резистин індукує регуляцію запальних хемокінів та цитокінів у хондроцитах, був проведений обчислювальний аналіз на диференційовано експресованих генах; було встановлено, що гени, які найбільш високо регулюються, мають мотив зв'язування активованих B-клітин (NFκB) ядерного фактора, що зв'язує мотив активованих В-клітин, що було підтверджено за допомогою репортерної конструкції NFκB-люциферази в хондроцитах людини. Тим часом було виявлено, що фактор транскрипції C/EBPβ також має високий бал зв'язування, а котрансфекція вектора експресії C/EBPβ посилює промоторну активність CCL3 та CCL4. У сукупності ці дані свідчать про те, що NFκB та C/EBPβ можуть відігравати ключову роль у високому рівні експресії цитокінів та хемокінів у хондроцитах людини після лікування резистином.
Функція резистину та ендотелію
Нещодавно ми досліджували, чи не погіршує резистин функції ендотелію, впливаючи на систему ендотеліального оксиду азоту синтази (eNOS) в ендотеліальних клітинах коронарних артерій людини (HCAEC) (Chen et al., 2010). eNOS був обраний для дослідження через його важливу роль у контролі судинного тонусу та неоваскуляризації (Palmer et al., 1987; Murohara et al., 1998; Chen et al., 2010). У нашому дослідженні клінічно значущі концентрації резистину суттєво знизили рівень мРНК eNOS, рівень білка та активності, а також знизили стабільність іРНК eNOS та рівні клітинного NO. Клітинні рівні активних форм кисню (АФК), включаючи супероксидний аніон, значно підвищувались в оброблених резистином HCAEC, тоді як потенціал мітохондріальної мембрани та активність каталази та супероксиддисмутази були зменшені порівняно з необробленими клітинами. Антиоксиданти ефективно блокують знижену регуляцію eNOS, спричинену резистином.
Недавнє дослідження впливу резистину на судинну функцію та інсулінову вазорелаксацію показало, що введення резистину молодим і старим мишам C57BL/6 та культивованим ендотеліальним клітинам суттєво погіршує дозозалежне інсулінову вазодилатацію за рахунок зменшення ферментативної активності eNOS як in vivo та in vitro (Gentile et al., 2008). Раніше було показано, що інсулін індукує розширення судин за допомогою вивільнення NO, опосередкованого eNOS (Zeng and Quon, 1996). Ефекти резистину в цьому дослідженні були специфічними для інсуліну на судинну дію, оскільки розширення судин, викликане збільшенням доз ацетилхоліну або нітрогліцерину, не впливало на резистин (Gentile et al., 2008). Крім того, було встановлено, що резистин порушує викликане інсуліном AKT та фосфорилювання eNOS в клітинах ендотелію та субстрат-1 рецептора інсуліну-1 фосфорилювання тирозину/серину, згодом змінюючи його взаємодію з PI3K і тим самим перериваючи провазорелаксантний шлях. Ці колективні дослідження демонструють, що резистин змінює коронарні вазомоторні функції як in vivo, так і in vitro. Потрібні додаткові дослідження для більш чіткого визначення ролей та шляхів, завдяки яким резистин впливає на коронарну фізіологію та формування судинних захворювань.
Резистин і тромбоз
Тромбоз виникає, коли згусток утворюється всередині кровоносної судини, перешкоджаючи потоку крові через кровоносну систему. Це може статися, коли кровоносна судина травмована, що призводить до набору тромбоцитів та фібрину до місця пошкодження, які утворюють тромб для запобігання втрати крові. Збільшення доказів свідчить про центральну роль тромбозу в прогресуванні та ускладненнях атеросклерозу, і тромбоз пов’язаний із клінічним виникненням ГКС (Libby and Aikawa, 2002; Libby et al., 2002). Ряд експериментальних та клінічних досліджень вказує на те, що тканинний фактор (ТФ) відіграє ключову роль у патофізіології ГКС, викликаючи утворення внутрішньокоронарних тромбів після пошкодження ендотелію (Wilcox et al., 1989; Pawashe et al., 1994; Annex et al., 1995; Ragni et al., 1996). Кілька досліджень показали, що резистин може посилити утворення тромбу під час утворення атеросклеротичних бляшок. Наприклад, було показано, що обробка HCAEC резистином викликає регуляцію експресії TF, яка, як видається, опосередковується безкисневими радикалами та активацією фактора транскрипції NFκB, сприяючи тим самим протромботичному стану (Calabro et al. ., 2011).
Хоча в даний час немає прямих доказів ролі резистину в утворенні тромбу, резистин може брати участь у тромбозі завдяки своїй регуляції ферменту eNOS. eNOS конститутивно генерує NO в ендотелії шляхом його перетворення L-аргініну з утворенням L-цитруліну та NO. Сигнальна молекула NO розслаблює VSMC, тим самим контролюючи тонус судин. NO також брав участь у агрегації та адгезії тромбоцитів in vitro; тим часом, роль NO та трьох інших ферментів NOS (eNOS, iNOS та nNOS) все ще досліджується in vivo. Мур та співавт. (2011, 2010) досліджували роль eNOS у мишей і виявили, що ендогенний NO, отриманий eNOS, відіграє вирішальну роль у регуляції функції тромбоцитів in vivo. Автори виявили, що eNOS відіграє значну роль в агрегації тромбоцитів, тоді як iNOS і nNOS, схоже, відіграють мінімальну роль у цьому процесі. Тому регулятори eNOS вгору та вниз, такі як резистин, можуть представляти важливу мішень для антитромботичних ефектів; це потрібно додатково оцінити за допомогою відповідних експериментальних моделей. Оскільки все більше доказів вказує на те, що резистин бере участь у патогенезі атеросклерозу, роль резистину в тромбозі заслуговує на подальше дослідження.
Резистин та ангіогенез
Досліджено також вплив мишачого резистину на ангіогенез; ефекти резистину на ангіогенез можуть бути опосередковані TNF-α-подібним слабким індуктором апоптозу (TWEAK), рівень якого виявлено значно підвищеним у клітин ендотеліоми миші b.End5 після лікування резистином. Тим часом було встановлено, що нейтралізація TWEAK блокує опосередковану резистином проліферацію та міграцію клітин (Robertson et al., 2009b). Розчинний білок TWEAK виявляє прозапальну та ангіогенну реакції і, як було встановлено, сприяє формуванню кровоносних судин в аналізі на ангіогенез рогівки щурів; також виявлено, що експресія TWEAK та його специфічного рецептора, Fn14 (FGF-індуковані рецептори молекули 14) регулюється при хронічних пошкодженнях тканин та захворюваннях, включаючи ревматоїдний артрит (RA) та церебральну ішемію (Burkly et al., 2007). Відповідно, Робертсон та ін. дійшов висновку, що регульована експресія TWEAK може сприяти посиленню запалення та ангіогенезу під час формування атероми (2009b).
Механізми збільшення миграції та проростання клітин ендотелію, спричиненого мишачим резистином, визначають залучення фосфорилювання PI3K/AKT та NKκB на основі скасування ангіогенних властивостей клітин, оброблених резистином, після специфічного інгібування цих медіаторів. Встановлено, що шлях Akt/I-ββ-кінази сприяє ангіогенній та метастатичній експресії генів при раку прямої кишки шляхом активації NFκB та β-катеніну (Agarwal et al., 2005). Тим часом PI3K/Akt індукує активацію NFκB та продукцію VEGF у клітинах мишачого епітелію (Li et al., 2005). Таким чином, мишачий резистин може впливати на ангіогенез і сприяти розвитку ракових метастазів. Тим часом посилення ангіогенезу інтенсивно досліджувалося як можливий терапевтичний засіб при лікуванні ішемічної хвороби серця, навіть якщо ангіогенез та неоваскуляризація інтими пропонуються як проатеросклеротичні події (Carmeliet, 2005; Khurana et al., 2005); отже, важливо додатково з’ясувати роль резистину в ангіогенезі в цих умовах. Хоча все більше доказів свідчать про те, що резистин відіграє певну роль у сприянні утворенню ССЗ, можливо, дослідження його ролі в ангіогенезі може надати корисну клінічну інформацію для лікування ішемічної хвороби серця.
Функція резистину та гладком’язових клітин судин
Судинні клітини гладкої мускулатури утворюють шари в стінці судини і контролюють кровотік, скорочуючись або розслабляючись у відповідь на зовнішні подразники. VSMC не розмножуються в нормальних фізіологічних умовах. Однак у відповідь на пошкодження або запальні подразники VSMC починають рости і ділитися. Порушення розповсюдження VSMC може призвести до патологічних змін у стінках судин (Boettger et al., 2009). Дійсно, було встановлено, що резистин індукує проліферацію гладком'язових клітин аорти людини залежно від дози, і це, мабуть, опосередковується шляхами передачі сигналів ERK1/2 та Akt (Calabro et al., 2004).
Резистин також сприяє міграції VSMC (Jung et al., 2006; Jiang et al., 2009). Показано, що гомоцистеїн накопичується в жировій тканині та індукує експресію резистину (Li et al., 2008). Нещодавно було продемонстровано, що індукована гомоцистеїном експресія резистину стимулює міграцію VSMC в культурі адипоцит – VSMC; невелика заважаюча РНК (siRNA) проти резистину значно послаблює міграцію VSMC в системі. Здавалося, міграція VSMC опосередкована індукованими резистином цитоскелетними змінами та активацією α5β1-інтегрину через α5β1-інтегрин-фокальну адгезію-кіназу/пов'язаний з паксиліном-Ras C3 субстрат ботулотоксину 1 (Jiang et al., 2009). Посилення проліферації та міграції VSMC, що здійснюється резистином, надає додаткові докази взаємодії між цим адипокіном і судинними клітинами, і це може представляти важливий фактор патологічних змін судин.
Терапевтичні міркування
Резистин є прозапальним цитокіном, і його дія опосередковується TNF-α (Silswal et al., 2005). Отже, ефект лікування анти-ФНО-α досліджували у пацієнтів із РА, хронічним запальним захворюванням. Введення інфліксимабу, моноклонального антитіла проти TNF-α, призвело до значного зниження рівня резистину в сироватці крові у пацієнтів з РА (Gonzalez-Gay et al., 2008).
Продукти, збагачені фолієвою кислотою, використовувались для зниження рівня гомоцистеїну в плазмі крові, а гіпергомоцистеїнемія є добре відомим фактором ризику ССЗ. Таким чином, вплив споживання фолієвої кислоти на сироватковий рівень резистину та здоров'я ендотелію вивчали на мишачій моделі. Високі дози споживання фолієвої кислоти (71 мкг · кг -1) спричинили значне зниження рівня резистину у хворих на ожиріння діабетичних мишей (Seto et al., 2010). Тим часом було показано, що олеїнова кислота, переважна мононенасичена жирна кислота оливкової олії, зменшує експресію гена резистину в ізольованих адипоцитах (Rea і Donnelly, 2006).
Терапія, спрямована на зниження рівня резистину в сироватці крові, є перспективною стратегією клінічного перекладу наших знань про роль резистину у формуванні захворювань. Зокрема, якщо підтверджено, що резистин відіграє ключову роль у чутливості до інсуліну, цукровому діабеті, MetS, різних формах ССЗ, тромбозах та дисфункції ендотеліальних клітин та макрофагів, резистин може стати корисною терапевтичною мішенню для ССЗ. На додаток до протизапальних засобів та статинів, нові лікарські засоби, спеціально націлені на резистин, можуть включати антисмислові олігонуклеотиди, антитіла та дрібномолекулярні інгібітори. Крім того, якщо індуковані резистином сигнальні шляхи чітко намічені, можна оцінити додаткові цілі резистину нижче за течією на предмет пригнічення через розробку лікарських засобів. Очевидно, що це захоплююче поле для подальшого вивчення та перекладу основних наукових відкриттів на клінічне застосування.
Резюме
- Дослідження показують, що ожиріння та надмірна вага ведуть до передчасної смертності від серцево-судинних захворювань
- Ожиріння як етіологія хвороби, лікування та міркування щодо лікування ожиріння у пацієнта -
- Взаємозв'язок факторів ризику захворювання вісцерального жиру та серцево-судинних захворювань Танно та Собецу
- Відповіді на опитування лікаря загальної практики щодо сучасних суперечок щодо дієти та серцево-судинних захворювань
- Безалкогольні напої, аспартам та ризик раку та серцево-судинних захворювань