Фолієва кислота запобігає серцевій дисфункції та зменшує фіброз міокарда на мишачій моделі ожиріння, спричиненого дієтою
Анотація
Передумови
Фолієва кислота (ФА) є антиоксидантом, який може зменшити утворення активних форм кисню і може притупити серцеву дисфункцію під час ішемії. Ми висунули гіпотезу, що добавки FA запобігають серцевому фіброзу та серцевій дисфункції, спричиненій ожирінням.
Методи
Шеститижневих мишей C57BL6/J годували протягом 14 тижнів дієтою з високим вмістом жиру (HFD), нормальною дієтою (ND) або HFD з фолієвою кислотою (FAD). Функцію серця вимірювали за допомогою трансторакального ехокардіографічного обстеження. Фенотиповий аналіз включав вимірювання маси тіла та серця, вмісту глюкози та гомоцистеїну (Hcy) у крові та стану окисного стресу в серці.
Результати
Споживання HFD підвищило рівень глюкози в крові натще і спричинило ожиріння та збільшення серця. Добавки FA у мишей, що годували HFD, призводили до зниження рівня глюкози в крові натще, ваги серця та вмісту Hcy у тканинах серця. Ми також спостерігали значну серцеву систолічну дисфункцію, коли мишей піддавали годуванню HFD, на що вказує зменшення фракції викиду лівого шлуночка та дробове вкорочення. Однак лікування FAD покращило серцеву функцію. Добавки FA захищені від серцевого фіброзу, індукованого HFD. Крім того, HFD підвищував концентрацію малонового диальдегіду в серцевій тканині та знижував рівень антиоксидантного ферменту, глутатіону та каталази. Споживання HFD викликало окислювальний стрес міокарда з покращенням шляхом лікування FA.
Висновок
Добавки FA суттєво знижують рівень глюкози в крові та вміст Hcy у тканинах серця і зворотну серцеву дисфункцію, спричинену HFD у мишей. Ці функціональні вдосконалення серця можуть бути опосередкованими пом’якшенням окисного стресу та фіброзу міокарда.
Передумови
Поширеність ожиріння швидко зростає у всьому світі [1, 2]. Ожиріння розглядається як розлад енергетичного балансу з невідповідним розширенням та дисфункцією жирової тканини. Ожиріння спричинює поширеність діабету 2 типу та серцево-судинних захворювань, які спричиняють гіпертрофію лівого шлуночка (ЛШ), інсульт та серцеву недостатність [3, 4]. Більше того, накопичені дослідження продемонстрували, що ожиріння впливає на реконструкцію серця зі структурними та функціональними відхиленнями [5, 6]. Однак основні механізми, що сприяють цим змінам, залишаються незрозумілими через складну взаємодію гемодинамічних, нейроендокринних та метаболічних факторів, що спричиняють гіпертрофію серця, клітинний апоптоз та інтерстиціальний фіброз [7].
Вважається, що окислювальний стрес та запалення беруть участь у патогенезі та прогресуванні багатьох форм серцево-судинних захворювань [8, 9]. Кілька досліджень показали, що окислювальний стрес відіграє ключову роль у розвитку індукованої ожирінням кардіоміопатії [10, 11]. Гіперглікемія, пов’язана з ожирінням, та порушення метаболізму спричиняють вироблення активних форм кисню (АФК) у судинних клітинах та кардіоміоцитах [12]. Під час інсулінорезистентності до початку діабету накопичення АФК можна виявити в тканинах серця [13], що сприяє серцевій дисфункції завдяки перекисному окисленню ліпідів, ремоделюванню позаклітинного матриксу, пошкодженню мітохондрій та змінам сполучних білків [14]. Крім того, серцевий фіброз та запалення покращуються шляхом лікування антиоксидантами в діабеті серця [15, 16]. Терапії, спрямовані на зменшення окисного стресу та посилення антиоксидантного захисту, застосовуються для запобігання серцевій дисфункції при серцево-судинних захворюваннях [17].
Фолієва кислота (ФА) - це вітамін групи В (вітамін В9), який полегшує перенесення 1-вуглецевих одиниць у декількох біосинтетичних реакціях для двох основних клітинних функцій, а саме метилювання ДНК та внеску формильних одиниць у синтез нуклеотидів [18]. Мета-аналіз рандомізованих контрольованих досліджень показав, що добавки ФА можуть зменшити ризик серцево-судинних захворювань [19]. Антиоксидантна активність бере участь у цих впливах ФА на серцево-судинні розлади [20]. Попередні дослідження повідомляли, що попередня обробка ФА притуплює дисфункцію міокарда під час ішемії та покращує реперфузійну травму та поєднує збереження високоенергетичних фосфатів, зменшення генерації АФК та загибель клітин при ішемії та реперфузії [21].
Гіпергомоцистеїнемія пов’язана з високим ризиком серцево-судинних захворювань, а збагачення дієти фолієвою кислотою знижує рівень Hcy у плазмі [22]. Інтерес до ФА для лікування серцево-судинних захворювань походить від його вирішальної ролі у перетворенні Hcy в метіонін [23]. ФА виявляє антиоксидантну дію проти АФК та пом'якшує гіпергомоцистеїнемію та пов'язану з нею дисфункцію ендотелію. Більше того, протизапальний ефект ФА проявляється зниженням рівня деяких медіаторів запалення у осіб із надмірною вагою, що свідчить про потенційну терапевтичну роль ФА у захисті від серцево-судинних захворювань [24]. Хоча добавки FA впливають на окислювальний стрес, запалення та метаболізм Hcy, прямий вплив FA на кардіоміопатію, пов’язану з ожирінням, ще не вивчено.
У цьому дослідженні ми висунули гіпотезу, що добавки FA у індукованих HFD мишей з ожирінням запобігають розвитку серцевої дисфункції, зменшуючи оксидантний стрес, запалення та пов'язаний з цим фіброз міокарда. Для перевірки цієї гіпотези мишей годували HFD протягом 14 тижнів у присутності або відсутності добавок FA. Згодом у мишей вимірювали збільшення ваги, рівень глюкози в крові, серцеву функцію та гістологію серця.
Методи
Тварини та експериментальний дизайн
Самців мишей C57BL/6J віком шість тижнів отримували від компанії Beijing HFK Bioscience Co. Ltd. (Пекін, Китай) і розміщували в кімнаті з контрольованою температурою (23 ± 2 ° C) з 12-годинним циклом світло-темрява. Мишам забезпечувався вільний доступ до їжі та води. Тварин випадковим чином розподіляли до нормальної дієти (ND приблизно 10% енергії у вигляді жиру) або дієти з високим вмістом жиру (HFD приблизно 60% енергії як жиру) або HFD, доповненої фолієвою кислотою (FAD, 20 мкг/мл, Sigma). питної води протягом 14 тижнів. У поточному дослідженні використана доза додаткового FA, яка в п’ять разів перевищує базові харчові потреби мишей [25]. Вагу тіла вимірювали щотижня. Для тестування толерантності до глюкози натще мишей голодували протягом ночі, а потім відбирали венозну кров за допомогою відсікання хвоста. Рівні глюкози в крові вимірювали за допомогою глюкометрів Accu-Chek (Roche Applied Science, Пенцберг, Німеччина). Серцеву функцію, морфологію, біохімічні показники, перекисне окислення ліпідів міокарда та профілі окисного стресу оцінювали, коли вони досягли 20-тижневого віку. Всі проведені процедури були узгоджені з Комітетом з догляду та використання тварин при Столичному інституті педіатрії (CIP 2016032).
Аналіз тканин серця
Тканини серця гомогенізували у 50 ммоль/л фосфатному буфері (рН 7,2), що містить 0,1 ммоль/л етилендіамінтетраоцтової кислоти, і центрифугували при 5000 ×g протягом 10 хв для подальшого тесту. Супернатант гомогенатів тканин серця збирали для аналізу FA та Hcy. Вимірювання проводили за допомогою набору для імуноферментного аналізу (ELISA) FA та Hcy (Cusabio, Wuhan, China) відповідно до інструкцій виробника.
Ехокардіографічне дослідження
Після 14 тижнів годування всіх тварин зважували та оцінювали за допомогою трансторакального ехокардіографічного дослідження. Всі вимірювання проводив технік, засліплений експериментами. Мишей знеболювали та аналізували за допомогою специфічного для тварин інструменту (VisualSonics Vevo770®, Visual Sonics Inc., Торонто, Канада) [26]. Кінцеві діастолічні та кінцево-систолічні діаметри ЛШ та товщина стінки були отримані шляхом відстеження М-режиму на основі вимірювань, усереднених за шість окремих циклів. Вимірювали такі структурні змінні: внутрішній діаметр лівого шлуночка у кінцевій діастолі (LVIDd) та кінцевій систолі (LVIDs) та товщину задньої стінки LV у діастоли та систоли. Систолічну функцію оцінювали на основі дробового вкорочення ЛШ та фракції викиду ЛШ.
Гістологічний аналіз
Після ехокардіографічного аналізу мишей евтаназували. Тканину серця також розтинали, відокремлювали і зважували. Поперечні зрізи ЛШ фіксували у 10% нейтральному забуференному формаліні та парафіні. Потім парафінові зрізи товщиною п’ять мікрон фарбували гематоксиліном та еозином (ВІН). Трихром Массона використовувався для виявлення відкладення колагену в тканині серця. Ступінь ураження серця досліджували наосліп, використовуючи світловий мікроскоп Leica DMRB/E (Leica Microsystems, Heerbrugg, Швейцарія). Серцевий м’яз і гладкі м’язи судин були забарвлені в рожевий колір, тоді як колаген - у синій колір.
Аналіз окисного стресу
Тканину серця використовували для оцінки активності антиоксидантних ферментів, супероксиддисмутази (SOD) та каталази (CAT), клітинного вмісту антиоксиданту глутатіону (GSH) та перекисного окислення ліпідів [малоновий діальдегід (MDA)]. Рівні вмісту ферментів SOD, CAT та GSH вимірювали за допомогою комерційного набору для аналізу (Beyotime Biotechnology, Пекін, Китай) відповідно до інструкцій виробника. Вміст білка визначали методами біцинхонінової кислоти з використанням комерційного набору (Solarbio, Пекін, Китай). Активність ферментів нормалізувалася до концентрації білка у зразках.
Статистичний аналіз
Усі набори даних представлені як середнє значення ± стандартна помилка середнього значення (SEM). Порівняння між двома групами проводили за допомогою неспареного двохвостого Стьюдента т-тест за допомогою програм Prism 6.0 GraphPad (GraphPad, Сан-Дієго, Каліфорнія, США). Значення стор 0,05 вважається статистично значущим.
Результати
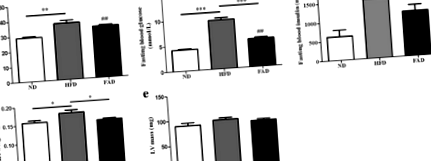
FA зменшував рівень глюкози в крові та запобігав збільшенню серця у мишей з HFD
Добавки FA зворотне підвищення Hcy, індуковане HFD
Дефіцит FA у сироватці крові був пов’язаний із ризиком серцево-судинних захворювань [27]. Тому ми використовували концентрації FA в тканинах як показник донорів метилу в екстрактах тканин серця. Ніякої різниці в рівнях FA між мишами ND та HFD не спостерігалося. Однак рівні ТК тканин були значно вищими у групі FAD порівняно з групами HFD (рис. 2а, стор ˂ 0,05). Ми вимірювали рівні Hcy тканин серця, оскільки FA збільшує рівень 5-метилентетрагідрофолатних редуктів, спричинюючи збільшення метаболізму Hcy [23]. Харчування HFD значно збільшило концентрацію Hcy у тканині серця (рис. 2b, стор ˂ 0,001). Цікаво, що ми виявили, що добавки FA знижували рівень Hcy у тканині серця мишей HFD, але не було значних відмінностей у рівнях Hcy між мишами FAD та ND (рис. 2b, стор ˂ 0,05).
Індукована HFD серцева дисфункція була покращена за допомогою лікування FA
Використовуючи 2-D М-режим ультрасонографії/ехокардіографії, ми спостерігали розвиток дилатації серця у мишей, яких годували HFD протягом 14 тижнів, як визначали LVIDd. LVIDs був значно високим у групах HFD. Значення LVID значно зменшувались у мишей, які отримували лікування FA, але не назад у мишей ND (рис. 3а та b, стор ˂ 0,05). Ми також спостерігали значну серцеву систолічну дисфункцію, коли мишей піддавали годуванню HFD, на що вказує зменшення фракції викиду ЛШ та дробове вкорочення (рис. 3в і d, стор ˂ 0,01). Миші HFD продемонстрували, що помітна і значна дилатація серця та систолічна дисфункція порівняно з мишами ND. Хоча ці зміни були полегшені лікуванням FA, миші FAD не змогли повернутися до нормального рівня (рис. 3c і d). Індукована ожирінням дилатація серця та серцева дисфункція покращувались у мишей, які отримували ФА (рис. 3в та d)., стор Рис.3
Добавки FA покращували фіброз міокарда, індукований HFD
Для подальшого вивчення кардіопротекторних ефектів добавок ФА ми вивчили ефекти ФА на морфологію серця. Фарбування ВІН показало, що в серцях мишей, що годувались HFD, спостерігалися структурні відхилення та значно збільшувалась жирова дегенерація кардіоміоцитів, тоді як ці чергування мишей, що годували HFD, полегшували лікуванням FA (рис. 4а). Однак явних змін запалення серед трьох груп не спостерігалося. Подальше фарбування трихромом Массона виявило значне збільшення накопичення колагену та фіброзу в серцях мишей, яких годували HFD. Лікування ФА помітно знижувало ступінь відкладення колагену та фіброзу (рис. 4б).
Гістологія серця після фарбування ВІН (a) і трихромне фарбування Массона (b) розділів з кожної групи (початкове збільшення 200 ×, n = 5). НД, нормальне харчування; HFD, дієта з високим вмістом жиру; FAD, HFD, доповнений FA; чорна стрілка, жирова дистрофія; сіра стрілка, накопичення колагену
Лікування FA послаблювало окислювальний стрес міокарда у мишей, що годували HFD
Оксидативний стрес пов’язаний із серцевою дисфункцією на моделях кардіоміопатії, пов’язаної з ожирінням [10]. Для оцінки ролі ФА в окисному стресі визначали окисно-відновний стан серця відповідних біомаркерів. Аналіз перекисного окислення ліпідів за допомогою MDA в міокарді виявив значне збільшення групи HFD. Добавки FA суттєво знизили рівні MDA порівняно з групою HFD (рис. 5а, стор ˂ 0,05). Крім того, споживання HFD, очевидно, спричинило окислювальний стрес у тканині серця, про що свідчить суттєво зниження найважливіших антиоксидантних ферментів GSH та CAT (рис. 5b та c), стор Рис.5
Обговорення
Метою цього дослідження було оцінити вплив добавок ФА на серце мишей із ожирінням, спричиненим HFD, та роль окисного стресу в цьому сценарії. У поточному дослідженні миші, яких годували HFD, демонстрували більший приріст ваги порівняно з мишами ND. Рівні глюкози та інсуліну були значно вищими у групі із СНВ, що свідчить про резистентність до інсуліну та відповідає розвитку діабету 2 типу. Добавки FA зменшували рівень глюкози в крові натще і покращували резистентність до інсуліну. Крім того, ми продемонстрували, що доповнення FA покращує серцеву дисфункцію у індукованих HFD мишей із ожирінням. Цей результат супроводжувався зниженням серцевого окисного стресу, фіброзу та вмісту Hcy в тканинах.
HFD пов’язаний із збільшенням ожиріння та серцевими захворюваннями, особливо систолічною дисфункцією, що характеризує раннє ожиріння/метаболічну кардіоміопатію [28]. Попередні експериментальні дані повідомляли про зв'язок між ожирінням та морфологічними та функціональними змінами в серцях людей та тварин [29,30,31]. Серцево-судинні ускладнення при ожирінні та резистентності до інсуліну часто проявляються як зменшення дробового вкорочення та порушення функції кардіоміоцитів [32]. У цьому дослідженні годування HFD індукувало значну серцеву систолічну дисфункцію, що супроводжувалося суттєвим збільшенням LVIDd та LVID. Однак добавки FA покращували фракційне вкорочення LV та фракцію викиду LV у мишей HFD. Цей висновок вказує на те, що FAD запобігає серцевій дисфункції, пов’язаній із ожирінням, у мишей з HFD.
Багато шляхів були залучені до патології серцевої дисфункції, пов’язаної з ожирінням, включаючи фіброз ЛШ, підвищений оксидантний стрес, запалення та зміни вмісту колагену [33]. Дослідження неодноразово показували, що окислювальний стрес та фіброз міокарда пов’язані з порушенням серцевої систолічної функції на мишачих моделях ожиріння та резистентності до інсуліну [34, 35]. Крім того, посилене окислення жирних кислот призводить до перевиробництва АФК [36], побічного продукту перекисного окислення ліпідів, який відіграє важливу роль у підвищенні окисного стресу, а також зменшує енергію для функції міокарда [37]. Оксидативний стрес викликає кілька шкідливих серцевих змін, включаючи дисфункцію мітохондрій, пошкодження ДНК, активацію металопротеїнази, клітинну дисфункцію, фіброз міокарда та гіпертрофію серця [38].
Висновки
Це дослідження демонструє, що добавка з FA суттєво знижує рівень глюкози в крові, зменшує вміст Hcy у серцевій тканині та захищає від серцевої дисфункції, пов'язаної з ожирінням, індукованої HFD у мишей. Морфологічні та функціональні поліпшення роботи серця можуть бути опосередкованими зменшенням перекисного окислення ліпідів та фіброзу міокарда. Ці спостереження свідчать про те, що добавки ФА інгібують окислювальний стрес, і, отже, можуть служити потенційним підходом для запобігання ожиріння, пов’язаної з кардіоміопатією.
- Анемія з дефіцитом фолієвої кислоти HealthLink BC
- Розробка нової моделі запору миші
- Симптоми дефіциту фолієвої кислоти, дієта; Лікування Повсякденне здоров'я
- Укріплення борошна кукурудзяної маси фолієвою кислотою в США
- DailyMed - ГЕМАТОГЕН FA- фумарат заліза, аскорбінова кислота, фолієва кислота, капсула ціанокобаламіну