Розробка нової моделі запору миші
Листування: Бін Сю, доктор філософії, професор, ключова лабораторія інтегрованої акупунктури та наркотиків, підключена до Міністерства освіти Китаю, Нанкінський університет китайської медицини, № 138 Сіаньлінь-роуд, Нанкін 210023, провінція Цзянсу, Китай. moc.anis@xuuuux
Телефон: + 86-25-86798095 Факс: + 86-25-86798095
Анотація
ЦІЛЬ: Створити нову модель запору миші.
МЕТОДИ: Тварин випадковим чином розподіляли на три групи і внутрішньошлунково вводили фізіологічний розчин 0-4 ° C (крижано-холодна група) або фізіологічний розчин 15-20 ° C (контрольна група з фізіологічним розчином) щодня протягом 14 днів, або залишали без лікування (пуста контрольна група ). Випорожнення збирали через 3–24 год після обробки для реєстрації вологого та сухого ваги та форми стільця. Проводили експерименти з кишковим рухом та вимірювали час дефекації протягом шести днів безперервно після призупинення лікування. Вирази PGP9.5 були виявлені за допомогою імуногістохімії.
РЕЗУЛЬТАТИ: На основі відсотка змін ваги стільця порівняно з вихідним рівнем (до подразнення) за 9-14 днів, зміни ваги стільця класифікували на три рівні. Кожен рівень показує різний стан тіла, це стан I (без змін: плюс-мінус 5%), стан II (трохи знижений: 5% -15%) та стан III (знижений: 15% -25%). У стані III, між 9-14 днем, вага стільця зменшився на 15% -25% порівняно з початковим рівнем і змінювався зі швидкістю> 10% порівняно з порожнім контрольним значенням, і стілець став маленьким і сухим. Крім того, функції кишечника дегенерували у цих тварин, а позитивна експресія PGP9.5 помітно знизилася в товстій кишці, клубовій кишці та мінтеріальному сплетенні товстої кишки.
ВИСНОВОК: Роздратування крижаним сольовим розчином є стабільним, повторюваним методом побудови моделі запору у мишей для вивчення патогенезу та способів лікування запору, а зміна маси та розміру стільця може слугувати корисним інструментом для оцінки успіху моделі запору чи ні.
Основна порада: Встановлення стабільних моделей тварин є дуже важливим для вивчення патогенезу захворювання для розробки стратегій профілактики та лікування. Дані попередніх досліджень показали, що періодичне та хронічне подразнення шлунку холодною водою може стримувати перистальтику шлунково-кишкового тракту. У цьому дослідженні ми дійшли висновку, що подразнення крижаним сольовим розчином мишей є стабільним, повторюваним методом побудови моделі запорів мишей.
ВСТУП
Запор, що супроводжує різні захворювання, є симптомом основних дефектів або транзиту фекальної маси через кишечник, або дефекації, часто діагностованого функціонального шлунково-кишкового розладу. Зазвичай він асоціюється з порушеннями моторики шлунково-кишкового тракту, що характеризується низкою складних шлунково-кишкових симптомів за відсутності механічної обструкції шлунково-кишкового тракту. Загальновизнано, що порушення моторики шлунково-кишкового тракту та вісцеральна парестезія становлять головну патологічну та фізіологічну основу дисфункції шлунково-кишкового тракту [1-3]. Враховуючи мізерність наявних клінічних даних, тваринні моделі повинні вивчати патогенез запору та розробляти стратегії профілактики та лікування, а також існує потреба в розробці оптимізованих моделей [4].
За останні кілька років було використано багато підходів для запорів у експериментальних тварин in vivo. Однак більша частина роботи була проведена на щурах. У порівнянні з щурами миші мають меншу толерантність і не можуть вводити тривалі подразнюючі препарати. Дослідження на мишах дають безліч переваг, включаючи економічну ефективність та наявність більшої кількості чистопородних або генетично маніпульованих (трансгенних та нокаутних) штамів. Більше того, анатомічні особливості мишей та розвиток ембріонів подібні до характеристик людей, а геноми також демонструють високий ступінь гомології [5]. Моделі мишей пропонують більшу універсальність для вивчення людських генних функцій та патогенезу захворювання, ніж моделі щурів. Отже, у цьому дослідженні ми прагнули створити стабільну модель запору у мишей, вивчити патогенез запору та вивчити кращі варіанти лікування.
МАТЕРІАЛИ І МЕТОДИ
Тварини
Мишей C57BL/6J (клас SPF, 3-тижневий самець, 20-25 г) було придбано в Модельному дослідницькому центрі тварин Нанкінського університету (Нанкін, Китай, номер ліцензії: SCXK 2013-0005). Їжа та вода були доступні за бажанням, а тварини утримувались у контрольованих умовах навколишнього середовища. Всі експериментальні маніпуляції проводились відповідно до Принципів догляду за лабораторними тваринами та Посібника з догляду та використання лабораторних тварин, опублікованого Національною науковою радою, Китай.
Групи та процедури
Мишей випадковим чином розділили на три групи: групу, оброблену сольовим розчином 0-4 ° C (крижана група, n = 30), нормальну грудну групу (пустий контроль, n = 10) та 15-20 ° C група, оброблена фізіологічним розчином (контроль сольовим розчином, n = 10), довільно пронумерована та вирощена в окремих клітках, що дозволяло нормальний доступ до їжі та води. Для полегшення відділення та збору табуретів використовували дротяну сітку. Для усунення впливу біологічних ритмів внутрішньошлункові введення проводили о 8:00 ранку один раз на день протягом 14 днів. Мишам у крижаних і сольових контрольних групах спочатку вводили або крижаний, або сольовий розчин кімнатної температури, відповідно, у дозі 0,2 мл/мишу, а потім доза збільшувалась на 0,05 мл/миші кожні 5 днів. Пустих мишей контрольної групи вирощували нормально без внутрішньошлункового введення. Зазвичай тварин вирощували та спостерігали протягом додаткових 6 днів після припинення внутрішньошлункового введення.
Збір та огляд стільця
Протягом 3-24 год після внутрішньошлункового введення стілець збирали керамічними чашками. Після забору спостерігали зміни форми стільця (розмір гранул) та реєстрували перед зважуванням. Потім кожну керамічну чашку зважували для визначення ваги мокрого середовища за допомогою електронних ваг. Після сушіння в мікрохвильовій печі (середній вогонь) протягом 6 хв чашку знову зважували для визначення сухої маси.
Вимірювання функції кишечника
Підготовка тканин
Після закінчення 14-денного втручання зразки тонкої кишки (тонка і клубова кишки) та проксимальні зразки тканин товстої кишки (приблизно 1 см в довжину) видаляли через 12 годин голодування. Кожен сегмент розкривали вздовж брижової межі і двічі промивали сольовим розчином. Коли брижові тканини та вміст кишечника видаляли, сегменти негайно фіксували зануренням у 4% параформальдегіду на 24 години. Потім їх обробляли для вбудовування парафіну у вакуумі та різали товщиною 10 мкм.
Імуногістохімія
Зрізи депарафінізували в ксилолі та гідратували в градуйованому розчині етанолу. Активність ендогенної пероксидази блокували 3% перекисом водню. Після трьох промивань 0,01 моль/л забуференного фосфатом сольового розчину (PBS; рН 7,2) неспецифічне зв’язування блокували 5% бичачим сироватковим альбуміном (BSA) протягом 30 хв при 37 ° C. Первинні антитіла до PGP9,5 (1: 1000) наносили на зрізи, і кожен зразок інкубували у вологій камері протягом ночі при 4 ° C. Слайди тричі промивали в PBS і інкубували з хріном пероксидазою (HRP) -полімерним анти-мишачим/кролячим lgG протягом 90 хв при 37 ° C. Після триразового промивання в PBS локалізацію цільового білка візуалізували інкубацією зрізів протягом 5-10 хв у свіжоприготованому розчині 3,3-діамінобензидину (DAB). Скла знову промивали, фарбували гематоксиліном і зневоднювали. Специфічність антитіла підтверджена негативним контролем за відсутності первинного лікування антитілами. Два спостерігачі оцінювали слайди за допомогою оптичного мікроскопа Olympus FV500 (Olympus, Токіо, Японія). Позитивне імунофарбування оцінювали в 5 випадкових полях зору при збільшенні 400. Середню щільність позитивного вираження оцінювали за допомогою програмного забезпечення для аналізу зображень.
Матеріали та препарати
Матеріали, використані в цьому дослідженні, включали фізіологічний розчин (ін’єкція хлориду натрію; Nanjing Chemical Reagent Co, Цзянсу, Китай), таблетки домперидону (Xi'an Janssen Pharmaceutical Ltd, Сіань, Китай), дротяну сітку (для полегшення відділення та збору стільця ), прецизійні електронні ваги (Sartorius Co, Пекін, Китай), камедь акації (порошок гуміарабіки; BASF Chemical Co, Тяньцзінь, Китай), чорний та червоний вуглецевий порошок (кольоровий тонер; Sanheng Information Technology Co, Гуанчжоу, Китай), та керамічні чашки (стійкі до високих температур, радіус: 2 см, висота: 3,5 см). Первинні антитіла для імуногістохімії: PGP9.5 (Abcam, Кембридж, Великобританія), Вторинні антитіла: HRP-полімерний анти-миша/кролик (Boster Biotech, Ухань, Китай)
Червоні (чорні) вуглецеві суспензії готували наступним чином: камедь акації (100 г) додавали до 800 мл води і кип'ятили до прозорості. Потім вищевказаний розчин змішували з червоним (чорним) порошком вуглецю (50 г) і кип'ятили тричі. Після охолодження кожен розчин розбавляли водою до 1000 мл і зберігали при 4 ° C. Розчини перемішували перед використанням.
Статистичний аналіз
Таблиця 1
Ефективність різних груп після лікування
| Групи | Лікування | Ефективність (після лікування) |
| Крижано-холодна група | 0-4 ° C сольовий розчин | Держава I, держава II та держава III |
| Контроль сольового розчину | Сольовий розчин 15-20 ° C | Ніяких типів держав |
| Пустий контроль | Звичайне годування | Ніяких типів держав |
Під час послідовних експериментів із партіями ми могли спостерігати три різних стани тіла (I, II та III) у крижаних холодних мишей, в той час як таких змін у мишей не спостерігалось у групах C. У стані I мокрий і сухий ваги ваги, зафіксовані між d 9-14, змінювались на -5% до 5% порівняно з базовим рівнем і змінювались із швидкістю 10% порівняно з відповідними значеннями порожньої контрольної групи. У цьому стані різниця у вазі стільця між крижаною групою та пустими мишами контрольної групи була статистично значущою.
Зміни стільця у всіх групах
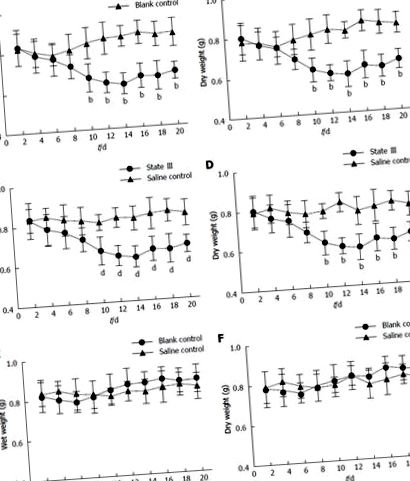
Після подразнення крижаним сольовим розчином ми могли спостерігати три різні стани (I, II та III), а симптоми запору спостерігались у стані III. Порівняно із порожньою контрольною групою (рис. (Рис. 1A 1A та B) та значеннями контрольної групи сольового розчину (рис. (Рис. 1C 1C та D), маса випорожнень у мишей III групи з холодною кригою в процесі експериментів зменшувалася, і нормальність була досягнута 6 d після припинення подразнення. Для порівняння, після подібної обробки фізіологічним розчином кімнатної температури (контрольна група з фізіологічним розчином), таких змін не спостерігалося, і маса калу мишей контрольної групи фізіологічного розчину не суттєво відрізнялася від відповідної контрольної групи значення (Рисунок (Рис. 1E 1E та F).
Зміни форм стільця. A: Брістольська шкала форми табурета; B: Вміст води у випорожненнях зростає і злипається, подібно до шкали Бристоля типу 5 або 6 мишей штату I; C: Деякі випорожнення прилипають до дротяної сітки, як і тип 6 або 7, що свідчить про легку діарею; D: Порівняння загальної довжини, оціненої для 25 пелет з калом (LS25).
Зображення табуретів з різних груп. У першому ряду в кожній групі табуретки були подібні до типу 3 або 4. З другого ряду табурети послідовно розташовувались у однаковій кількості (n = 25) поспіль. A: через 7 днів; B: через 14 днів; C: через d 16; D: через 20 д.
Вплив на функції тонкої кишки під час експериментів
Експерименти з руховим кишковим рухом показали, що відстані, на які рухався чорний вуглець, суттєво зменшувались у мишей стану III порівняно з групою контрольної групи в обох d 15 (47,03% ± 6,18% проти 61,94% ± 4,80%, Р = 0,0211, рис. 4A та B) та d 20 (56,11% ± 4,23% проти 63,73% ± 4,68%, P = 0,0379, малюнок Рисунок 4C 4C та D), і спостерігалося збільшення швидкості руху вуглецю в контрольній групі з сольовим розчином на d 15 порівняно з порожня контрольна група (71,18% ± 4,81% проти 61,94% ± 6,20%, Р = 0,0169). У подальших експериментах у мишей стану III, які застосовували попередню обробку суспензій домперидону, швидкість руху вуглецю була збільшена порівняно з мишами стану III без використання домперидону в обидва дні d 15 (65,22% ± 5,43% проти 44,52% ± 8,11%, P = 0,0051, рисунок Рисунок 4E 4E та F) та d 20 (63,14% ± 6,73% проти 52,12% ± 4,05%, P = 0,0196, рисунок 4E 4E та F), і не суттєво відрізнялися від значень порожньої контрольної групи.
Вимірювання часу, необхідного для дефекації першої гранули, що містить індикатор. В: Усі групи вимірювали через 15 днів; В: Усі групи вимірювали через 20 днів; C: стан III порівняно з тими, хто отримував домперидон та пусту контрольну групу на d15; D через 20 d (n = 5 для кожної групи), b P d P (малюнок 6A), 6A), клубова кишка (малюнок (малюнок 6D) 6D) та проксимальна кишка (рисунок (Figure6G) 6G) міентеріальне сплетення в порожньому контролі групи. Статистичний аналіз показав, після внутрішньошлункового введення крижаного сольового розчину, що середня щільність позитивної експресії PGP9,5 помітно знизилася в тодкій кишці (0,6185 ± 0,07 проти 0,4343 ± 0,09, P = 0,0092, малюнок 6B 6B і C), клубова кишка (0,9095 ± 0,07 проти 0,7685 ± 0,08, Р = 0,0166, рисунок 6E 6E та F) та проксимальна кишка (0,4925 ± 0,07 проти 0,3381 ± 0,04, P = 0,0019, малюнок 6H 6H та I) групи.
Вплив на загальну експресію білка PGP9.5 нейронів при імуногістохімічному фарбуванні. Тканина з коричневими зернистими відкладеннями була позитивною реакцією (як вказують стрілки; -: 50 мкм, збільшення × 400). А, Б: В тонку кишку; D, E: В клубовій кишці; G, H: У проксимальній кишці; C, F, I: Порівняння середньої щільності позитивної експресії PGP9,5 між двома групами. a P 10% порівняно зі значенням порожньої контрольної групи.
Мишей, які демонструють нижчу толерантність до наркотиків, не можна довго лікувати подразними препаратами. Однак збільшена доступність нокауту та трансгенних моделей шлунково-кишкових генів миші пропонує більші можливості для вивчення патогенезу та лікування запорів. Отже, ми дослідили створення моделі мишачих запорів і попередньо створили просту повторювану модель мишачих запорів. У цій безмедикаментозній моделі ми використовували подразнення крижаним сольовим розчином, щоб викликати запор. Примітно, що ми виявили, що миші у віці 3-4 тижні є найбільш підходящими, тому втручання слід проводити до дорослого віку, що означає, що ця модель не застосовується до кореляційного дослідження старечих запорів. Ця модель вимагала лише короткого циклу втручання (14 днів), і нормальність була досягнута через 6 днів після припинення подразнення, що є зручним та практичним методом, і дозволяє уникнути побічних ефектів через занадто сильне подразнення препаратом, і, отже, представляє привабливу модель для вивчення патогенез та патогенез, що лежать в основі запору, та вивчити варіанти лікування.
КОМЕНТАРИ
Передумови
Запор - це симптом основного захворювання, що впливає на моторику кишечника. Враховуючи мізерність наявних клінічних даних, необхідні моделі на тваринах, і існує потреба в розробці оптимізованих моделей. У існуючих моделях запорів більшість із них проводять на щурах. Отже, автори досліджували створення моделі мишачого запору та попередньо побудували просту повторювану модель мишачого запору.
Межі досліджень
Постійне подразнення шлунку холодною водою може стримувати моторику шлунково-кишкового тракту у щурів, що свідчить про те, що вживання холодної води є фактором ризику запорів. Однак мало зусиль було спробувано створити модель запору мишей з хронічним та періодичним подразненням холодною водою.
Інновації та прориви
Подразнення крижаним сольовим розчином мишей може спричинити дисфункцію шлунково-кишкового тракту. Було встановлено багато методів для оцінки функції кишечника, які демонструють здатність імітувати стан, заснований на симптомах людини. Цей спосіб зручний і практичний.
Програми
Він представляє привабливу модель і допомагає вивчити патогенез та патогенез, що лежать в основі запору, та вивчити варіанти лікування.
Експертна оцінка
Це дослідження охоплює цікаву тему. Це досить нове і додає до нашого канону знань про патофізіологію та терапевтичні можливості запору.
Виноски
За підтримки Національної ключової програми базових досліджень 973, № 2011CB505206; Національний фонд природничих наук Китаю, № 81202744 та № 81373749.
Заява комітету з огляду інституцій: Це дослідження було розглянуто та схвалено Інституційною комісією з огляду Нанкінського університету китайської медицини, Нанкін, Китай.
Заява інституційного комітету з догляду та використання тварин: усі експериментальні маніпуляції проводились відповідно до принципів лабораторного догляду за тваринами та Керівництва з догляду та використання лабораторних тварин, опублікованого Національною науковою радою, Китай; і дослідження було схвалено Інституційним комітетом з догляду та використання тварин при Нанкінському університеті китайської медицини.
Заява про конфлікт інтересів: Автори заявляють, що конфлікту інтересів, пов’язаних із цим дослідженням, не існує.
Заява про спільний доступ до даних: Немає додаткових неопублікованих даних.
Відкритий доступ: Ця стаття є статтею з відкритим доступом, яку обрав власний редактор і повністю рецензував зовнішні рецензенти. Він розповсюджується відповідно до ліцензії Creative Commons Attribution Non Commercial (CC BY-NC 4.0), яка дозволяє іншим розповсюджувати, реміксувати, адаптувати, ґрунтуватись на цій роботі некомерційно та ліцензувати їх похідні роботи на різних умовах, за умови, що оригінальний твір цитується належним чином, а використання є некомерційним. Див .: http://creativecommons.org/licenses/by-nc/4.0/
Рецензування розпочато: 20 вересня 2015 р
Перше рішення: 14 жовтня 2015 року
Стаття в пресі: 19 листопада 2015 р
P- Рецензент: De Ponti F, Jadallah KA, Pasalar M S- Редактор: Qi Y L- Редактор: Ma JY E- Редактор: Wang CH
- Фолієва кислота запобігає серцевій дисфункції та зменшує фіброз міокарда на мишачих моделях
- Розробка нової моделі ожиріння, спричиненого дієтою (DIO), використовуючи худих щурів Wistar
- Розробка та характеристика експериментальної моделі метаболічного синдрому, викликаного дієтою в Росії
- Вплив дієти з високим вмістом жиру на розвиток аденоми товстої кишки на тваринній моделі
- ФРАНЦУЗЬКА ДІЄТА GURU ВИДАЄ НОВІ ІДЕЇ ВІДМІНЕНОГО ВАГИ - Sun Sentinel