Мезенхімальні стовбурові клітини, виведені желем Уортона: фенотипова характеристика та оптимізація їх терапевтичного потенціалу для клінічного застосування
Те-Вон Кім
1 кафедра нейрохірургії, Інститут медичної науки Вонванга, Медична школа, Університет Вонванга, 344-2 Шиньон-дон, Іксан 570-749, Корея; Електронні листи: rk.ca.ukw@wdmik (D-W.K.); rk.ca.ukw@dsgnak (S-D.K.)
2 Центр передового досвіду для старіння та ремонту мозку, Департамент нейрохірургії та ремонту мозку, Медичний коледж Університету Південної Флориди, Тампа, FL 33612, США; Електронні листи: ude.fsu.liam@snahgaem (M.S.); ude.fsu.htlaeh@uzonihsk (К.С.); ude.fsu.liam@ehctnapp (P.P.)
Meaghan Staples
2 Центр передового досвіду для старіння та ремонту мозку, Департамент нейрохірургії та ремонту мозку, Медичний коледж Університету Південної Флориди, Тампа, FL 33612, США; Електронні листи: ude.fsu.liam@snahgaem (M.S.); ude.fsu.htlaeh@uzonihsk (К.С.); ude.fsu.liam@ehctnapp (P.P.)
Казутака Шинодзука
2 Центр передового досвіду для старіння та ремонту мозку, Департамент нейрохірургії та ремонту мозку, Медичний коледж Університету Південної Флориди, Тампа, FL 33612, США; Електронні листи: ude.fsu.liam@snahgaem (M.S.); ude.fsu.htlaeh@uzonihsk (К.С.); ude.fsu.liam@ehctnapp (P.P.)
Паоліна Панчева
2 Центр передового досвіду для старіння та ремонту мозку, Департамент нейрохірургії та ремонту мозку, Медичний коледж Університету Південної Флориди, Тампа, FL 33612, США; Електронні листи: ude.fsu.liam@snahgaem (M.S.); ude.fsu.htlaeh@uzonihsk (К.С.); ude.fsu.liam@ehctnapp (P.P.)
Сун-Дон Кан
1 Департамент нейрохірургії, Інститут медичної науки Вонванга, Медичний факультет, Університет Вонванга, 344-2 Шиньон-дон, Іксан 570-749, Корея; Електронні листи: rk.ca.ukw@wdmik (D-W.K.); rk.ca.ukw@dsgnak (S-D.K.)
Цезар В. Борлонган
2 Центр передового досвіду для старіння та ремонту мозку, Департамент нейрохірургії та ремонту мозку, Медичний коледж Університету Південної Флориди, Тампа, FL 33612, США; Електронні листи: ude.fsu.liam@snahgaem (M.S.); ude.fsu.htlaeh@uzonihsk (К.С.); ude.fsu.liam@ehctnapp (P.P.)
Анотація
1. Вступ
2. Анатомічний взаємозв’язок різних структур UC та WJ як джерела MSC
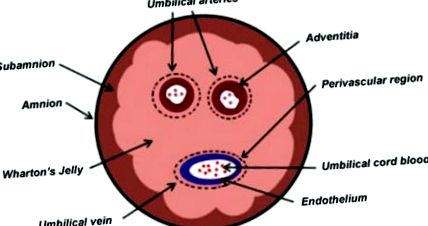
Під час вагітності плід і плацента з'єднані еластичним UC, який запобігає стисканню, перекручуванню та згинанню пуповинних судин, забезпечуючи при цьому хороший кровообіг. Анатомічно UC складається з двох пупкових артерій і однієї пупкової вени, обидві вбудовані в певний слизовий багатий протеогліканом матрикс, відомий як WJ, який потім покривається амніотичним епітелієм (Рисунок 1).
Діаграма поперечного перерізу пуповини людини показує анатомічні відділи, включаючи желе Уортона, як джерело стовбурових клітин.
WJ, що містить мультипотентну фібробластоподібну популяцію MSC, були вперше отримані більше 10 років тому [12]. Раніше WJ-MSC називали «стовбуровими клітинами матриці пуповини» (UCMSCs), щоб відрізнити їх від ендотеліальних клітин, виділених із пупкової вени (HUVEC), а також MSC, виділених із крові UC (UCB-MSC) [13,14].
Існує дві можливі теорії про те, як існували стовбурові клітини в WJ. По-перше, на початку розвитку людства існували дві хвилі міграції МСК плода. Під час цих хвиль міграції деякі МСК потрапили в пастку та мешкали у желатиновій зоні Южної Колумбії [15]. По-друге, клітини в WJ насправді є примітивними MSC, що походять від мезенхіми, які вже були там в матриці UC. Функція цих клітин може полягати в секреції різних глікопротеїнів, мукополісахаридів, глікозаміногліканів та білків позаклітинного матриксу з утворенням драглистої подрібненої речовини для запобігання задушенню судин UC під час гестації [16].
3. Характерні особливості WJ-MSC для клітинної терапії
3.1. Джерела стовбурових клітин
На сьогоднішній день у людини виділено різні типи стовбурових клітин з різних тканин, включаючи зародки перед імплантацією, плоди, пов’язані з народженням тканини та органи дорослих. На основі біохімічних та геномних маркерів їх можна широко класифікувати на ембріональні стовбурові клітини (ESC), мезенхімальні стовбурові клітини (MSC) та гемопоетичні стовбурові клітини (HPS).
ГСК мають обмежену пластичність, оскільки вони можуть диференціюватись лише на кров та пов’язані з кров’ю лінії. Крім того, показники HSC з кісткового мозку та UC низькі і потребують розширення ex vivo для лікування гематологічних захворювань у дорослих людей. Однак недавнє дослідження показало, що є вагомі докази того, що HSC є плюрипотентними і є джерелом для більшості, якщо не всіх, типів клітин у нашому тілі [31].
МСК плода суперечливі, оскільки вони походять від абортів людини. Оскільки Піттенгер та його колеги продемонстрували успішну ізоляцію мультипотентних МСК із кісткового мозку, це стало основним джерелом отримання МСК [32]. Хоча BM-MSC є найбільш вивченими та добре задокументованими, BM-MSC мають обмеження щодо кількості клітин і як такі вимагають розширення in vitro, що створює ризик втрати властивостей стебла, індукції артефактивних хромосомних змін та проблем забруднення [ 16,32]. Жирова тканина нещодавно з’явилася як альтернативне джерело МСК. Незважаючи на його рясний характер, для збору тканини все ще потрібна інвазивна процедура [33].
Позаембріональні перинатальні МСК, зібрані з плаценти, плодової оболонки (амніон та хоріон), UC, UC крові та навколоплідних вод представляють проміжний тип стовбурових клітин, який частково поєднує деякі плюрипотентні властивості дорослих MSC [34–37]. Оскільки вони мають тісний онтогенетичний взаємозв’язок із ембріональними стовбуровими клітинами, екстраембріональні МСК, отримані з тканини, мають імунопривілейовані характеристики, мають ширшу мультипотентну пластичність і швидше розмножуються, ніж дорослі МСК [37,38]. Більше того, ці клітини можна було б ізолювати та використовувати без етичних проблем, оскільки позаембріональні тканини зазвичай викидаються після народження [38].
3.2. Імуномодулююча властивість WJ
3.3. Фенотипова характеристика WJ
Згодом Єшке та його колеги виявили конкретну область підкладки UC (субліміон) та WJ, збагачену нішами стовбурових клітин [17]. До цього звіту Кіта та співробітники [25] раніше намагалися ізолювати МСК від субліону УК, і вони повідомили, що субамніотичні МСК відрізняються від ЕСК і не демонструють пухлинність in vitro. CL-MSC, виділені своїм методом, підтримують типові характеристики MSC in vitro, але також виявили кілька специфічних особливостей [25]. Через кілька анатомічно різних зон, знайдених в UC, ізольовані мультипотентні клітини іноді виявляють неоднорідність. Крім того, відмінності в техніці ізоляції можуть призвести до подальших змін. Слід зазначити, що CL-MSC мають чудовий потенціал з точки зору їх проліферативної здатності та, можливо, мультипотентності [17]. Однак головним недоліком CL-MSC є надзвичайно трудомісткий характер процесу ізоляції. На відміну від цього, WJ забезпечує широкий запас MSC. Хоча WJ – MSC демонструють більшу різницю щодо якості клітин, WJ все ще є дуже корисним складом MSC. Відповідно, при виборі джерела MSC слід враховувати якість та кількість стовбурових клітин, необхідних для кожного конкретного застосування.
4. Клінічне застосування стовбурових клітин, похідних від ВЖ
4.1. Терапія раку
4.2. Захворювання печінки
4.3. Серцево-судинні захворювання
4.4. Регенерація хряща
4.5. Ремонт периферичного нерва
4.6. Серцева диференціація стовбурових клітин, похідних від WJ
Легка доступність та здатність UCMSC диференціюватись у клітини з характеристиками кардіоміоцитів роблять UCMSC привабливим кандидатом для клітинної терапії та інженерії серцевої тканини. Наступним кроком є показати, чи мають UCMSC, а також похідні від WJ стовбурові клітини функціональні властивості кардіоміоцитів, щоб повністю оцінити їх корисність для репарації серця.
5. Нові межі досліджень у дослідженні WJ
5.1. Клональні МСК
Багате джерело людських MSC було знайдено в периваскулярній області UC людини, яка називала HUCPVC [24, 100, 101], що дозволило першому надійному клональному підтвердженню одноклітинної ієрархії диференціації MCS [102]. Виділення негематопоетичної (CD45−, CD34−, SH2 +, Thy-1 +, CD44 +) популяції HUCPVC [24] може представляти важливе джерело клітин для алогенних методів терапії на основі МСК через їх швидке подвоєння, високі частоти КУО -F та CFU-остеогенна субпопуляція та високий рівень MHC -/- фенотип. HUCPVC демонструють подібний імунологічний фенотип до MSC, отриманих з кісткового мозку (BM-MSC), і представляють негемопоетичний міофібробластичний фенотип MSC (CD45−, CD34−, CD105 +, CD73 +, CD90 +, CD44 +, CD106 +, 3G5 +, CD146 +) [103] . На додаток до міцної квінті-потенціальної здатності диференціювати in vitro, було показано, що HUCPVC сприяють загоєнню м’язово-скелетних та шкірних ран in vivo [103]. Подібні клонові експансії стовбурових клітин, похідних від ВЖ, забезпечать чітко визначений набір стовбурових клітин, що дозволяє послідовно перевіряти та повторювати дослідження, що може сприяти успішному перекладу лабораторних досліджень ВЖ для терапевтичних застосувань.
5.2. Застосування магнітно-резонансної томографії в стовбурових клітинах з контрастною міткою UC
6. Висновки
В цілому ці дослідження пропонують авторитетні погляди на фенотипові маркери та терапевтичний потенціал стовбурових клітин, похідних WJ. Ми надаємо уявлення про прогалини в знаннях щодо біологічних властивостей клітин та трансляційних застосувань. З огляду на безліч тканинних джерел стовбурових клітин, подальші дослідження переваг та обмежень ВЖ покажуть їх оптимальні схеми трансплантації, розроблені для конкретних захворювань.
Подяка
CV Borlongan підтримується Фондом Джеймса та Естер Кінг для програми біомедичних досліджень 1KG01-33966, Міністерство оборони W81XWH1110634 та NIH NINDS RO1 1R01NS071956-01. Д. В. Кім підтримується співробітником Сонгсанського університету в 2012 році.
Конфлікт інтересів
Автори не заявляють конфлікту інтересів.
- Чому горіхи макадамії є суперпродуктом харчування, який кожен повинен включати у свій раціон Максим
- Розмова із SuicideGirls про їх нове; Дієта; Марка бур’янів
- Чому натрій має вирішальне значення для спортсменів, які найкраще працюють завдяки Precision Hydration
- Чим харчуються золоті рибки за своїм харчуванням, це може здивувати вас - Pet Ponder
- Ці спортсмени - не Том Брейді, їх жахливі звички в їжі змусять вас стриматися