Фенофібрат пригнічує гіпертрофію адипоцитів та резистентність до інсуліну, активуючи жировий PPARα у мишей, що страждають ожирінням з високим вмістом жиру
Анотація
Вступ
Резистентність до інсуліну найбільш тісно пов'язана з вісцеральним ожирінням (Kissebah, 1997; Jensen, 2006). Дані досліджень на людях і тваринах вказують на те, що ожиріння внаслідок гіпертрофії адипоцитів призводить до інсулінорезистентності та діабету, тоді як відновлення нормальних рівнів жирової тканини полегшує інсулінорезистентність, наявну при ожирінні (Spiegelmanand Flier, 1996; Murphy et al., 1997; Wickelgren, 1998; Brunzell and Hokanson, 1999). Гіпертрофічні адипоцити збільшують TNFα, лептин та циркулюючі вільні жирні кислоти, які були залучені до розвитку резистентності до інсуліну (Hotamisligil et al., 1993; Taylor et al., 1996; Boden, 1997; Okuno et al., 1998). Таким чином, перетворення гіпертрофічних адипоцитів у малі адипоцити, як видається, відіграє важливу роль у полегшенні як інсулінорезистентності, так і діабету (Okuno et al., 1998; de Souza et al., 2001).
Фібрати діють як агоністи α (PPARα), що активуються проліфератором ядерних пероксисом, що регулюють експресію генів, критичних для метаболізму ліпідів та ліпопротеїнів (Schoonjans et al., 1996; Staels et al., 1998; Kliewer et al., 1999). Показано, що фібрати регулюють ожиріння у гризунів за рахунок збільшення окислення печінкової жирної кислоти та зменшення рівня циркулюючих тригліцеридів, відповідальних за гіпертрофію жирових клітин та гіперплазію (Yoon et al., 2002, 2003; Jeong et al., 2004a, b), що припускає що PPARα бере участь у контролі інсулінорезистентності, спричиненої ожирінням. Однак дослідження показали, що поліпшення передачі сигналів про інсулін шляхом активації PPARα зумовлене в основному зменшенням ектопічних ліпідів у нежировій тканині.
Хоча PPARα відіграє важливу роль у окисленні жирних кислот у печінці та скелетних м’язах, повідомляється, що активатори PPARα можуть впливати на метаболізм жирової тканини. Наприклад, введення безафібрату, типового активатора PPAR, призводить до дедиференціації адипоцитів у преадипоцитоподібні клітини шляхом активації генів, що беруть участь як у мітохондріальному, так і в пероксисомному β-окисленні (Cabrero et al., 2001; Vázquez et al., 2001 ); ліганд PPARα GI259578A зменшує середній розмір адипоцитів у білій жировій тканині (Okamoto et al., 2007). Відповідно, ми припускаємо, що активація жирового PPARα фенофібратом може інгібувати гіпертрофію адипоцитів, що призводить до покращення інсулінорезистентності.
Отже, цілями цього дослідження було 1) визначити, чи активує фенофібрат жирову експресію цільових генів PPARα, що беруть участь у β-окисленні жирних кислот, та 2) вивчити подальший вплив фенофібрату на розмір адипоцитів та чутливість до інсуліну. Отримані нами дані продемонстрували, що лікування фенофібратом збільшує експресію мРНК ферментів, відповідальних за β-окислення жирних кислот у вісцеральній жировій тканині, що призводить до зменшення розміру адипоцитів та полегшення інсулінорезистентності.
Результати
Регулювання маси тіла, маси вісцерального жиру та розміру адипоцитів фенофібратом
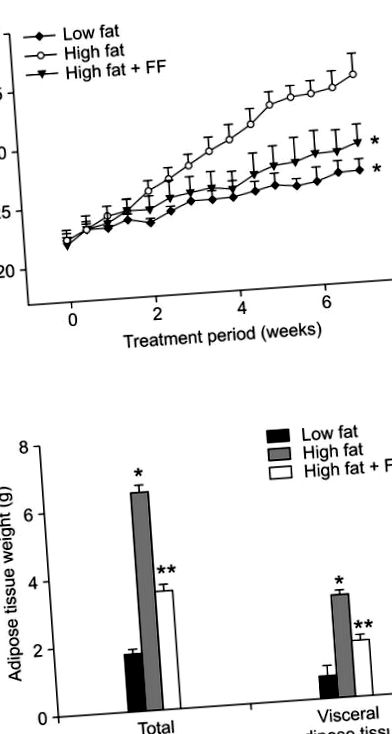
Лікування фенофібратом запобігало збільшенню маси тіла, спричиненому дієтою, з високим вмістом жиру (рис. 1А). Як загальна, так і вісцеральна маса жирової тканини також зменшувалась у мишей, які отримували дієту з високим вмістом жиру, доповнену фенофібратом, порівняно з мишами, які харчувалися дієтою з високим вмістом жиру (рис. 1В). Гістологічний аналіз показав, що фенофібрат спричинив зменшення розміру адипоцитів у жировій тканині епідидиму на 43% у збагачених фенофібратом мишах з високим вмістом жиру та жирів, що харчуються з високим вмістом жиру (рис. 2А). Середній розмір адипоцитів у мишей з ожирінням з високим вмістом жиру становив 5 505 ± 354 мкм 2, тоді як розмір адипоцитів становив 3135 ± 182 мкм 2 у мишей із ожирінням, які отримували фенофібрат (рис. 2В). Кількість адипоцитів у фіксованій зоні збільшилася на 75% у мишей із ожирінням, які отримували фенофібрат, порівняно з мишами з високим вмістом жиру, які годувались ожирінням (рис. 2С), припускаючи, що фенофібрат спричиняв збільшення малих адипоцитів та зменшення великих адипоцитів у епідидимальних жирова тканина ожирілих мишей. Що стосується фізіологічного значення таких змін, молекули, які генеруються або секретуються гіпертрофічними адипоцитами, беруть участь у розвитку інсулінорезистентності (Hotamisligil et al., 1993; Taylor et al., 1996). Таким чином, фенофібрат може полегшити резистентність до інсуліну, принаймні частково, завдяки своїй здатності зменшувати розмір адипоцитів.
Експресія цільових генів PPARα, що беруть участь у β-окисленні жирних кислот у вісцеральній жировій тканині та диференційованих адипоцитах 3T3-L1
Щоб визначити, чи може зменшення розміру адипоцитів бути спричинене опосередкованими фенофібратом діями PPARα в жировій тканині, ми виміряли рівні мРНК цільових ферментів PPARα, відповідальних за пероксисомне та мітохондріальне β-окислення жирних кислот у вісцеральній жировій тканині ожирених мишей та адипоцитів миші культур. Миші, що харчуються фенофібратом, з високим вмістом жиру, виявляли значно вищі рівні мРНК ферментів для β-окислення жирних кислот у жировій тканині епідидиму [наприклад, ацил-КоА оксидаза (ACOX), еноїл-КоА гідратаза/3-гідроксиацил-КоА дегідрогеназа (HD) та середньоланцюгової ацил-КоА-дегідрогенази (MCAD) відповідно на 186%, 145% та 20%] у порівнянні з мишами з високим вмістом жиру, яких годували дієтою (рис. 3). Подібним чином, лікування потужним лігандом PPARα, Wy14,643, збільшувало експресію мРНК ACOX, HD та MCAD на 50%, 18% та 11% відповідно у диференційованих клітинах 3T3-L1 (рис.4). Ці результати свідчать про те, що фенофібрат може зменшувати розмір адипоцитів, частково завдяки активації жирового PPARα.
Експресія генів жирових маркерів
Оскільки страждають ожирінням, резистентні до інсуліну гризуни з гіпертрофічними адипоцитами надмірно експресують гени-маркери адипоцитів, такі як PPARγ, адіпоцитарний білок, що зв’язує жирні кислоти, лептин та TNFα (Brun et al., 1997; Okuno et al., 1998), ми тестували вплив фенофібрату на експресію мРНК лептину та TNFα в жировій тканині епідидиму. Відповідно до впливу фенофібрату на розмір адипоцитів, лікування фенофібратом суттєво знижувало рівні лептину та TNFα мРНК на 19% та 26% відповідно, порівняно з тими в групі, яка харчувалася лише дієтою з високим вмістом жиру (рис.5).
Циркулюючий рівень ліпідів, глюкози та інсуліну
Рівні вільних жирних кислот та тригліцеридів у сироватці крові були вищими на 24% та 91% відповідно у групі, що страждає від високої жирності, порівняно з контрольною групою з низьким вмістом жиру (табл. 1). Однак рівень вільних жирних кислот у сироватці крові знизився на 12%, а рівень тригліцеридів у плазмі крові у мишей, які отримували фенофібрат, порівняно з тими у мишей, що харчувалися дієтою. Фенофібрат також спричиняв зниження рівня інсуліну та глюкози у плазмі крові відповідно на 58% та 42% у тварин, що харчуються з високим вмістом жиру, таким чином покращуючи резистентність до інсуліну у мишей із ожирінням.
Внутрішньочеревинний тест на толерантність до глюкози
Вплив фенофібрату на зміни рівня глюкози в крові вимірювали під час внутрішньоочеревинного тесту на толерантність до глюкози у мишей з високим вмістом жиру. Після семи тижнів лікування фенофібратом миші демонстрували значне зниження концентрації глюкози в крові після внутрішньочеревного введення глюкози порівняно з контрольними мишами з ожирінням (рис. 6). Ці результати вказують на те, що фенофібрат може покращити толерантність до глюкози у мишей з ожирінням, спричиненим дієтою.
Обговорення
Накопичення вісцерального жиру внаслідок гіпертрофії адипоцитів індукує зміни у виробленні та секреції адипокінів, таких як адипонектин, вісфатин, лептин та TNFα, що беруть участь у розвитку резистентності до інсуліну (Ahima, 2006; Bulcao et al., 2006; Matsuzawa, 2006 ). Лептин і TNFα надмірно експресуються в жирових тканинах ожирених, резистентних до інсуліну гризунів, які мають гіпертрофічні адипоцити (Hotamisligil et al., 1993; Maffei et al., 1995; Okuno et al., 1998; Kralisch et al., 2007) . Оскільки повідомляється, що лептин і TNFα принаймні частково відповідають за інсулінорезистентність, спричинену ожирінням (Hotamisligil et al., 1996; Ceddia et al., 1998), зменшення експресії лептину та TNFα може сприяти покращенню резистентності до інсуліну. У нашому дослідженні лікування мишей із ожирінням фенофібратом знижувало рівень мРНК лептину та TNFα, хоча зміни рівня циркулюючих адипокінів фенофібратом не вимірювали. Таким чином, представляється ймовірним, що фенофібрат сприяє поліпшенню резистентності до інсуліну через зменшення експресії сигнальних молекул у гіпертрофічних адипоцитах.
Крім того, багато доказів, отриманих в результаті генетичних досліджень людини та гризунів, вказує на те, що PPARα відіграє певну роль у розвитку ожиріння та ожиріння, хоча PPARα експресується на низькому рівні в білій жировій тканині. Генетичні дослідження людини показали, що поліморфізм посилення функції L162V у гені PPARα пов'язаний зі зниженим ожирінням у загальній популяції (Bosse et al., 2003). Дослідження на гризунах також показали, що більші запаси жирових залоз спостерігалися відтворюваним чином у PPARα-нульових мишей (Akiyama et al., 2001), припускаючи, що активатор PPARα фенофібрат може використовуватися як інгібітор маси жирової маси. Однак дотепер фенофібрат не використовувався для контролю маси жирової тканини у людини, можливо, через можливість того, що доза фенофібрату для втрати жиру викликає небажані побічні ефекти, хоча наші сучасні результати показують, що фенофібрат значно зменшив масу вісцерального жиру у мишей із ожирінням.
На закінчення ці дослідження демонструють, що лікування фенофібратом підвищує експресію генів-мішеней PPARα, що беруть участь у β-окисленні жирних кислот у вісцеральній жировій тканині ожиріних, резистентних до інсуліну мишей. Ці зміни призвели до зменшення розміру адипоцитів, а також зниження вмісту вільних жирних кислот у сироватці крові, експресії мРНК жирового лептину та TNFα, зменшуючи тим самим частоту резистентності до інсуліну.
Методи
Тварини
Для всіх експериментів восьмитижневих мишей (C57BL/6J) утримували та виводили в Корейському науково-дослідному інституті біології та біотехнології в умовах, що не містять патогенів, зі стандартним 12-годинним циклом світло/темрява. До введення спеціальних дієт мишей годували стандартною чау-гривою та водою ad libitum. Мишей ділили випадковим чином на три групи (n = 5/група), одна з яких отримувала дієту з низьким вмістом жиру (4,5% жиру, мас./Мас., CJ, Корея). Інша група отримувала дієту з високим вмістом жиру, що містила 35% жиру (мас./Мас., Research Diets, Нью-Брансвік, Нью-Джерсі), а останню групу годували тією ж дієтою з високим вмістом жиру, доповненою фенофібратом (0,05%, мас.) Протягом семи тижнів (Jeong et al., 2004b; Jeong and Yoon, 2007). Склад дієти з високим вмістом жирів наведено в таблиці додаткових даних S1. У всіх експериментах вагу тіла вимірювали щодня, використовуючи баланс верхнього навантаження, а особу, яка вимірювала масу тіла, засліплювали для кожної групи лікування. Тварин жертвували вивихом шийки матки, тканини збирали, зважували, швидко заморожували в рідкому азоті та зберігали при -80 ℃ до використання.
Тести на толерантність до глюкози проводили шляхом внутрішньочеревної ін’єкції (ІП) глюкози (2 г/кг маси тіла) мишам на дієті з високим вмістом жиру або на тій самій дієті з високим вмістом фенофібрату протягом 7 тижнів. Глюкозу в крові вимірювали за допомогою системи Accu-Chek Performa (Рош, Німеччина) через зазначені інтервали часу.
3T3-L1 диференціація
Клітини миші 3T3-L1 (ATCC) у 6-лункових планшетах проліферували в DMEM, що містить 10% бичачої телячої сироватки (Gibco-BRL, Grand Island, NY). Після того, як клітини витримували злиття протягом двох днів, їх інкубували в індукційному середовищі (0-й день), що містить 1 мкМ дексаметазону, 0,5 мМ 1-метил-3-ізобутил-ксантину та 1 мкг/мл інсуліну в DMEM з 10% FBS (Gibco -BRL). Культури продовжували ще протягом двох днів для індукування диференціації адипоцитів. Після цього клітини культивували в DMEM з 10% FBS протягом решти процесу диференціації. Всі інші методи лікування проводили лише з 0 по 2 день, а середовище змінювали через день.
Визначення рівня глюкози, інсуліну, тригліцеридів та вільних жирних кислот у плазмі крові
Рівні тригліцеридів та глюкози вимірювали за допомогою автоматичного хімічного аналізатора крові (CIBA Corning, Oberlin, OH). Рівні вільних жирних кислот та інсуліну вимірювали за допомогою SICDIA NEFAZYME (Shinyang Chemical, Сеул, Корея) та набору радіоімуноаналізу на інсуліні щурів (Linco, St. Charles, MO), відповідно.
Гістологічний аналіз
Для фарбування гематоксиліном та еозином (H&E) жирові тканини епідидиму фіксували у 10% -ному фосфатно-забуференному формаліні протягом однієї доби та обробляли звичайною процедурою для парафінових зрізів. Зрізи товщиною п’ять мікрометрів вирізали і фарбували H&E для мікроскопічного дослідження. Щоб визначити кількість і розмір адипоцитів, зрізи, пофарбовані H & E, аналізували за допомогою системи аналізу зображень (Image Pro-Plus, Silver Spring, MD).
RT-PCR
Загальну клітинну РНК готували з використанням реагенту Trizol (Gibco-BRL, Grand Island, NY). Два мкг загальної РНК транскрибували за допомогою зворотної транскриптази вірусу мишачого лейкозу Молоні та антисмислового праймера для отримання кДНК у стандартних умовах. Зразки кДНК ампліфікували за допомогою ПЛР в MJ Research Thermocycler (Waltham, MA). Праймери ПЛР, що використовуються для ампліфікації, показані в таблиці додаткових даних S2. Реакція складалася з 30 циклів денатурації протягом 1 хв при 94 ℃, відпалу протягом 1 хв при 58 ℃ і подовження протягом 1 хв при 72 ℃. Продукти ПЛР аналізували електрофорезом на 1% агарозному гелі. Продукти ПЛР кількісно визначали з агарозних гелів за допомогою набору GeneGenius (Syngene, Кембридж, Великобританія).
Статистичний аналіз
Якщо не зазначено інше, усі значення виражаються як середнє значення ± SD. Всі дані були проаналізовані неспареними, студентськими т-тест на значущі відмінності середніх значень кожної групи за допомогою SigmaPlot 2001 (SPSS Inc, Chicago, IL).
- Підказки баріатричної хірургії, спрямованої на зменшення інсулінорезистентності для зцілення серця
- Щоденні форуми щодо діабету, фенофібрату, чутливості до інсуліну та схуднення
- Дефіцит ”мітохондрій у м’язах не спричиняє інсулінорезистентного діабету
- Вибраний одного дня Жировий від лікаря, який ДРІТ СИФІ
- Вплив схуднення та фізичних вправ на концентрацію апелінової сироватки та вираження жирової тканини в