Епігеномні зриви: наслідки раннього впливу на розвиток
Анотація
ВСТУП
Ендокринно-руйнуючі сполуки (EDC) - це хімічні речовини, які перешкоджають функції ендогенних гормонів в ендокринній системі. Опромінення може призвести до репродуктивних відхилень, зміненого розвитку, дефектів мозку та поведінки, порушення імунної функції та раку (оглянуто в (Diamanti-Kandarakis та ін., 2009). Найбільш часто вивчаються ЕДК - це ДДТ, поліхлоровані біфеніли (ПХБ), полібромірованний дифеніл ефіри (PBDE), фталати та бісфенол A (BPA). На додаток до своїх ендокринних активних властивостей, деякі EDC порушують епігеномне програмування (Anway and Skinner, 2008; Dolinoy та інші, 2007; Kang and Lee, 2005; Лі та інші, 1997). Тут, після короткого підсумку епігенетики, ми опишемо чутливість епігенома до впливу навколишнього середовища під час розробки та два типи особливо чутливих локусів: відбиті гени та метастабільні епіаллеї. Потім ми підсумуємо дослідження за допомогою Агуті життєздатна жовта (A vy) модель миші для виявлення епігенотоксичності BPA та обговорення потенціалу цієї моделі для скринінгу інших EDC. Трансгенераційні ефекти EDC омінг більш наочним. Щоб зрозуміти біологічні механізми успадкування фенотипів, необхідно ретельно вивчити епігенетичні зміни в геномі та в імпринтованих генах.
ЕПІГЕНЕТИЧНЕ ПРОГРАМУВАННЯ: ОРЕКРЕСТИРОВАНА СИСТЕМА
Гіпотеза «фетальне походження хвороби» пояснює явища, при яких ранні впливи на розвиток впливають на початок захворювання в подальшому житті. Гіпотеза, вперше запропонована Девідом Дж. П. Баркером, спочатку постулювала, що ранні харчові впливи впливають на серцеві захворювання (Barker and Clark, 1997). Зараз ця теорія охоплює наслідки численних впливів на ініціювання раку, порушення розвитку, неврологічні захворювання та метаболічні синдроми (Barker та ін., 2002).
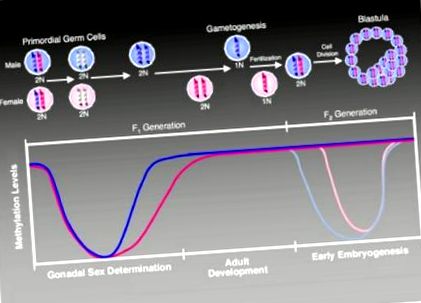
Під час розвитку епігеном циклічно проходить через низку точно визначених змін метилювання, покликаних забезпечити належний розвиток (рис. 1). Відповідні терміни та надзвичайна точність метилювання в гаметах та наступне запліднення роблять цю високо узгоджену систему особливо вразливою до впливу навколишнього середовища (Murphy and Jirtle, 2003). Коротко кажучи, геном батьків активно деметилюється, а геном матері пасивно деметилюється після запліднення. На стадії морули відбувається de novo метилювання геному для встановлення належних моделей метилювання під час ембріонального розвитку.
Зміни статусу метилювання під час розвитку (Jirtle and Skinner, 2007). У первинних статевих клітинах широкомасштабне деметилювання стирає попередні батьківські специфічні знаки метилювання, які регулюють експресію відбиткового гена. Після цього стирання шаблони метилювання у відбиткових генах відновлюються в залежності від статі, спочатку в гоноцитах, що розвиваються (чоловіки, кольорово-фіолетовий), а пізніше у жіночій (кольорово-рожевий) зародкові лінії. Відбиті гени зберігають свої первинні знаки метилювання протягом життя та під час епігеномного перепрограмування, яке слідує за заплідненням наступного покоління. У поколінні F2 епігенетичне перепрограмування відновлює тотипотентність зиготи. Батьківський геном активно деметилюється (позначений світлою фіолетовою лінією на графіку), тоді як материнський геном зазнає пасивного деметилювання (позначений більш яскравою рожевою лінією на графіку) (Weaver and Susiarjo, 2009). Після імплантації відбувається реметилювання геному для регулювання диференціації різних типів клітин. В цей час також встановлюються вторинні відбитки, які поряд з основними відбитками зберігаються протягом усього життя людини. Це підтримання дозволяє успадкувати специфічну для батьків моноалельну експресію в соматичних тканинах протягом усього дорослого віку.
Відбиток є вразливим до дерегуляції під час стирання та встановлення первинного відбитка під час гаметогенезу. Ці відбитки також слід захищати від невідповідного стирання незабаром після запліднення, коли ДНК зазнає глобального деметилювання (Jirtle and Skinner, 2007). Таким чином, екологічні агенти, що змінюють імпринтинг цих генів, призведуть до серйозних порушень розвитку та посилення сприйнятливості до хвороб (Das та ін., 2009).
РЕАГУЮТЬ РЕАКЦІЇ ТА НАСЛІДКИ НА ЕПІГЕНОМ
Лабільна природа епігенома дозволяє йому реагувати та адаптуватися до стресових факторів навколишнього середовища. Ці епігенетичні модифікації також можуть бути шкідливими - як у подальшому житті, так і для майбутніх поколінь. Навіть серед генетично ідентичних особин епігенетичні зміни можуть глибоко вплинути на фенотип. Наприклад, монозиготні близнюки, які вирощуються в різних середовищах, мають суттєво контрастні рівні метилювання до дорослого віку (Fraga та ін., 2005). Вважається, що це явище відповідає за суперечливі випадки раку, астми та серцево-судинних захворювань, які часто спостерігаються серед монозиготних близнюків. Зовсім недавно було виявлено, що системний червоний вовчак (СЧВ) також відрізняється серед монозиготних близнюків (Javierre та ін., 2010). Близнюки, несумісні з цим захворюванням, також продемонстрували значні відмінності в метилюванні ДНК та експресії генів, що мають відношення до патогенезу СЧВ. В одному рідкісному випадку монозиготна пара близнюків виявилася невідповідною до синдрому каудального розмноження. Генетичних мутацій не виявлено, і було показано, що гіперметилювання гена AXIN1 призводить до розладу (Oates та ін., 2006). Ці відкриття вказують на те, наскільки епігенетична дисрегуляція керує початком та прогресуванням захворювання.
Епігенетичні зміни не лише успадковуються в соматичних клітинах, але також можуть підтримуватися під час мейозу. Як результат, епігенетична інформація може передаватися у спадок через покоління. Приклади цього є у рослин, комах та ссавців. У рослин вплив навколишнього середовища може змінити епігенетичну регуляцію експресії генів, яка зберігається протягом наступних поколінь (Бойко та ін., 2010; Моліньє та ін., 2006). У drosophila melanogaster трансгенераційне епігенетичне успадкування регулюється ремоделюванням хроматину (Ruden and Lu, 2008). Нарешті, у життєздатної жовтої миші Агуті успадкування фенотипу кольору шерсті у наступних поколіннях контролюється епігенетичними механізмами на алелі Агуті (Blewitt та ін., 2006; Morgan та ін., 1999).
Епігеномні реакції людини на голод, здається, також узгоджуються з трансгенераційним успадкуванням. Метилювання у відбиткових генах змінюється у тих, хто зазнав голоду внутрішньоутробно (Heijmans та ін., 2008; Tobi та ін., 2009). Вважається, що така реакція є адаптивною для сприяння виживанню в недоїданому середовищі; однак епігеномна дисрегуляція підтримується у зрілому віці і корелює зі збільшенням захворювань, таких як рак, шизофренія та серцево-судинні захворювання (Barker та інші, 2009; Song та інші, 2009). Крім того, у дітей неповносправних батьків спостерігалося збільшення ожиріння новонароджених, рак, атопічні та аутоімунні захворювання, що вказує на потенціал трансгенераційного успадкування епігенетичних дефектів (Painter та ін., 2008). Оскільки зміни в метилюванні ДНК в регуляторних елементах відбитків є у людей, що зазнали внутрішньоутробного впливу голодомору десятиліттями раніше, вони вважаються потенційно корисними як біосенсори для впливу на організм речовин, що змінюють епігеном (Hoyo та ін., 2009).
МЕТАБЛИВІ ЕПІАЛЛИ: ЕКОЛОГІЧНІ БІОСЕНСОРИ
Метастабільні епіаллелі - це алелі, які варіабельно експресуються у генетично ідентичних особин завдяки епігенетичним модифікаціям, встановленим під час раннього розвитку. Ці епігенетичні знаки мають ряд важливих характеристик: 1) вони встановлені стохастично (Morgan та ін., 1999), 2) вони потенційно успадковуються трансгенераційно (Ракян та інші, 2003), і 3) їх встановлення може бути змінено екологічними агентами, такими як харчові добавки (Waterland and Jirtle, 2003). Життєздатні миші Агуті (A vy) та Axin Fused (Axin Fu) - унікальні тваринні моделі, які несуть метастабільні епіаллеї A vy та Axin Fu відповідно. Хоча метастабільних епіаллелей ще не виявлено у людей, ці біосенсори мишей є корисними моделями для визначення того, чи впливають харчові та токсичні речовини матері на епігенетичне програмування у нащадків.
Метастабільні епіаллеї A vy та Axin Fu містять інтрацистернальні A-частинки (IAP). Ретротранспозони IAP широко поширені в геномі миші приблизно в 1000 копій на клітину і складаються з елементів до 7 кб у повну довжину (Kuff and Lueders, 1988; Maksakova та ін., 2006). Елементи IAP, поряд з кількома іншими, включають ендогенні ретровіруси класу II, які становлять 3% геному миші, але лише 0,3% геному людини (Консорціум, 2002). Незважаючи на те, що елементи IAP відсутні в геномі людини, присутні й інші транспонсовані елементи, включаючи ретровірусні, подібні елементи (Консорціум, 2002). Довгі термінальні повтори (LTR), фланкуючі IAP, несуть промотори, які ініціюють транскрипцію IAP, і - у випадку з цими метастабільними епіаллеями - сусідні послідовності господарів (Falzon and Kuff, 1988; Lewin, 2000; Mietz and Kuff, 1990).
Миша A vy несе вкладиш IAP, що ретранспонується, в ген мишачого Агуті, вище від нормального стартового місця транскрипції (Dickies, 1962) (Малюнок 2А). Мишачий ген Агуті кодує молекулу, що сигналізує про паракрин, яка стимулює фолікулярні меланоцити до утворення жовтого пігменту замість чорного пігменту (Miltenberger та ін., 1999). Зазвичай транскрипція починається з промотору певного циклу волосся в шкірі. Перехідна експресія у волосяних фолікулах призводить до утворення апікальної жовтої смуги на кожному чорному волоссі, що спричиняє коричневий (агуті) колір шерсті мишей дикого типу.
Епігенетична генна регуляція в локусі A vy. (A) Метастабільна епіаллея A vy містить інтрацистернальну вставку частинки A в межах псевдоекзона 1А. Нормальна транскрипція відбувається із специфічного промотору циклу волосся в екзоні 2 і веде до коричневих мишей. Введення IAP вище за течією промотору дикого типу призводить до конститутивної експресії Agouti від IAP криптичного промотору та жовтих мишей. Стохастичне метилювання сайтів CpG вище за течією криптичного промотору корелює коректно з виразом A vy. (B) П’ятнадцяти тижнів, генетично однакові, миші Vy з різним кольором шерсті. Жовті миші (ліворуч) гіпометилюються перед промотором A vy, тоді як миші псевдоагуті (праворуч) гіперметилюються на цих сайтах CpG, повторюючи нормальну експресію Агуті. Підвищення рівня ектопічної експресії Агуті у 15-тижневих мишей A vy (справа наліво) призводить до ожиріння, пухлини та діабету.
У мишей A vy криптичний промотор в проксимальному кінці IAP індукує конститутивну транскрипцію Агуті у всіх клітинах та протягом усього життя миші (Waterland and Jirtle, 2003). Ця ектопічна експресія призводить до пожовтіння хутра та до зв’язування білка агуті з рецептором меланокортину 4 у всіх тканинах, включаючи центр насичення в гіпоталамусі (Miltenberger та ін., 1999). Отриманий сигнал посилює ожиріння, діабет та рак у жовтих мишей (Morgan та ін., 1999). Метилювання CpG на ІАП встановлюється під час ембріонального розвитку, і рівні корелюють обернено з ектопічною експресією Агуті. Рівні метилювання різняться серед ізогенних мишей, внаслідок чого фенотипи варіюються від жовтих та ожиріння (неметильованих) до псевдоагуті та здорових (метильованих) (Малюнок 2B). Цей спектр потенційних фенотипів робить мишу A vy унікальною біосенсорною моделлю для визначення епігенетичних ефектів впливу навколишнього середовища та поживних речовин (Dolinoy, 2008; Waterland and Jirtle, 2003).
Як і A vy, алель Axin Fu містить вставку IAP у мишачому гені Axin. Білок аксіну бере участь у формуванні осі зародка ссавців. Введення IAP призводить до експресії усіченої, але біологічно активної транскрипту Axin, що призводить до осьових дуплікацій та перегинів хвоста, що утворюються під час розробки (Rakyan та ін., 2003). Миші Axin Fu мають перекручені хвости різного ступеня тяжкості; ступінь перегину хвоста обернено пов'язана зі ступенем метилювання IAP у локусі Axin Fu (Rakyan та ін., 2003). Подібно до моделі A vy, модель Axin Fu також забезпечує потужний інструмент для аналізу здатності впливів розвитку впливати на генетичне метилювання та фенотип (Waterland and Jirtle, 2003).
Ще одна метастабільна епіаллея - IAP Cabp. Миші A vy та Axin Fu також несуть ген Cabp IAP завдяки своїй присутності у фоновому штамі миші C57BL/6. Ген активатора CDK5, що зв'язує білок (Cabp), розташований на миші 2-ї хромосоми. Цікаво, що IAP Cabp містить ретротранспозон IAP (Druker та ін., 2004), а експресія гена обернено корелює з метилюванням цитозину при 5 'LTR елемента IAP . Вкладиш Capp IAP є специфічним для штаму миші C57BL/6, що свідчить про недавню ретротранспозицію. Завдяки присутності Capp IAP як у мишей A vy, так і у Axin Fu, вплив впливу навколишнього середовища можна досліджувати на більш ніж одному метастабільному локусі в межах однієї тварини.
МОДЕЛЬ ВІД МИШІ І БІСФЕНОЛ А: ВИЗНАЧЕННЯ ЕПІГЕНОТОКСИКАНТІВ
Вплив бісфенолу A (BPA) та харчових добавок матері на фенотип та епігенотип Avy/a нащадків. (A) Самки мишей піддавались модифікованій контрольній дієті з кукурудзяною олією, заміненою соєвою олією, модифікованою дієтою, що містить 50 мг/кг BPA, або модифікованою дієтою, що містить 50 mg/kg BPA, і доповненою донорами 250 мг/кг геністеїну або метилу. (B) Потомство, що зазнало впливу BPA внутрішньоутробно та під час лактації, було гіпометильовано на алелі A vy і з більшою часткою жовтого, ніж контрольні миші. Потомство, яке зазнало впливу BPA і доповнили донорами метилу та геністеїном, повернулось до рівня метилювання та пропорції кольору шерсті.
Хоча біохімічні механізми, за допомогою яких BPA змінює епігенетичне програмування, залишаються незрозумілими, результати інших досліджень підтверджують висновок про те, що BPA змінює епігенетичне програмування. Наприклад, неонатальне вплив щурів на низьку дозу BPA (10 мкг/кг маси тіла) епігенетично регулює експресію фосфодіестерази типу 4 (PDE4D4) та підвищує сприйнятливість до раку передміхурової залози (Хо та ін., 2006; Prins та ін., 2008). Зовсім недавно було показано, що внутрішньоутробний викид мишей до високої дози BPA (5 мг/кг) гипометилирует ген Hoxa10 в матці, що призводить до аномальної експресії та підвищеного зв'язування ER∂ з геном (Bromer та ін., 2010). BPA також збільшує експресію білків гістону під час естроген-опосередкованої проліферації клітин (Zhu та ін., 2009). Чи це збільшення є корелятивним чи причинним для розмноження клітин, вимагає подальшого дослідження. Крім того, низькі дози BPA (20 мкг/кг маси тіла), введені вагітним мишам протягом гестації, змінювали епігеном у передньому мозку потомства (Yaoi та ін., 2008). Вплив хімічної речовини призвів до гіпометилювання в локусах NotI та дерегуляції експресії генів. Ці зміни можуть допомогти пояснити дефекти розвитку мозку та поведінки, що спостерігаються у відповідь на вплив BPA на мишах (Tando та ін., 2007).
Епігенетичне програмування - нова кінцева точка, яка ще не вивчалась у стандартному тестуванні на токсичність. Окрім BPA, кілька ендокринних руйнівників можуть змінити епігенетичне програмування. Діетилстильбестрол (DES) був першим EDC, який показав, що порушує нормальні схеми метилювання (Li та інші, 1997). З тих пір було встановлено, що ДДТ, миш'як, фталати, метоксихлор та вінклозолін також викликають епігенетичні зміни (Anway та інші, 2005; Kang та Lee, 2005; Nilsson та інші, 2008; Shutoh та інші, 2009; Vahter, 2008). Повсюдна природа ендокринних руйнівників та інших токсичних речовин, що змінюють епігеном, викликає велике занепокоєння щодо ранніх факторів розвитку та демонструє необхідність профілактичних або терапевтичних стратегій для боротьби з їх негативними епігенетичними ефектами. Крім того, ефекти багаторазового змішаного впливу та добавок на епігеном ще не були повністю визначені. Результати цього дослідження BPA вказують на те, що харчові добавки можуть покращити чистий епігенетичний вплив на метастабільні алелі; однак інші суміші цілком можуть виявляти адитивні або синергетичні негативні ефекти. Модель A vy забезпечує унікальний спосіб вивчити потенційні наслідки ОДГ та інших факторів впливу.
ТРАНСГЕНЕРАЦІЙНІ ЕФЕКТИ ОДГ
ВИСНОВОК
Чутливість людського епігенома до низьких рівнів ОДГ безпосередньо впливатиме на здоров'я нинішнього та майбутнього населення. Якщо показано, що EDC заважають епігенетичному програмуванню на нинішніх рівнях експозиції, дослідники припускають, що окрім зміни сприйнятливості до хвороб, вони можуть також сприяти задокументованому збільшенню безпліддя у людини (Price and others, 2007). Таким чином, оскільки регулюючі органи намагаються визначити найкращий спосіб включення епігенетичних кінцевих точок в токсикологічну оцінку ризику, вчені повинні продовжувати розробляти кращі способи збільшення ширини доз, які можна вивчити, та масштабу епігенома, допитаного в нашому прагненні визначити епігенотоксичні агенти, які шкодять нам не мутуючи геном, а змінюючи епігеном.
ПОДЯКИ
Ця робота була підтримана грантом NIH 5R01-> ES008823, DOE DE-FG02-05ER64101 та премією Благодійного фонду Естер Б. О'Кіф.
- Вплив дієтичного споживання яєць матері під час ранньої лактації на концентрацію овальбуміну в людському молоці
- Диференціальні ефекти теплової пластичності розвитку у трьох поколінь гуппі (
- Вплив раннього ентерального харчування на моторику шлунково-кишкового тракту та бар’єр слизової оболонки кишечника
- Demol S 50mg10mg Tablet View Застосування, побічні ефекти, ціна та замінники 1mg
- Ефекти фруктової дієти, переваги, втрата ваги, максимуми та мінімуми вживання в їжу лише фруктів