Диференціальні ефекти теплової пластичності розвитку у трьох поколінь гуппі (Poecilia reticulata): каналізація та випереджувальне узгодження
Предмети
Анотація
Вступ
Матеріали і методи
Вивчення тварин
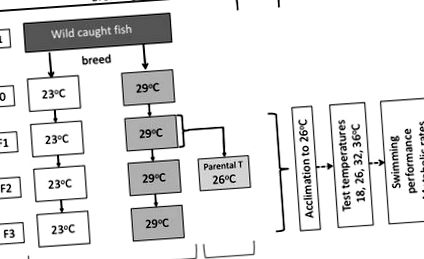
Усі процедури проводились із дозволу Комітету з етики тварин Університету Сіднея (номер затвердження L04/1–2013/3/5907), і ми підтверджуємо, що всі методи виконувались відповідно до відповідних рекомендацій та норм. Гуппі (Poecilia reticulata) є ідеальними зразками видів для цього дослідження, оскільки вони швидко розмножуються, і потомство швидко розвивається; в наших експериментальних умовах гуппі досягли статевої зрілості у віці 2–3 місяців, а розмножувались у віці 3–4 місяців. Гуппі отримали від дикої популяції в Північній території, Австралія (12 ° 25´ південної широти, 130 ° 50´ сх. Д.). Рибу утримували в пластикових резервуарах (645 × 423 × 276 мм) з щільністю 1–2 риби на літр при 25–26 ° C із світловим циклом 12 год. Риб годували двічі на день рибними пластівцями (Тропічні рибні пластівці Уордлі, The Hartz Mountain Corporation, Secaucus, NJ, USA). У кожному резервуарі був повітряний фільтр (біохімічний губчастий фільтр, Age of Aquariums, Australia), підключений до повітряного насоса (AC-9908; Resun, Китай). У цих умовах ми розводили дику рибу і використовували її потомство як батьківську рибу в експериментах (рис. 1).
Схематичний план експериментів. Ми отримали гуппі (Poecilia reticulata) з дикої природи (покоління F-1) і розводили їх у неволі. Ми використовували потомство першого покоління з дикої популяції як наше експериментальне батьківське покоління (F0). Ми розмістили рибу F0 як неповнолітню на двох температурних обробках (22–23 ° C [23 ° C] і 29–30 ° C [29 ° C]). Для експерименту 1, який мав на меті перевірити сукупний тепловий вплив температур розвитку між поколіннями, ми виростили F0 для наступних трьох поколінь (F1 до F3) за постійних умов (23 і 29 ° C). Щоб перевірити, чи існують ефекти дідуся у батьків в різних середовищах (експеримент 2), ми вирощували і розводили рибу F1 як з 23, так і з 29 ° C (температура дідусів) при 26 ° C (F2, батьківська температура), так що будь-яка різниця в їх потомство (F3), мабуть, походить від покоління дідуся. Усі експериментальні риби протягом трьох тижнів були акліматизовані до 26 ° C для усунення будь-яких наслідків оборотної акліматизації перед вимірюванням фенотипових реакцій (показники плавання та швидкості метаболізму) при різних температурах тесту (18, 26, 32, 36 ° C).
Експериментальне проектування: Експеримент 1
Перш ніж вимірювати фенотипічні реакції, ми протягом трьох тижнів піднімали рибу від обох температур розвитку до загальної температури саду (26 ° C), щоб усунути потенційні наслідки оборотної теплової аклімації, яка може замаскувати наслідки пластичності розвитку як такої 24, 25. Ми дозрілих риб, відібраних для експериментів, помістили в одностатеві резервуари для загальних садових процедур, і риба дозріла протягом тритижневого періоду аклімації.
Ми вимірювали показники Ucrit та метаболізму в діапазоні гострих тестових температур (18, 26, 32 та 36 ° C). Ми вибрали ці тестові температури на основі попередніх випробувань вимірювання Ucrit у рибах, які в інших місцях не використовувались в експерименті. Нашою метою було вибрати гострі тестові температури, які охоплювали температуру розвитку і падали по обидва боки температури, при якій відбувалися максимальні показники, але не завдаючи шкоди рибі. У цьому випадку показники плавання знижувались при 36 ° C у всіх експериментальних групах, але швидкість метаболізму не знижувалась. Тим не менше, ми вирішили не підвищувати температурні показники, щоб уникнути шкоди рибі.
Експериментальне проектування: Експеримент 2
Тут ми мали на меті перевірити, чи вплинуло середовище дідусів на фенотипи, коли середовище змінювалось між дідуським та батьківським поколіннями. Ми розводили рибу при 22–23 ° C та при 29–30 ° C до покоління F1, як описано вище. Потім ми виростили та виростили неповнолітнього F1 при 26 ° C до покоління F2 (рис. 1). Отже, покоління F2 було отримано з різних температур дідуся (23 ° C та 29 ° C для лікування дідусів), але однакової батьківської температури (26 ° C), що дозволило нам виявити будь-який вплив дідуся на фенотипи потомства F3. Ми вимірювали фенотипові відповіді (стійкі рухові показники [Ucrit], а також спокій та максимальна швидкість метаболізму [див. Нижче]) у восьми чоловіків та восьми жінок від кожної терапії дідуся (температура дідуся 23 ° C: жінки, довжина 0,015 ± 0,00098 м, маса 0,086 ± 0,019 г; самці, довжина 0,015 ± 0,00053 м, маса 0,074 ± 0,010 г. 29 ° C Температура розвитку: самки, довжина 0,017 ± 0,00022 м, маса 0,074 ± 0,0042 г; самці: 0,017 ± 0,00044 м, маса 0,072 ± 0,0023 g).
Продуктивність плавання
Швидкість метаболізму
Ми вимірювали концентрацію кисню в порожній камері під час усіх випробувань, щоб перевірити наявність інших можливих джерел споживання кисню, і, коли це було необхідно, ми віднімали споживання кисню в порожній камері з даних риби. Всі респіометри після використання висушували і регулярно чистили, щоб неприємні наслідки були мінімальними. Обсяг метаболізму обчислювали як різницю між максимальним та швидкістю метаболізму в спокої. У основному тексті ми повідомляємо результати щодо метаболічного обсягу, оскільки це функціонально найбільш релевантно, а в Додатковому матеріалі ми повідомляємо про спокій та максимальні норми споживання кисню, оскільки це вимірювання, що показують, як були отримані значення метаболічного рівня.
Статистичний аналіз
В аналізі для експерименту 1 ми використовували покоління (F1, F2, F3), температуру розвитку (23 або 29 ° C), гостру температуру тесту (18, 26, 32, 36 ° C) та стать (чоловіків та жінок) як фіксовані фактори. В експерименті 2 ми використовували температуру розвитку дідуся (23 або 29 ° C), стать та гострі тестові температури як фіксовані фактори. Ми використовували стандартну довжину як коваріат для аналізу плавних показників, а масу як коваріату для аналізу норм споживання кисню. Крім того, ми використовували ідентифікатор риби як випадковий фактор для обліку повторних вимірювань тієї самої особини при різних температурах тесту, використовуючи модель випадкового перехоплення. Коли секс був значущим, ми проводили подальші аналізи для чоловіків та жінок окремо. Далі ми проаналізували значущі взаємодії, порівнюючи граничні середні та пост-hoc пермутаційні аналізи. В аналізі Ucrit ми додали температуру тесту як квадратичний термін (Тест + Тест ^ 2). На відміну від параметричних моделей ANOVA в R, lmPerm збирає разом відповідні терміни в моделях поверхонь відповіді та виробляє правильний ANOVA, так що "Тест" у наших таблицях результатів для Ucrit представляє квадратичний термін. Ми не використовували квадратичний термін для аналізу рівня метаболізму, оскільки метаболічні реакції на температуру були приблизно лінійними.
Крім того, ми проаналізували індивідуальні криві теплових характеристик Ucrit, щоб перевірити, чи змінюється режим (тобто температура, при якій відбувається максимальна продуктивність) кривих продуктивності внаслідок різних температур розвитку, що вказуватиме на відповідність довкілля або невідповідність поколінь. Ми встановили квадратичні рівняння 43 на кривих теплових характеристик окремих риб, щоб визначити режим. Ми також визначили ширину продуктивності як температурний діапазон, в межах якого риба виконувалась в межах 80% від максимального значення, як описано в 31. Ми проаналізували режим і широту кривих продуктивності за допомогою дисперсійного аналізу. Незалежні фактори були такими ж, як і вище, за винятком температури випробування, яка замість цього використовувалася для розрахунку кривих продуктивності. Зверніть увагу, що режим і ширина кривої продуктивності були розраховані на основі чотирьох вимірів продуктивності плавання у кожної риби. Отже, може бути помилка, пов’язана з оцінками, хоча ми гарантували, що одна і та ж людина проводила випробування з плавання, використовуючи одне і те ж обладнання для кожного вимірювання.
Результати
Експеримент 1: фенотипічні зміни між поколіннями в середовищах
Продуктивність плавання
Чоловіки мали загальну вищу стійку плавальну ефективність (Ucrit), ніж жінки (основний ефект статі, таблиця 1, рис. 2A-B, EF), і існувала тристороння взаємодія між поколінням, температурою розвитку, температурою тесту та статтю, генерацією та температура розвитку (табл. 1).
В окремих аналізах кожної статі Ucrit самок визначали за допомогою тристоронньої взаємодії між поколінням, температурою розвитку та температурою тесту (Таблиця 2; Рис. 2A-B). Аналіз граничних середніх показників показав, що Ucrit риби з температурою розвитку 23 ° C був нижчим, ніж риба з температурою розвитку 29 ° C у поколінні F1 (пост-hoc p 0,9; рис. 2C). Однак у всіх поколіннях Ucrit був вищим у риб, розвинених при 29 ° C, порівняно з тими, що розвивались при 23 ° C при будь-яких тестових температурах (post-hoc all p). Таблиця 2 Пермутаційний аналіз продуктивності плавання та обміну речовин, проведений окремо для чоловіків та самок у Експеримент 1.
Укрит самців визначався взаємодією між генерацією та температурою розвитку (табл. 2; рис. 2Е, Ж), а критрит був значно вищим у риб F2 при обробці 23 ° С порівняно з обробкою 29 ° С (пост-хок р 0,3; рис. 2G). Крім того, суттєва взаємодія між температурами розвитку та тесту (Таблиця 2) показала, що Ucrit у самців при температурі розвитку 23 ° C був значно вищим при температурі 26 ° C та 36 ° C (обидва post hoc p 0,5) порівняно з рибою з обробка 29 ° C (рис. 2H); ця картина була зворотною до тієї, що спостерігається у жінок (пор. рис. 2D).
Криві показників ефективності Ucrit були подібними між процедурами, і не було значних відмінностей між поколіннями, температурами розвитку або статтю в режимі (середнє значення ± se = 30,88 ± 0,33; всі p> 0,15), або в широті продуктивності (середнє значення ± se = 17,16 ± 0,47; усі р> 0,12). Підсумовуючи, Ucrit визначався температурами розвитку, але цей ефект змінювався між поколіннями і відрізнявся між статями, хоча на термочутливість (криві продуктивності) не впливав жоден експериментальний фактор.
Обмін речовин
Подібно до Ucrit, реакції на спокій та максимальні показники споживання кисню (додаткова рис. 1) та метаболізм (рис. 3) різнилися між статями (основні ефекти та взаємодія між статтю та поколінням, температура розвитку та температура тесту (таблиця 2)., Додаткова таблиця 1), щоб ми проаналізували дані чоловіків та жінок окремо. Відпочинок та максимальні показники метаболізму як жінок, так і чоловіків визначалися тристоронніми взаємодіями між генерацією, температурою розвитку та температурою тесту (Додаткова Рис. 1, Додаткова Таблиця 1).
У жінок метаболічний обсяг визначався взаємодією між поколіннями та температурою розвитку (таблиця 2; рис. 3А, Б), а також між температурою розвитку та температурою тесту (таблиця 2, рис. 3А, Б). Діаграми взаємодії показують, що обсяг метаболізму суттєво відрізнявся між способами лікування в поколіннях F1 та F2 (обидва пост-hoc p Таблиця 3 Пермутаційний аналіз продуктивності плавання та обмін метаболізму для чоловіків та жінок в експерименті 2.
Режим кривої температурних характеристик Ucrit (рис. 4D) був вищим у чоловіків із групи дідусів 23 ° C, ніж у групи дідусів 29 ° C, і зворотний випадок був у жінок (рис. 4E, температура дідуся батьків) x статева взаємодія p 0,15; рис. 4F).
Обмін речовин
Споживання кисню у спокої визначалося тристороннім взаємодією між статтю, температурою дідуся та температурою тесту (Додаткова таблиця 3; Додаткова рис. 3). У чоловіків споживання кисню в спокої змінювалося лише з температурою тесту (Додаткова таблиця 4), тоді як у жінок це визначалося взаємодією між дідусятами та температурами тесту (Додаткова таблиця 4, Додаткова фіг. 3A, B). Максимальні норми споживання кисню не відрізнялися між статями, але визначалися взаємодією між дідуськами та температурними показниками (Додаткова таблиця 3; Додаткова фіг. 3C, D).
Суттєвої різниці між статями в обсязі метаболізму не було (табл. 3), але обсяг метаболізму визначався взаємодією між температурою дідуся та температурою тесту (табл. 3; рис. 4С). Порівняно з рибою при лікуванні дідусями 29 ° C, метаболічний обсяг був вищим при 32 ° C (post-hoc p = 0,022) та 36 ° C (post-hoc p = 0,028) тестових температур у риб, отриманих від бабусь і дідусів, вирощених при 23 ° C (рис. 4C).
Обговорення
Різниця між статями, яку ми постійно спостерігали, цікава, оскільки вона показує, що чоловіки та жінки не лише відрізняються за абсолютними значеннями ознак, а й за ступенем впливу цих значень від попередніх поколінь. Чоловічі та жіночі гуппі мають дуже різні траєкторії життєвої історії і по-різному реагують на екологічні процеси, такі як хижацтво 63. Тривалість життя чоловіків коротша, ніж у жінок 64, так що чоловіки можуть також відчувати більш вузький діапазон довкільних умов навколишнього середовища, що може зробити випереджувальні (великі) батьківські наслідки більш вигідними. Крім того, жінки зберігають сперму, що ефективно подовжує репродуктивний вік чоловіків після смерті особи. Було б дуже цікаво дослідити, чи змінює сперма епігенетичний вплив на потомство, оскільки затримка запліднення може збільшити ризик невідповідності навколишнього середовища.
Коди метилювання ДНК встановлюються під час гаметогенезу та під час дуже раннього ембріогенезу 8. Між самцями та самками існують виражені відмінності у розвитку статевих клітин та їх епігенетичному стані 71. Наприклад, у шпаків характер опадів під час раннього розвитку впливав на схеми метилювання ДНК генів глюкокортикоїдних рецепторів специфічно для статі і тим самим по-різному впливав на придатність чоловіків та жінок 72. Отже, навколишнє середовище може по-різному впливати на епігенетичні профілі чоловіків та жінок і тим самим викликати фенотипові траєкторії, характерні для статі, у різних поколінь. Ці гендерні відповіді важливі експериментально, оскільки необхідно чітко розмежовувати стать та екологічно, оскільки зміна навколишнього середовища може мати принципово різний вплив на чоловіків та жінок. Відмінності, які ми спостерігали між статями в пластичності розвитку, будуть важливі для подальшого розвитку, оскільки вони також можуть впливати на динаміку популяцій в мінливих умовах.
Можливо, відбір зіграв певну роль у отриманні наших результатів, припускаючи, що фенотипові ознаки, які ми вимірювали, є спадковими. Наприклад, самки, які краще генетично пристосовані до будь-якої температури розвитку, могли внести більшу частку потомства до наступного покоління. Однак, якби це було так, можна було б очікувати, що зміни фенотипу будуть спрямовані між поколіннями в одному середовищі, і що риби будуть дедалі більше спеціалізуватися на своєму середовищі. Ми рідко спостерігали ці відповіді в наших даних. Однак слід зазначити, що модифікатори розвитку, що опосередковують епігенетичні зміни, такі як ДНК-метилтрансферази (DNMT), самі еволюціонували так, що в епігенетичних відповідях завжди буде присутній генетичний компонент 73. У середовищах, що коливаються між поколіннями, відбір повинен віддавати перевагу модифікаторам, які зменшують фенотипову експресію основної генетичної дисперсії, оскільки реакції на відбір в одному поколінні будуть неадаптивними в наступному 44 .
Наші висновки про те, що наслідки пластичності розвитку проявляються по-різному у різних ознак та статі і не обов’язково збігаються з фенотипами потомства та їхнім середовищем, мають значення для розуміння еволюції пластичності розвитку, оскільки переваги не є настільки чітко визначеними, як це передбачається прогностичною адаптивною гіпотезою, наприклад. Швидше, можливо, що еволюція пластичності розвитку є специфічною для певних ознак і модифікується ролями, які ці риси відіграють в історії життя.
Доступність даних
Повний набір даних подано як додатковий матеріал.
- Вплив дієти господаря та тепловий стан на продуктивність харчування бліх Xenopsylla ramesis
- Пластичність розвитку фізіології та морфології у європейських пташенят махорки, обмежених у харчуванні
- Епігеномні порушення Ефекти раннього впливу на розвиток
- Диференціальний вплив дієтичних схем на вдосконалені кінцеві продукти гликації Рандомізований кросовер
- Ефекти дієти з високим вмістом жиру можуть передаватися протягом трьох поколінь - ScienceDaily