(-) - Епігалокатехін-3-галлат збільшує експресію генів, пов’язаних з окисленням жиру в скелетних м’язах мишей з високим вмістом жиру
Судатіп Сае-Тан
1 Департамент харчових наук, Університет штату Пенсільванія, Університетський парк, штат Пенсільванія, 16802
Кімберлі А. Гай
1 Департамент харчових наук, Університет штату Пенсільванія, Університетський парк, штат Пенсільванія, 16802
Мері Дж. Кеннет
2 Департамент ветеринарних та біомедичних наук, Університет штату Пенсільванія, Університетський парк, штат Пенсільванія, 16802
Джошуа Д. Ламберт
1 Департамент харчових наук, Університет штату Пенсільванія, Університетський парк, штат Пенсільванія, 16802
Анотація
(-) - Епігалокатехін-3-галат (EGCG), основний поліфенол у зеленому чаї, запобігає розвитку ожиріння на моделях гризунів. Тут ми дослідили вплив EGCG на маркери окислення жиру у мишей C57bl/6J з високим вмістом жиру. Миші з високим вмістом жиру, які отримували дієтичну EGCG з використанням 0,32% протягом 16 тижнів, мали зменшення приросту маси тіла та кінцевої маси тіла (19,2% та 9,4% відповідно) порівняно з контролем з високим вмістом жиру. Лікування EGCG знизило рівень глюкози в крові натще, інсуліну в плазмі та резистентності до інсуліну на 18,5%, 25,3% та 33,9% відповідно. Лікування EGCG також зменшило маркери жирової хвороби печінки, пов’язаної з ожирінням, у мишей з високим вмістом жиру. Аналіз експресії генів скелетних м'язів показав, що EGCG підвищує рівні мРНК ядерного респіраторного фактора (nrf) 1, ацил-coA-декарбоксилази середнього ланцюга (mcad), роз'єднуючого білка (ucp) 3 та елемента, що реагує на проліфератор пероксисоми (ppar) α, на 1,4-1,9 -кратно порівняно з контролем з високим вмістом жиру. Всі ці гени пов’язані з окисленням жирних кислот у мітохондріях. Крім того, EGCG збільшив фекальну екскрецію ліпідів у мишей з високим вмістом жиру. Підводячи підсумок, виявляється, що EGCG модулює збільшення маси тіла у мишей з високим вмістом жиру як за рахунок збільшення експресії генів, пов’язаних з окисленням жиру в скелетних м’язах, так і шляхом модуляції засвоєння жиру з дієти.
1.0 Вступ
(-) - Епігалокатехін-3-галлат (EGCG) - найпоширеніший і широко вивчений катехін у зеленому чаї (Camellia sinensis, Theaceae) 1. Попередні дослідження показали, що зелений чай та EGCG пригнічують розвиток ожиріння на лабораторних моделях тварин і можуть модулювати масу тіла у людей [розглянуто в 2].
Показано, що лікування мишей C57bl/6J 0,32% дієтичним EGCG протягом 16 тижнів зменшує збільшення маси тіла, спричинене дієтами, маркери діабету II типу та тяжкість ожиріння, пов’язаного з ожирінням жирової хвороби печінки (ORLFD) 3. Аналіз вмісту ліпідів у фекаліях показав, що лікування ЕГКГ збільшувало екскрецію ліпідів у фекаліях, і що це збільшення суттєво корелювало із зменшенням приросту маси тіла. Ліпаза підшлункової залози є основним ферментом травлення, відповідальним за розщеплення тригліцеридів у тонкому кишечнику 4. Раніше було показано, що EGCG інгібує ліпазу підшлункової залози in vitro 5, 6. Нещодавно ми виявили, що опосередковане EGCG інгібування ліпази підшлункової залози є неконкурентним щодо концентрації субстрату (Grove et al., Неопубліковані результати).
Інші останні дослідження показали, що EGCG та зелений чай можуть модулювати експресію генів, пов’язаних з метаболізмом ліпідів. Наприклад, Клаус та ін. повідомляли, що лікування новозеландських чорних мишей 1% дієтичним EGCG протягом 4 тижнів зменшувало збільшення маси тіла та маси жиру, спричиненого дієтою. Аналіз вмісту фекальної енергії показав, що миші, оброблені EGCG, мали більш високий рівень енергії у фекаліях, ніж контролі з високим вмістом жиру, що вказує на те, що EGCG спричиняє порушення всмоктування споживаної дієти енергії. Автори також повідомили, що EGCG підвищує експресію мРНК роз'єднуючого білка (ucp) 2 та ucp3 у печінці та скелетних м'язах відповідно. Ці гени пов'язані з окисленням жирних кислот, і підвищена експресія може пояснити деякі наслідки дії EGCG на збільшення маси тіла. Лікування EGCG також регулювало кілька генів, пов’язаних із синтезом та зберіганням жирних кислот у печінці та білій жировій тканині, включаючи: стеароїл коА дегідрогеназу 1, яблучний фермент та глюкокіназу. Подібний вплив на експресію генів у жировій тканині спостерігали також у мишей C57bl/6J, які отримували EGCG, з високим вмістом жиру 8 .
Порівняно мало повідомляється про вплив EGCG на експресію генів, пов'язаних з ожирінням в скелетних м'язах. Лікування собак бігль із ожирінням 80 мг/кг, перорально екстракт зеленого чаю перед годуванням протягом 12 тижнів не мав значного впливу на масу тіла або масу жиру, проте знизив рівень тригліцеридів у плазмі та покращив чутливість до інсуліну. Аналіз експресії генів показав, що лікування зеленим чаєм збільшує експресію мРНК активованого проліфератором пероксисоми рецептора (ppar) α та ліпопротеїнової ліпази в м'язі. Не спостерігали значного впливу на рівень мРНК транспортера глюкози 4 9. На відміну від цього, Чен та співавт. Не виявили значного впливу EGCG зеленого чаю на експресію pparα або ucp3 в скелетних м'язах щурів з високим вмістом жиру, яких лікували протягом 27 тижнів 10 .
Відмінності між ефектами, що спостерігаються у собаки, та ефектами, що спостерігаються у щурів, можуть бути результатом різниці в біодоступності поліфенолів чаю у цих видів 11, 12. Абсолютна пероральна біодоступність EGCG у щурів становить лише 1,6%, тоді як у собак пероральна біодоступність набагато вища. Наші попередні дослідження показали, що миша більш схожа на людину, ніж щур, з точки зору біотрансформації та біодоступності EGCG 13, 14. З цієї причини та завдяки широкому використанню моделей мишей для вивчення профілактики ожиріння, ми дослідили експресію кількох генів, пов’язаних з окисленням ліпідів, у скелетних м’язах мишей з високим вмістом жиру. Ми порівняли ці зміни із спостережуваним впливом на фізіологічні маркери ожиріння, діабету ІІ типу та ORLFD. Тут ми повідомляємо результати нашого дослідження.
2.0 Експериментальний
2.1 Хімічні речовини та дієта
EGCG (93% чистоти) був придбаний у компанії Taiyo Green Power Company (Цзянсу, Китай). Дієти були підготовлені компанією Research Diets, Inc. (Нью-Брансвік, Нью-Джерсі), і рецептури раніше повідомлялися 3. Праймери для ПЛР у режимі реального часу були синтезовані Genomics Core Facility при Пенсильванському державному університеті (Університетський парк, штат Пенсільванія). Усі інші хімічні речовини були найвищої категорії, комерційно доступні.
2.2 Тварини та лікування
2.3 Глюкоза в крові натще, інсулін у плазмі та інсулінорезистентність
Вимірювання рівня глюкози в крові натощак реєстрували на 0, 4, 8, 10, 12 та 14 тижнях для кожної групи лікування за допомогою ручного монітора глюкози Contour (Bayer Healthcare, Tarrytown, NY). Мишей голодували протягом 7 год після зміни підстилки в клітці (для запобігання копрафагії) і відбору проб крові з хвостової вени. Інсулін у плазмі натще визначали після завершення експерименту, використовуючи ІФА для інсуліну щурів/мишей (Millipore, Billerica, MA) відповідно до протоколу виробника. Інсулінорезистентність оцінювали за кінцевими значеннями глюкози та інсуліну в крові за допомогою оцінки моделі гомеостазу інсулінорезистентності (HOMA-IR) 15:
2.4 Аналіз хвороби ожиріння жирової печінки, пов’язаної з ожирінням
ORFLD оцінювали як за допомогою біохімічних, так і гістопатологічних методів. Тригліцериди печінки визначали гомогенізацією тканини печінки (50–100 мг) у 2 мл ізопропанолу. Гомогенат центрифугували при 2000 × g протягом 10 хв і супернатант аналізували за допомогою набору тригліцеридів типу L типу (Wako Diagnostics, Річмонд, штат Вірджинія). Концентрації ліпідів нормалізували до вологої маси тканин. Рівні аланінамінотрансферази в плазмі (ALT) визначали за допомогою спектрофотометричного методу (Catachem, Inc., Bridgeport, CT).
Для гістопатологічної діагностики зрізи печінки, зафіксовані формаліном, зневоднювали і вбудовували в парафінові блоки. Зрізи (6 мкм) вирізали і фарбували гематоксиліном та еозином. Зразки були засліплені та прочитані сертифікованим лабораторією ветеринарним ветеринарним лікарем, що має досвід у патології гризунів (MJK). Печінковий ліпідоз, вакуолізацію та вогнищевий некроз визначали як критерії захворювання печінки. Ступінь вираженості ліпідозу визначали напівкількісно на основі ступеня накопичення ліпідів та площі ураження. Ліпідоз оцінювали за шкалою 0 = відсутність значних уражень, 1 = мінімальний (1 - 20%), 2 = незначний (21–40%), 3 = помірний (41–60%), 4 = помітний (61 - 80 %), 5 = важкий (81-100%).
2.5 ПЛР-аналіз у реальному часі експресії генів
Загальну РНК виділяли із зразків м’язів ніг за допомогою реагенту Tri (Sigma) згідно з інструкцією виробника. Кількісну кількість виділеної РНК визначали за допомогою спектрофотометра NanoDrop ND-1000, а кДНК синтезували за допомогою зворотної транскриптази. Після синтезу кДНК проводили ПЛР у реальному часі, використовуючи SYBR Green PCR Master Mix згідно з протоколом виробника та посилюючи на системі виявлення послідовності ABI Prism 7000. Рівні мРНК нормалізувались до β-актину. Стандартні криві були зроблені з використанням серійних розведень з об'єднаних зразків кДНК. Послідовності використовуваних праймерів наведені в таблиці 1 .
Таблиця 1
Послідовності праймерів, що використовуються для ПЛР-аналізу в реальному часі експресії генів у скелетних м’язах мишей з високим вмістом жиру.
| mcad | GAGCCTGGGAACTCGGCTTGA | GCCAAGGCCACCGCAACTTT |
| nrf1 | TGCAGCAGGGAGCCACTGTC | ATGGGCGGCAGCTTCACTGT |
| ucp3 | GAGCGGACCACTCCAGCGTC | TCACCACATCCGTGGGCTGG |
| pparα | ATCGGCCTGGCCTTCTAAAC | TCCCCTCCTGCAACTTCTCA |
2.6 Аналіз ліпідів калу
Зразки фекалій поєднували з деіонізованою водою (1: 2, w: v) та інкубували протягом ночі при 4 ° C. Зразки вихровували і екстрагували двічі рівним об'ємом метанол: хлорформ (2: 1, v: v). Органічну фазу фільтрували через 0,45 мкм мембрану з ПТФЕ і сушили під вакуумом. Залишок зважували і нормалізували до фекальної маси.
2.7 Статистичний аналіз
Усі графіки показують середнє значення ± стандартна помилка середнього значення (SEM). Одностороння ANOVA з пост-тестом Тукі була використана для порівняння коефіцієнта підсилення BW, інсуліну, HOMA-IR, тригліцеридів печінки, ALT, ліпідів у калі та гепатомегалії. Протягом дослідження було використано двосторонній ANOVA з пост-тестом Бонферроні на BW та глюкозу в крові. Статистична значимість була досягнута на с. 16. Загалом, не було значної різниці у споживанні їжі між групами лікування (дані не наведені). ВЧ-лікування значно збільшило кінцеву масу тіла та швидкість приросту маси тіла порівняно з мишами, що годували НЧ (табл. 2). Навпаки, миші з високим вмістом жиру, які отримували EGCG, продемонстрували зниження швидкості приросту маси тіла на 21,7% та зменшення кінцевої маси тіла на 9,4% (p Таблиця 1). Цікаво, що не було значного впливу EGCG на вагу заочеревинних та епідидимальних жирових подушечок (дані не наведені). Ці ефекти на кінцеву масу тіла та збільшення маси тіла подібні до попередньо повідомлених результатів, хоча не такі значні за величиною 3. Причини відмінностей незрозумілі, але це може бути пов'язано з відносно великим стандартним відхиленням, яке спостерігається в експериментах з цією моделлю. Ні кишкові, ні підшкірно-жирові депо не досліджувались, тому можливо, що спостережувані зміни маси тіла корелюють зі змінами цих жирових депо.
Таблиця 2
Вплив лікування EGCG на біологічні маркери ожиріння та типу II у мишей C57BL/6J з високим вмістом жиру, що харчуються дієтою з високим вмістом жиру. *
| Початкова вага тіла (г) | 19,1 ± 0,3 а | 18,8 ± 0,2 а | 18,8 ± 0,3 а |
| Кінцева вага тіла (г) | 31,8 ± 0,7 а | 49,6 ± 0,5 b | 44,9 ± 1,1 c |
| Швидкість збільшення ваги (г/нед.) | 0,9 ± 0,1 а | 2,3 ± 0,1 b | 1,8 ± 0,1 c |
| Глюкоза в крові (мг/дл) | 119,1 ± 5,1 а | 206,7 ± 6,9 b | 168,6 ± 6,1 c |
| Інсулін у плазмі (нг/мл) | 1,2 ± 0,1 а | 6,6 ± 0,3 b | 4,9 ± 0,5 c |
| HOMA-IR | 6,5 ± 0,8 а | 57,2 ± 3,2 b | 37,8 ± 4,4 c |
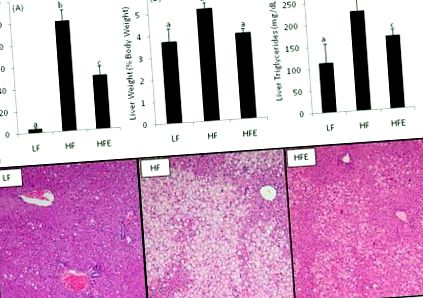
Вплив EGCG на ORFLD у мишей C57bl/6J з високим вмістом жиру. Добавки EGCG знижували рівень АЛТ (A), гепатомегалії (B) та тригліцеридів печінки (C) у плазмі крові після 15-тижневого лікування порівняно з контрольними мишами HF. Стовпчики представляють середнє значення n = 16 - 22. Стовпчики помилок представляють SEM. Різні надрядкові літери вказують на статистично значущі відмінності в односторонньому режимі ANOVA з пост-тестом Тукі. Гістопатологічний аналіз (D) показав, що лікування EGCG зменшує тяжкість та площа печінкового ліпідозу. Фото мікрофотографії репрезентативних зразків печінки показані зі збільшенням у 100 разів.
Гістопатологічний аналіз підтвердив біохімічний діагноз ORFLD (рис. 2D). У HF мишей був важкий відцентровий бульбашний печінковий ліпідоз з вогнищевим некрозом. Миші HFE мали помітно менше накопичення жиру та менші площі ураження. Напівкількісний аналіз печінкового ліпідозу показав зниження оцінки тяжкості з 4,8 ± 0,1 до 3,5 ± 0,5 у мишей HFE (p 2). Хоча попередні дослідження вивчали роль опосередкованих EGCG змін експресії генів у печінці та жировій тканині у профілактиці ожиріння, скелетні м'язи в основному ігнорували. Споживання зеленого чаю було показано як на людях, так і на тваринах для збільшення витрат енергії та зменшення коефіцієнта дихання 7, 17, 18 .
Попередні дослідження показали, що тривале лікування EGCG може збільшити фекальну екскрецію ліпідів. Ми визначали вміст ліпідів у калі гравіметрично і виявили середню концентрацію ліпідів у калі 8,6 та 10,8 мг/г у HF та HFE відповідно. Середній вміст ліпідів у фекаліях значно збільшився на 20,4% при лікуванні EGCG порівняно з контрольною групою HF (p Balentine DA, Wisemanand SA, Bouwens LC. Хімія флавоноїдів чаю. Crit Rev Food Sci Nutr. 1997; 37: 693–704. [ PubMed] [Google Scholar]
- Генетичні поліморфізми в генах, пов’язані з ризикованою поведінкою, що передбачає індекс маси тіла
- Дієтичні емульгатори безпосередньо змінюють склад мікробіоти людини та експресію генів ex vivo
- Дієтично залежне зміна гематоенцефалічного бар’єру в умовах щільної перехідної експресії білка - Reeb -
- Харчові звички, жир в організмі пов’язані з різницею в хімії мозку Національний інститут здоров’я
- Прагнення до жирної їжі Ваші гени - це не ваша доля