Енергетичний обмін при нейророзвитку та медуллобластомі
Кетрін Тех 1,2, Тімоті Р. Гершон 2,3,4
Ключові слова: Медулобластома; гліколіз; ліпогенез; еукаріотичний фактор подовження 2 кіназа (eEF2K)
Надіслано 02 грудня 2014 р. Прийнято до друку 27 січня 2015 р.
Вступ
Метаболічно орієнтована терапія обіцяє запропонувати нещодавно ефективне, менш токсичне лікування медуллобластоми, найпоширенішої злоякісної пухлини мозку в дитинстві. Сучасна терапія залежить від чутливості медуллобластоми до пошкодження ДНК, яке було виявлено більше 50 років тому. Краниоспінальна променева терапія, вперше впроваджена в 1950-х роках, перетворила медуллобластому з однорідного летального захворювання на рак, що піддається лікуванню, із 60% довготривалим виживанням (1). З тих пір десятиліття клінічних випробувань поступово покращували результати, додаючи хіміотерапію, причому 80% пацієнтів зі стандартним ризиком та 70% пацієнтів з високим ризиком виживали більше 5 років (2-6). Однак успіх променевої та хіміотерапії має значні витрати, оскільки ті, хто вижив, повинні жити з неприємними наслідками лікування, включаючи деменцію, ранні інсульти, порушення росту та втрату слуху (7-14). Вижилі також залишаються під загрозою рецидиву, який в даний час невиліковний, і 20-30% пацієнтів з медуллобластомою врешті-решт помирають від хвороби (2,15,16). Пошук нових специфічних для пухлини вразливостей, що доповнюють чутливість до пошкодження ДНК, може дозволити нові підходи до терапії. Недавні дослідження показують, що метаболічна програма медуллобластоми може бути раніше не перевіреною вразливістю.
Тут ми розглядаємо специфічні особливості метаболізму медуллобластоми, які можуть бути спрямовані терапевтично. Деякі метаболічні процеси, типові для медуллобластоми, включаючи посилений ліпогенез та аеробний гліколіз, походять від нервового розвитку. Інші метаболічні процеси, включаючи глобальне пригнічення трансляції білка, можуть не мати чіткого корелятивного розвитку, а можуть бути загальними рисами раку. Ми пропонуємо, щоб ці різноманітні метаболічні процеси взаємопов’язані, як показано на малюнках 1,2, і можуть бути націлені спільно, щоб максимізувати потенційний протипухлинний ефект.
Нервові попередники та клітини медуллобластоми мають різні метаболічні потреби
Медулобластома - це молекулярно неоднорідний набір пухлин, що виникають із мозочка, мають загальні гістологічні закономірності, але виникають із різних наборів нервових родоначальників. Дві молекулярні підгрупи медуллобластоми були пов'язані із сигнальними шляхами розвитку гіперактивації, зокрема Sonic Hedgehog (Shh) та WNT. Відстеження роду у трансгенних мишей демонструє, що активація цих шляхів трансформує різні, але пов'язані набори нейронних родоначальників. Shh гіперактивація обумовлює формування медуллобластоми, особливо у родовідних нейронах гранул мозочка (CGNP), популяції, яка походить від верхньої ромбічної губи (17,18). Активація шляху WNT, у поєднанні з делецією р53, керує утворенням медуллобластоми з попередників стовбура мозку, що походять від нижньої ромбічної губи (19). Мітотичний ефект Shh на CGNP і онкогенний ефект гіперстимуляції шляху Shh забезпечують ідеальну експериментальну платформу для вивчення метаболічних закономірностей, коли нервові попередники розмножуються і дають початок пухлинам, що походять від попередників.
І нервові попередники, і пухлинні клітини стикаються з проблемами метаболізму, що відрізняє їх від інших клітин мозку. Усі клітини споживають енергію, підтримуючи гомеостаз, а всі клітини мозку виробляють енергію з глюкози, кетонів та амінокислот. Нейрони, які є постмітотичними клітинами, є найбільшими споживачами енергії мозку, витрачаючи енергію на підтримку електричної активності та міжклітинного зв'язку (20, 21). Тому ефективність генерації АТФ може мати надзвичайно важливе значення. Однак потреба в ефективному утворенні АТФ у проліферуючих клітинах мозку може бути врівноважена додатковими метаболічними потребами.
На відміну від постмітотичних нейронів, проліферативні клітини повинні не тільки витягувати енергію з субстратів, але й метаболізувати ці субстрати в нуклеїнові кислоти, білки та ліпіди для їх потомства (22). У перші 2 післяпологові тижні у мишей та в перший рік життя у людини мозочок є місцем швидкої проліферації, оскільки CGNP діляться у відповідь на сигналізацію Shh. Проліферація CGNP породжує найбільшу популяцію нейронів мозку. Що стосується високопроліферативних CGNP, то генерація проміжних продуктів для синтезу ліпідів, нуклеїнових кислот і білків може конкурувати за пріоритет із подальшим генеруванням АТФ. Клітини високоякісних пухлин, включаючи медуллобластому та гліобластому, повинні аналогічним чином збалансувати енергетичний метаболізм з необхідністю синтезу макромолекул, необхідних для росту пухлини. Навпаки, пухлини нижчого класу можуть не вимагати постійного накопичення біомаси, а тому можуть надавати пріоритет виробництву АТФ. Різні метаболічні потреби проліферативних і непроліферативних популяцій клітин відповідають глибоким відмінностям у їх механізмах метаболізму поживних речовин.
Нервові клітини-попередники налаштовують метаболізм на підтримку ліпогенезу
Поряд з індукцією проліферації, Shh індукує ліпогенез у CGNP через механізм, який зберігається в медулобластомі (23-25). На рівні регуляції транскрипції активація шляху Shh вгору регулює білки, необхідні для синтезу ліпідів, включаючи синтазу жирних кислот (FASN) та ацетил-CoA карбоксилазу 1 (ACC1), і знижує регуляцію ферментів катаболізму жирних кислот, включаючи ацил-CoA оксидазу 1 (ACOX1) та середньоланцюгової ацил-КоА дегідрогенази (MCAD). Ці транскрипційні зміни відображаються змінами в метаболічній активності CGNP, продемонстрованих in vitro, де Shh зменшує окислення жирних кислот CGNP (24). Транскрипційна регуляція ферментів метаболізму ліпідів у CGNPs координується Shh-залежною активацією E2F1 за допомогою модуляції Rb (24). Завдяки цій системі Shh індукує як посилений циклічний цикл, так і посилений ліпогенез, забезпечуючи тим самим, що біосинтез макромолекул поєднується з проліферацією. Подібним чином, Shh додатково індукує зміни в метаболізмі глюкози для підтримки біосинтезу.
Аеробний гліколіз дозволяє нервовим родоначальникам збалансувати потреби в енергії та біосинтезі
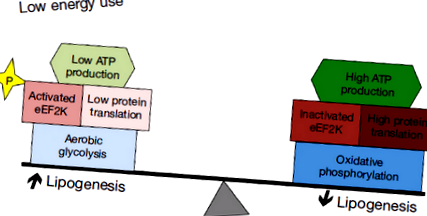
Глюкоза є основним джерелом енергії в мозку. Завдяки окисному фосфорилюванню глюкоза може метаболізуватися до H2O та CO2 для утворення 38 АТФ на молекулу. Як варіант, глюкоза може метаболізуватися до пірувату за допомогою гліколізу, зрештою, утворюючи лактат і 2 АТФ. Аеробний гліколіз - це метаболізм глюкози до лактату, незважаючи на наявність достатньої кількості кисню, необхідного для окисного фосфорилювання. Клітини з великими потребами в АТФ, швидше за все, будуть у неблагополучному стані аеробним гліколізом, оскільки гліколіз генерує менше АТФ на молекулу глюкози, ніж окисне фосфорилювання. Проте проліферуючі клітини можуть використовувати аеробний гліколіз для задоволення конкуруючих потреб як у виробництві енергії, так і в накопиченні біомаси (рис. 1). На відміну від окисного фосфорилювання, яке перетворює глюкозу в H2O та CO2, аеробний гліколіз також утворює проміжні речовини метаболізму, які можуть бути використані для біосинтезу ліпідів та нуклеїнових кислот (26). Відповідно до їх різних енергетичних потреб, нейрони та нейронні попередники використовують специфічні набори ферментів, що метаболізують глюкозу, що сприяють або окисному фосфорилюванню, або аеробному гліколізу.
Диференційовані нейрони та нейрогенні попередники метаболізують глюкозу, використовуючи різні набори гліколітичних ферментів. Гексокінази каталізують фосфорилювання глюкози, перша модифікація глюкози при надходженні в клітину. Існує чотири гени ссавців, що кодують гексокінази (Hk1-4). Hk1 експресується нейронами та глією у всьому мозку, але виключається з областей нервових родоначальників (27). На відміну від цього, передача сигналу Shh індукує експресію Hk2 у CGNP (27). Далі за гликолітичним шляхом Shh індукує сплайсинг ферменту піруваткінази в ізоформу M2 (PkM2) (23,28).
У різних типах клітин Hk2 та PkM2 пов'язані з аеробним гліколізом, а метаболомічний аналіз демонструє, що Shh викликає аеробний гліколіз у CGNP (23,27). Поглинання мозочка та генерація лактату особливо збільшуються в період постнатального нейрогенезу мозочка, а CGNP, культивовані в присутності Shh, збільшують споживання глюкози та утворення лактату без збільшення споживання кисню (27). Генетична делеція Hk2 в CGNP заблокувала індукований Shh аеробний гліколіз, демонструючи центральну роль Hk2 у налаштуванні метаболізму CGNP у відповідь на сигналізацію Shh.
Посилений ліпогенез та аеробний гліколіз при медуллобластомі
Злоякісні клітини пухлини головного мозку, як і нейронні попередники, є дуже проліферативними і повинні задовольняти конкуруючі потреби у виробленні енергії за допомогою катаболізму поживних речовин і перетворенні поживних речовин у макромолекули, необхідні для росту. Регулятори транскрипції та ферменти, що опосередковують посилений ліпогенез та аеробний гліколіз у CHNP, стимульованих Shh, також контролюють метаболізм пухлинних клітин на мишачих моделях медуллобластоми, керованої Shh. Лінії мишей ND2: SmoA1 та SmoM2 експресують різні конститутивно активні алелі ефектора Shh, що згладжуються та розвивають спонтанні медуллобластоми. Ці пухлини демонструють підвищену регуляцію FASN, активацію E2F1 та відкладення крапель ліпідів, що свідчить про високу швидкість синтезу ліпідів (24), та підвищену регуляцію Hk2 та PkM2, що узгоджується з посиленим аеробним гліколізом (23,27). Гліколітичний метаболізм медуллобластоми додатково продемонстрований 18 дослідженнями FDG PET, які показують інтенсивну глюкозну придатність медуллобластом як у мишей, так і у людей, навіть у порівнянні із типово високим вмістом глюкози в мозку (27,37).
Аеробний гліколіз та ліпогенез як загальні ознаки для всіх типів пухлин головного мозку
Порушення ліпогенезу або гліколізу обмежує ріст пухлини мозку
Обмеження енергетичних витрат при медуллобластомі забезпечує метаболізм пухлини
Механізми, що обмежують споживання енергії, дозволяють пухлинам максимізувати ліпогенез та отримати оптимальну користь від аеробного гліколізу. Хоча метаболізм глюкози за допомогою гліколізу підтримує направлення поживних речовин у біосинтез, неефективне вироблення АТФ представляє ризик, якщо порушується доступність поживних речовин. Мінімізація споживання енергії пухлини може зменшити цей ризик. Чисте перетворення глюкози в ліпіди також є відповідальністю, якщо не можна зменшити енергетичні потреби. Нещодавно був описаний механізм обмеження енергетичних витрат пухлини шляхом інгібування трансляції мРНК, який виявився активним при медуллобластомі (49). Цей механізм може бути важливим для того, щоб дозволити пухлинним клітинам повноцінно брати участь у ліпогенних та гліколітичних механізмах нервових родоначальників без відповідальності за дефіцит енергії (Рисунок 1).
Еукаріотичний фактор подовження еукаріотичний фактор подовження 2 (eEF2) відіграє важливу роль у трансляції, сприяючи GTP-залежній транслокації зростаючого пептидного ланцюга вздовж рибосоми (50). Активність eEF2 регулюється вниз за допомогою фосфорилювання за допомогою еукаріотичного фактора подовження 2-кінази (eEF2K) (51). У свою чергу, eEF2K активується датчиком енергії AMPK (52,53). Експресія eEF2K негативно корелює з виживаністю пацієнтів як у медуллобластомі, так і в гліобластомі, що свідчить про те, що зменшення активності eEF2 сприяє росту пухлини (49). Відповідно до цієї інтерпретації, порушення експресії eEF2K у ксенотрансплантованих клітинних лініях спричинило сенсибілізацію пухлин до дефіциту поживних речовин, змушуючи пухлини у мишей, що харчуються з обмеженим вмістом калорій, рости повільніше та зі збільшенням загибелі клітин пухлини (49).
Комбінаторне націлювання на метаболізм пухлини
Що цікаво, білок датчика внутрішньоклітинної енергії AMPK являє собою точку зближення між цими різними процесами (рис. 2). AMPK надає гомеостатичний ефект, інтегруючи ліпогенез, вироблення енергії та трансляцію білка. Однак націлювання на AMPK може бути проблематичним, оскільки активація та інгібування AMPK можуть мати неоднозначний вплив на ріст. Активація AMPK пригнічує ліпогенез за рахунок інгібуючого фосфорилювання ACC1 (59-61), що може обмежити ріст пухлини. Відповідно до супресивного ефекту пухлини, делеція Hk2 викликала активацію AMPK у GFAP-cre: медуллобластомах SmoM2, уповільнюючи ріст пухлини (27). Однак активація AMPK також фосфорилює eEF2K, що може сприяти зростанню, обмежуючи витрати енергії (51,62). Для того, щоб порушити гомеостатичний ефект інтеграції, опосередкованої AMPK, може бути найефективнішим спрямовувати одночасно на ліпогенез, eEF2K та аеробний гліколіз. Кетогенна дієта в поєднанні зі специфічними інгібіторами Hk2 та/або eEF2K може досягти цієї мети та оптимально націлити метаболізм пухлини.
Подяки
Фінансування: Тімоті Р. Гершон підтримується грантами Національного інституту охорони здоров’я (NIH; 1K08NS077978-01), Фонду Св. Болдріка та Американського інституту досліджень раку.
Виноска
Конфлікт інтересів: Автори не мають заявляти про конфлікт інтересів.
- Енергетичний метаболізм та склад тіла у дослідженнях харчування та здоров’я - Вища школа Vlag
- Витрати енергії під час перегодовування Харчування; Повний текст метаболізму
- Ендокринологія, діабет та метаболізм Відділення педіатрії
- Вплив ультра оброблених проти необроблених дієт на споживання енергії - Повний текст
- Перегодовування фруктозою у родичів першого ступеня хворих на цукровий діабет 2 типу впливає на енергію