Ендогенно окислена мітохондріальна ДНК індукує запальні реакції in vivo та in vitro
Департамент ревматології та досліджень запалення, Університет міста Гетеборг, Швеція; і
1 Листування: Департамент ревматології та досліджень запалення, Університет міста Гетеборг, Guldhedsgatan 10A, 41346 Гетеборг, Швеція. Електронна пошта: [email protected]
Департамент ревматології та досліджень запалення, Університет міста Гетеборг, Швеція; і
Кафедра клінічної хімії, Університетська лікарня Салгренська, Гетеборг, Швеція
Департамент ревматології та досліджень запалення, Університет міста Гетеборг, Швеція; і
Департамент ревматології та досліджень запалення, Університет міста Гетеборг, Швеція; і
Департамент ревматології та досліджень запалення, Університет міста Гетеборг, Швеція; і
1 Листування: Кафедра ревматології та досліджень запалення, Університет міста Гетеборг, Guldhedsgatan 10A, 41346 Göteborg, Швеція. Електронна пошта: [email protected]
Департамент ревматології та досліджень запалення, Університет міста Гетеборг, Швеція; і
Кафедра клінічної хімії, Університетська лікарня Салгренська, Гетеборг, Швеція
Кафедра ревматології та досліджень запалення, Університет міста Гетеборг, Швеція; і
Департамент ревматології та досліджень запалення, Університет міста Гетеборг, Швеція; і
Анотація
Ми повідомляємо, що мітохондріальна ДНК (mtDNA) є запальною хворобою in vitro та in vivo в результаті присутності неметильованих послідовностей CpG та її окисного статусу. Очищені людські та мишачі мтДНК індукували артрит при внутрішньосуглобовому введенні мишам. Важливо, що олігодезоксинуклеотид, який містив одну окисно пошкоджену основу, також викликав артрит при введенні внутрішньовенно. у мишей. На відміну від цього, ні людська, ні мишача ДНК не викликали запалення. Індукований мтДНК артрит не залежав ні від В-клітин, ні від Т-клітин, але опосередковувався моноцитами/макрофагами. Індукований mtDNA ядерний фактор κκB призвів до утворення фактора некрозу пухлини α, потужного артритогенного фактора. Нарешті, позаклітинна мтДНК була виявлена в синовіальних рідинах хворих на ревматоїдний артрит, але не у контрольних суб’єктів. Ми прийшли до висновку, що ендогенна мтДНК виявляє запальні властивості внаслідок вмісту неметильованих мотивів CpG та окисно пошкоджених аддуктів.
ВСТУП
Оскільки мтДНК є мішенню пошкодження вільними радикалами внаслідок своєї близькості до ланцюгових реакцій переносу електронів і оскільки опосередковані вільними радикалами пошкодження мтДНК відновлюються з низькою ефективністю, ми досліджували внесок окисно пошкодженої ДНК в артритогенність. Дійсно, олігонуклеотид, у якого відсутні мотиви CpG, але який містив єдиний 8-гідрокси-2'-дезоксигуанозин (8-оксидG), був запальним у природних умовах in vivo. На противагу цьому, олігодезоксинуклеотид (ODN) з точно такою ж послідовністю, за винятком того, що в ньому не було окисленого залишку, був повністю інертним in vivo.
МАТЕРІАЛИ І МЕТОДИ
Підготовка зразка ДНК
мтДНК екстрагували з мітохондрій ізольованих м'язів людини та з мишачих (штаму NMRI) м'язів та мітохондрій печінки, по суті, як описано раніше [6]. нДНК екстрагували з ядер, виділених з печінки мишей ЯМР, по суті, як описано [7]. Фрагменти ампліфікованої полімеразною ланцюговою реакцією (ПЛР) ПЛР-I та ПЛР-II людської мтДНК отримували за допомогою праймерів 5'-TAGAAACCGTCTGAACTATC-3 '(вперед) та 5'-CCACAGATTTCAGAGCATT-3' (реверс) для ПЛР-I та 5′ ‐ CACATTACAGTCAAATCCCT ‐ 3 ′ (вперед) та 5′ ‐ TTGTATTGATGAGATTAGTA ‐ 3 ′ (реверс) для ПЛР-II. Ампліфіковані фрагменти ДНК відповідають послідовностям від нуклеотиду (nt) 7171 до nt 7611 (PCR ‐ I; 421 bp) та nt 15761 до nt 16487 (PCR ‐ II; 727 bp) в геномі мітохондрій людини (номер приєднання GenBank X93334; [8]). Продукти ПЛР очищали за допомогою набору для очищення ПЛР (Boehringer Mannheim, Мангейм, Німеччина) і відновлювали у забуференному фосфатом сольовому розчині (PBS) перед внутрішньосуглобовим (i.a.) введенням (5 мкг на колінний суглоб) мишам ЯМРТ. GpC – ODN, 5′-TCCATGAGCTTCCTGATGCT ‐ 3 ′ та oxoGpC – ODN, 5′ ‐ TCCATGAXCTTCCTGATGCT ‐ 3 ′, де X = 8 ‐ oxodG, були синтезовані за допомогою SGSDNA (Стокгольм, Швеція).
Ін’єкції ДНК у мишей
Зразки мтДНК, нДНК та ODN (20 мкл об., що містить 5 мкг ДНК або 10 нмоль ODN) вводили i.a. в колінах у самок мишей віком від 6 до 8 тижнів [миші BALB/c з ALAB, Стокгольм, Швеція; CB17 та миші з важким комбінованим імунодефіцитом (SCID) від M&B, Bomholtvej, Данія; NMRI миші від B&K, Universal AB, Соллентуна, Швеція]. Всі тварини були розміщені в приміщенні для тварин відділення ревматології та досліджень запалення в Університеті Гетеборг (Швеція) у стандартних умовах. Ін'єкційних мишей вбивали через 3 або 14 днів, а суглоби видаляли для гістопатології та імуногістохімії.
Виснаження імунних клітин in vivo
У самок мишей ЯМР виснажили моноцити периферичної крові шляхом лікування етопозидом (Bristol Myers Squibb AB, Bromma, Швеція), який вводили підшкірно (sc) у дозі 12,5 мг/кг щодня, починаючи за 2 дні до ін'єкції ДНК, і продовжували протягом курсу експерименту (3 дні). Це лікування вибірково виснажує моноцити, як було продемонстровано раніше [9]. Контрольні миші отримували s.c. ін’єкції PBS. Самки мишей BALB/c (віком 6–8 тижнів) виснажували гранулоцити шляхом внутрішньочеревної (i.p.) попередньої обробки 1 мг моноклонального антитіла (mAb) RB6‐8C5 [10] за 2 год до внутрішньоутробного введення. ін'єкції мтДНК. Контрольним мишам попередньо обробляли mAb щурячого анти-овальбуміну (анти-OVA) імуноглобуліну G (IgG).
Гістопатологія та імуногістохімія суглобів мишей
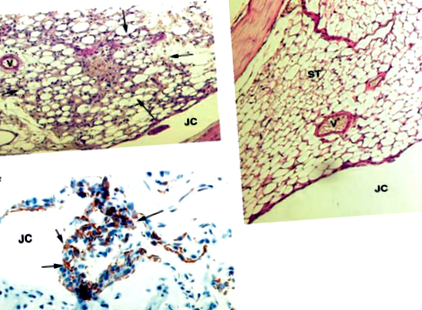
Гістопатологічне та імуногістохімічне дослідження суглобів мишей проводили, як описано раніше [4]. Тяжкість артриту на ділянках колінного суглоба оцінювали сліпим спостерігачем і оцінювали за шкалою 0–3, де 0 = відсутні ознаки запалення, 1 = легке запалення, що характеризується гіперплазією синовіального шару оболонки, і 2–3 = підвищення рівня запалення, що характеризується припливом запальних клітин у синовіальну тканину. Для довідкових цілей, суглоб, показаний на рис. 1а, оцінюється як бал 2, а показник на малюнку 1б оцінюється як 0.
Антисмисловий ODN до ядерного фактора (NF) ‐κB
Експресія субодиниці p65 NF κB була заблокована у самок мишей NMRI i.p. введення 900 мкг антисмислового ODN, 5'-GAAACAGATCGTCCATGGT-3 ', або невідповідного контрольного ODN, 5'-GAAACAGATCGTCTATGGT-3', за 2 дні до i.a. ін'єкція мтДНК. Ці модифіковані фосфоротіоатом ODN були синтезовані CyberGene AB (Huddinge, Швеція). У гістопатологічних зрізах суглобів мишей, яким вводили внутрішньовенно, не спостерігали артриту. з антисмисловим або невідповідним ОДН у дозі 900 мкг на мишу.
Вимірювання фактора проліферації та фактора некрозу пухлини α (TNF ‐ α)
Наївні клітини мишачої селезінки від чотирьох окремих мишей ЯМР інкубували у концентрації 2 × 10 6 клітин/мл у середовищі Іскове, що містить 10% фетальної телячої сироватки. Клітини культивували при 37 ° С у 5% СО2 у присутності 10 мкг/мл мтДНК, 10 мкг/мл нДНК або лише середовища протягом 24 год (аналіз TNF-α) або протягом 68 год (аналіз проліферації). 24-годинні супернатанти культури аналізували на вироблення TNF-α за допомогою імуноферментного аналізу (ELISA; R&D Systems, Міннеаполіс, Міннесота). Для вивчення реакцій на проліферацію 68-годинні культури імпульсували 3 H-тимідином протягом 4 годин, клітини збирали на фільтри та вимірювали включення 3 H-тимідину в β-лічильник.
Аналіз синовіальних рідин людини
РЕЗУЛЬТАТИ
mtDNA-індукований артрит (MDIA)
Єдиний i.a. ін'єкція 5 мкг mtDNA в колінні суглоби мишей ЯМР викликала протягом 3 днів гістопатологічні зміни, які характеризувались потовщенням синовіальної мембрани та інфільтрацією мононуклеарних клітин (Рис. 1а), стан, який зберігався щонайменше 14 днів. Запалення не було у всіх контрольних суглобах, яким вводили внутрішньовенно. з нДНК з печінки миші (рис. 1b) або носія (PBS). Гістохімічне фарбування суглобів MDIA виявило наявність мононуклеарних фагоцитарних клітин Mac1 + і Mac3 + (рис. 1в) та повну відсутність CD4 + та CD8 + Т-лімфоцитів. Частота артриту, що спостерігалася у мишей, яким вводили мтДНК, становила 70–80%. Ми також обрали дві області генома мітохондрій людини з різними частотами CpG для ампліфікації ПЛР: PCR-I (22 CpG у фрагменті 421 bp) та PCR-II (22 CpG у фрагменті 727 bp). Обидва фрагменти, ампліфіковані ПЛР, індукували MDIA після i.a. ін'єкція мишам (Рис.2). MDIA може бути тиражований i.a. ін’єкція мтДНК у три різні штами мишей (NMRI, CB17 та BALB/c) та у тварин різного віку (7 тижнів та 9 місяців) і не залежала від джерела, тобто м’язів миші/людини або тканин печінки миші ( дані не відображаються).
Ролі вродженого та набутого імунітету в MDIA
Виснаження гранулоцитів у мишей ЯМР призвело до зменшення частоти MDIA з 91% до 55% (P= 0,055), але не мали суттєвого впливу на ступінь тяжкості MDIA (табл. 1). MDIA може індукуватися з приблизно однаковими частотами в суглобах мишей SCID з дефіцитом Т і В-клітин або їх конгенічним контрольним штамом CB17 (Таблиця 1). В цілому ці дані вказують на те, що вроджена, але не набута імунна відповідь є ключовою у стимулюванні MDIA.
i.a. ін'єкція ODN, що містить окислений нуклеотид
Для вивчення впливу окисного пошкодження на артритогенний потенціал ми порівняли запальність двох синтетичних 20-мерних ODN, одного з центральним дезоксигуанозином (GpC – ODN), а іншого - із 8-оксидним G залишком, заміщеним цим дезоксигуанозином (oxoGpC – ODN ). При внутрішньовенному введенні GpC-ODN, як очікувалося, не викликав запалення в суглобах мишей, тоді як oxoGpC-ODN провокував артрит у 25/27 випадках (Рис.5). Слід зазначити, що у невеликій кількості випадків було важке запалення суглобів, що характеризується утворенням пануса та/або руйнуванням кісток. Отже, включення одного окисно пошкодженого нуклеотиду різко вплинуло на здатність викликати запалення. Оскільки мтДНК зазвичай містить окислені нуклеотиди, залишки 8-oxodG у виділених фрагментах мтДНК або виділених під час відновлення пошкоджень, ймовірно, сприяють цьому типу запалення.
Аналіз синовіальних рідин людини
Щоб дослідити потенційний зв’язок між наявністю позаклітинної мтДНК та запальними явищами у запалених суглобах людини, ми піддали ПЛР-аналізу зразків SF від 54 хворих на РА на наявність вільної (позаклітинної) мтДНК. Використовувані ПЛР-праймери були розроблені для ампліфікації фрагмента ДНК 456 bp в області геному мтДНК людини між nt 16031 і nt 16487. ПТР-ампліфікована mtDNA була виявлена у 38/54 (70%) зразків SF у пацієнтів з РА і в 0/17 (0%) контрольних зразків.
ОБГОВОРЕННЯ
Зниження частоти та тяжкості MDIA у мишей, виснажених гранулоцитами, було менш вираженим, ніж ефект виснаження моноцитів, що вказує на те, що нейтрофіли відіграють менш помітну роль у цьому запаленні. В і Т-клітини, здається, не беруть участі в цьому стані, виходячи з того, що MDIA може бути індукована у мишей SCID та CB17 з однаковою частотою та тяжкістю. Крім того, гістохімічне фарбування зрізів імунокомпетентних суглобів мишей ЯМР, яким вводили мтДНК, виявило повну відсутність Т-клітин, що експресують CD4 і CD8.
Ми розглядали, чи може ендогенна ДНК сприяти руйнівним процесам у господаря шляхом ініціювання аутозапалення. Нещодавно було постульовано, що розвиток аутоімунітету може відбутися у відповідь на вивільнення аутоантигенів під час загибелі клітин [26]. Ендогенна мтДНК, що виділяється з клітин, що зазнають некрозу, могла активувати макрофаги для утворення прозапальних цитокінів і тим самим брати участь у артритному процесі. Наше обстеження зразків СФ у пацієнтів свідчить про те, що мтДНК присутня в більшості суглобів РА і відсутня в суглобах суб'єктів, які не страждають на артрит. Хоча припускати, що мтДНК, виявлена в цих суглобах, бере участь у запаленні, може бути передчасним, існують вагомі вказівки на те, що ендогенні клітинні компоненти сприяють запальним захворюванням. Потрібна подальша робота, щоб визначити остаточну роль мтДНК в артриті людини.
На сьогоднішній день було витрачено багато зусиль на виявлення бактеріальної ДНК у запалених суглобах людини [27, 28], і наш недавній звіт чітко показує, що бактеріальна ДНК може викликати артрит у мишей [4]. У цьому дослідженні ми чітко показали, що мтДНК є імуностимулюючою, а також здатною викликати артрит у мишей. Видається ймовірним, що наявність безклітинної мтДНК посилює запалення, стимулюючи вироблення прозапальних цитокінів, створюючи тим самим порочне коло запалення та руйнування клітин та прискорюючи вивільнення додаткової ендогенної, прозапальної ДНК. У конкретному випадку артриту можуть бути передбачені такі терапії, як лікування нуклеазами або антисмислами, які мінімізують або протидіють впливу позаклітинної mtDNA на суглоби.
Гістопатологічний та імуногістохімічний аналіз MDIA. (а) Гістопатологія колінного суглоба миші ЯМР через 3 дні після внутрішньовенного введення. ін'єкція 5 мкг мишачої мтДНК, що походить з м'язової тканини. Інфільтрація одноядерних клітин очевидна. (b) Гістопатологія колінного суглоба миші ЯМР через 3 дні після внутрішньовенного введення. ін'єкція 5 мкг нДНК. Суглобові тканини здаються нормальними. (c) Імуногістохімія колінного суглоба, яку обробляли, як зазначено вище (а), показуючи синовіальне розширення клітин, що експресують Mac1 (коричневий). JC, порожнина суглоба; V, судина; ST, синовіальна тканина; стрілки, запальні клітини в синовії.
Ефекти i.a. ін'єкція цілих мтДНК та фрагментів мтДНК на розвиток артриту у мишей. Захворюваність на артрит у колінних суглобах мишей ЯМР, яким вводили внутрішньо з PBS (n = 10), 5 мкг нДНК печінки миші (n = 13), 5 мкг мтДНК м’язів мишей (n = 43) або 5 мкг кожного з ампліфікованих ПЛР фрагментів мітохондріального геному людини: PCR ‐ I ( n = 5) або ПЛР-II (n = 5). Мишей вбивали через 3 дні після ін’єкції ДНК, а колінні суглоби оцінювали гістопатологічно на ступінь тяжкості синовіту. Статистично значущі відмінності (∗∗∗, P
| Моноцити | Етопозид s.c./ ЯМР | 25/n = 8 ∗ | 0,19 ± 0,13 ∗ |
| Контроль | PBS s.c./NMRI | 75/n = 8 | 0,69 ± 0,16 |
| Гранулоцити | mAb RB6‐8C5 i.p./BALB/c | 55/n = 11 нс | 0,73 ± 0,26 нс |
| Контроль | mAb анти-OVA i.p./BALB/c | 91/n = 11 | 1,09 ± 0,20 |
| Т і В-клітини | Немає/SCID | 100/n = 5 нс | 1,0 ± 0,0 нс |
| Контроль | Немає/CB17 | 80/n = 5 | 0,8 ± 0,20 |
- a Всі миші отримували один раз внутрішньовенно. ін'єкція 5 мкг мтДНК. Миші ЯМР виснажували моноцити за допомогою s.c. ін’єкція етопозиду. Елементи контролю, отримані PBS. Мишей BALB/c виснажували гранулоцити за 2 год до отримання мтДНК i.p. ін'єкція IgA mAb RB6‐8C5, і контрольні миші отримували i.p. ін'єкції IgG mAb анти-OVA. Миші SCID з дефіцитом T і B та їх вроджені контролі CB17 не отримували попередньої обробки. Всіх мишей забивали через 3 дні після отримання мтДНК, а частоту та тяжкість артриту в суглобах оцінювали за гістопатологією. Значення, виражені для тяжкості артриту, є середніми значеннями ± sem. Статистичну значимість визначали за допомогою точного тесту Фішера (частота артритів) або неспареного тесту Стьюдента т‐ Тест (тяжкість артриту). ns, Несуттєво;
- ∗ P
Антисмислова терапія, спрямована проти NF κB, впливає на ступінь тяжкості MDIA. ЯМР-мишам вводили i.p. з NF κκB антисмисловим або невідповідним ODN (n = 12 на групу) за 2 дні до i.a. ін’єкція в колінний суглоб з мтДНК м’язів миші (5 мкг). Мишей вбивали через 3 дні після ін'єкції ДНК, а колінні суглоби досліджували гістопатологічно на предмет оцінки тяжкості артриту. Статистично значущі відмінності (∗, P
Індукція вироблення TNF-α в культурах спленоцитів миші шляхом додавання мтДНК. Рівні TNF-α (пг/мл) вимірювали методом ІФА у 24-годинних супернатантах мишачих спленоцитів від чотирьох окремих мишей, де клітини не обробляли (▵) або стимулювали 10 мкг/мл мтДНК (•) або 10 мкг/мл нДНК (○).
Ефекти i.a. ін'єкція мишам ODN, які містять або не мають жодного залишку 8-oxodG. Мишам ЯМР вводили ін'єкційно. з 10 нмоль неартритогенних GpC – ODN (n = 10) або оксоGpC – ODN (n = 27). Мишей вбивали через 3 дні, гістопатологічно досліджували колінні суглоби та визначали частоту артритів. Відмінності у захворюваності на артрит між цими двома групами були статистично значущими (**, P
ПОДЯКИ
Цю роботу підтримали гранти Шведської асоціації проти ревматизму, Шведської мережі проти запалення, Фонду Нанні Сварц, Фонду короля Густава V, Шведської ради з медичних досліджень та Програми Біотехнології Комісії ЄС (BIO4CT97‐5130). Ми дякуємо Ylva Nyberg, Margareta Attström та Margareta Verdrengh за чудову технічну допомогу, Mary Jo Wick за допомогу з мишами та Kristina Eriksson за корисну критику.
- Вплив argentum nitricum (AgNO3) як у системах in vivo, так і in vitro Журнали відкритого доступу
- Проектування, виготовлення, характеристика in vivo та in vitro нового вбудовування ниток PLGA
- Змінена функція мітохондрій через зміни до дієти до та після пологів у овець American Journal
- Зміни запального раку ендометрія ризикують біомаркерів у осіб, які перебувають на хірургічному втручанні
- Ефекти швидкого та поетапного переїзду в нове середовище на лошат; відповіді на відлучення