Вплив argentum nitricum (AgNO3) як в системах in vivo, так і in vitro
Департамент біотехнологій, Університет Бурдвана, Бурдван-713104, Західна Бенгалія, Індія
* Автор-кореспондент: Атану Конер
Кафедра біотехнології,
Університет Бурдвана,
Burdwan-713104, Західна Бенгалія, Індія.
Електронна пошта: [електронна пошта захищена]
Отримано:14.11.2013 Прийнято: 30/11/2013 Опубліковано: 12.12.2013
Відвідайте для отримання додаткових статей за адресою Дослідження та огляди: Науковий журнал біології
Анотація
Ключові слова
Ріст бактерій та грибів, центральна догма, еукаріотичне тіло, гомеопатична потенція.
Вступ
Argentum nitricum, також відомий як нітрат срібла (AgNO3), - це неорганічна сполука, яка використовується як антисептичний засіб завдяки своїм антисептичним властивостям. Загальна назва Argentum nitricum - камінь пекла або камінь диявола. Його готують шляхом розчинення нітрату срібла у спирті для утворення материнської настоянки. Лікарське використання нітрату срібла сягає середньовіччя, коли його застосовували як антисептик та їдкий засіб для лікування ран. Сьогодні нітрат срібла все ще використовується при лікуванні бородавок, хоча і не є загальним явищем. Легке отруєння все ще відбувається при лікуванні бородавок, даючи деяке уявлення про токсичність цієї сполуки. Симптомами легкого отруєння є занепокоєння та збудження, спочатку доведене Ганеманом та знову Мюллером у 1845 р.
Найважливіше дію на кров, виробляючи антипластичний ефект, роблячи її більш рідкою і темною; червоні тільця втрачають забарвлення; кров застоюється в судинах, і харчування заважає. Задіяні також нервові центри, що породжує різні симптоми мозкового та хребетного розладу. Нітрат срібла застосовується для усунення різних типів розладів, таких як нервозність, побоювання, розлади травлення, астма та тривога. Його ефективність лежить в діапазоні від 6c до 200c. Особливе терапевтичне використання цього гомеопатичного препарату ідеально підходить для середніх віків, коли воно використовується як антисептик разом з їдким для боротьби з травмами.
Матеріали і методи
Виділення геномної ДНК з бактеріальних та грибкових джерел
Грам позитивний - Bacillus sp. (MTCC-2497) та грамнегативну - кишкова паличка (BL-12) використовували як штами бактерій і вирощували протягом ночі на бульйоні LB, переносили в мікропробірку для центрифуги та центрифугували. Гранулу ресуспендували в ТЕ-буфері (Tris-EDTA, pH 8,0). Додавали 10% SDS і інкубували. Суміш фенол-хлороформ (1: 1) додавали і перемішували. Суміш центрифугували при 10000 об/хв. Верхню водну фазу переносили в нову пробірку і повторно екстрагували рівним об'ємом фенол-хлороформу. Суміш знову центрифугували при 10000 об/хв. Верхній водний розчин брали і змішували з 3М ацетатом натрію (рН 5,2), додавали ізопропанол і обережно перемішували для осадження ДНК. Знову проводили центрифугування при 10000 об/хв для осадження ДНК. ДНК промивали 70% етанолом протягом 30 секунд і короткочасно центрифугували. ДНК ресуспендували в буфері ТЕ.
Брали грибний бульйон (YEPD) і 0,5 М суспензійний буфер (Tris Cloride, pH-7,5) змішували разом з частинками піску і витримували на льоду протягом 15 секунд. Додавали 1% SDS і інкубували. Пробірки центрифугували і додавали фенолхлороформну суміш (1: 1) з наступним центрифугуванням. До супернатанту додавали 3М ацетат натрію (рН 5,5) з негайним додаванням абсолютного спирту. Потім його поміщали в морозильну камеру при -20 ° C на 30 хв. Після охолодження проводили центрифугування і гранули промивали 70% етанолом. Нарешті він був призупинений у буфері TE.
Агарозний гелевий електрофорез ДНК
Агарозний гель (0,8%) отримували розчиненням у 1Х буфері TAE. Гребінець вставляли перед заливанням гелю. Гель залишали на 30-40 хвилин для затвердіння і гребінець видаляли з гелю. Бак для електрофорезу, що містить гель, заповнювали 1X буфером електрофорезу TAE. 1 об'єм буфера для зразків змішували з 5 обсягами зразка ДНК. Зразки наносили на лунки, утворені в гелі. Бромід етидію в концентрації 0,5 мкг/мл вводили в гель. Електроди підключили і протягом 1 години подавали струм 70 вольт. Після електрофорезу гель візуалізували під ультрафіолетовим світлом.
Додецилсульфат натрію (SDS) -гель-електрофорез:
SDS-гель-електрофорез проводили згідно з методикою, яку дотримувались Konar та співавт. (2013). Для цього були зібрані пластини SDS. Гель, що розділяє акриламід, готували в конічній колбі і розливали між пластинами. Приготували акриламідний гель для укладання. Компоненти змішували і заливали розділяючим гелем. Колодязі готували за допомогою гребінців. Зразки готували з рівним об'ємом буфера зразків. Потім зразки нагрівали на киплячій водяній бані і завантажували. Напруга подавалась залежно від розміру гелю. Гелю давали працювати, поки зразок не досягне дна розсмоктуючого гелю. Потім електроживлення відключили; гель видаляли з апарату. Гелю давали фарбуватися протягом ночі. Наступного дня гель занурювали в розчин для знежирення і спостерігали.
Робота in vivo:
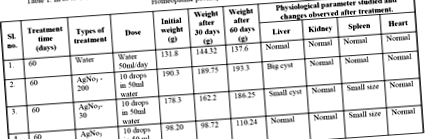
Взяли чотирьох щурів-альбіносів, яких обробляли спиртом для контрольного набору, argentum nitricum Mother, argentum nitricum potency-30, argentum nitricum potency-200. Через 60 днів їх приносили в жертву та вивчали різні фізіологічні параметри, такі як наявність або відсутність кісти, зміна розміру органів та наявність будь-яких інших відхилень у роботі печінки, серця, селезінки та нирок (таблиця 1). Вивчено їх фенотипові та гематологічні показники. Кров брали з серця на предметному склі, фарбували плямою Лейшмана, промивали водою і спостерігали під мікроскопом.
Таблиця 1: В умовах in vivo було вилучено чотирьох щурів-альбіносів; вивчались різні фізіологічні параметри та ефекти в різних гомеопатичних потенціях
Результати та обговорення
Три результати спостерігалися в умовах in vitro, тобто ріст бактерій, ліки від бактерій та гомеопатії, ліки від грибків та гомеопатії. Коли бактерії ростуть нормально, спостерігалося збільшення значення оптичної щільності щодо часу. Коли бактерії ростуть разом з гомеопатією, оптична щільність, згадана в таблиця 2 зменшується, оскільки гомеопатичні потенції пригнічують ріст бактерій, тому зменшення значення оптичної щільності спостерігалось у грамнегативних бактерій, тоді як грампозитивні бактерії спостерігали поступове збільшення. Була вивчена центральна догма, і наявність (+) або відсутність (-) смуги ДНК (електрофорез у агарозному гелі) та білка (SDS-PAGE) згадується в таблиця 3.
Таблиця 2: Оптична щільність при 400 нм культур бактерій і грибів
Таблиця 3: Результат електрофорезу в агарозному гелі та SDS-PAGE
Від Фігура 1, можна зробити висновок, що гомеопатичні ліки не мали значного впливу на ріст грибів, оскільки їх ріст залишався статичним. Графік спочатку рухався вгору через нормальний ріст бактерій/грибків, потім він зменшувався (бактерицидний/фунгіцидний) або перебував у стаціонарній фазі через гомеопатичну потенцію.
Фігура 1: Вплив Argentum nitricum на гриби
Дивно, що гомеопатичні ліки не пригнічували ріст грампозитивних бактерій, оскільки вони виявляють свою активність росту noraml із збільшенням оптичної щільності (малюнок 2). З іншого боку, спостерігалося пригнічення росту грамнегативних бактерій гомеопатичним препаратом, що свідчить про зниження оптичної щільності (малюнок 3).
Малюнок 2: Вплив Argentum nitricum на грампозитивні бактерії
Малюнок 3: Вплив Argentum nitricum на грамнегативні бактерії
Мікроскопічний огляд кров'яної плівки показав, що клітини, які були оброблені argentum nitricum з потенцією-200, мають усадку, а решта з них не показала значних змін (малюнок 4).
Малюнок 4: Мікроскопічний слайд; (а) предметне стекло для плівки крові для контролю, (b) предметне стекло для плівки крові з AgNO3-200
Лікування мишей argentum nitricum призвело до утворення кісти в печінці (малюнок 5). У мишей, які отримували ліки з більшим розведенням (потенція - 200), виявлялося більше числа кіст, оскільки вона легше засвоювалась клітинами свого тіла в порівнянні з ліками з меншим розведенням (потенція - 30).
Малюнок 5: Розтин мишей; (а) одинарна кіста в печінці мишей, які отримували потенцію AgNO3 30 (b) подвійна кіста у печінці мишей, які отримували активність AgNO3 - 200.
Малюнок 6: Гістологічний вигляд; (а) органи мишей використовували як контроль, (б) органи мишей обробляли AgNO3-30, (в) обробкою AgNO3-200 і (d) обробляли неочищеним AgNO3
Висновок
Метою експерименту було вивчення впливу гомеопатичного препарату argentum nitricum на еукаріотичну та прокаріотичну системи. Як in vitro, так і in vivo показали детоксикацію гомеопатичної потенції. Але грампозитивні бактерії демонстрували постійне збільшення оптичної щільності з часом через певні невідомі причини. Також у стані in vivo спостерігались деякі фізіологічні зміни, такі як зменшення розміру селезінки та утворення кісти у оброблених альбіносів проти необроблених. Також спостерігались деякі фенотипічні зміни, такі як випадання волосся та раптова зміна ваги. Оскільки ми всі знаємо, що гомеопатичний препарат не має побічних ефектів, але з цього експерименту ми можемо зробити висновок, що гомеопатичний препарат не є безпечним для тривалого застосування.
- Проектування, виготовлення, характеристика in vivo та in vitro нового вбудовування ниток PLGA
- Вплив міждисциплінарної допомоги на втрату ваги у рандомізованому контрольованому дослідженні BMJ Open
- Ендогенно окислена мітохондріальна ДНК індукує запальні реакції in vivo та in vitro -
- DailyMed - ДОБРОЧНЕ ДОБАВЛЕННЯ - альбом veratrum, argentum nitricum, colocynthis, pulsatilla nigricans,
- Репресії щодо доступу до суперплатників для оплати медичних процедур