Емульсія ліпідів
Однією з них є ліпідні емульсії, які можуть покращити біодоступність препарату, збільшуючи проникність рогівки та/або збільшуючи час утримання препарату на очній поверхні.
Пов’язані терміни:
- Спинномозкова анестезія
- Глюкоза
- Ліпідний
- Настій
- Парентеральне харчування
- Соєва олія
- Риб'ячий жир
- Токсичність
- Захворювання печінки
- Недоношеність
Завантажити у форматі PDF
Про цю сторінку
Щорічне всесвітнє опитування нових даних щодо побічних реакцій на ліки
Суджана Донтукурті,. Джоель Ярмуш, у щорічній роботі про побічні ефекти наркотиків, 2015 рік
Ефективність реанімації за допомогою Інтраліпіду
Емульсію ліпідів вводили щурам з тимчасовою серцево-судинною токсичністю, індукованою бупівакаїном. Швидкість відновлення бачилася в наступному порядку: 30% ліпідна емульсія> 20% ліпідна емульсія> нормальний фізіологічний розчин> відсутність лікування. Автори застосували фармакокінетичне та фармакодинамічне моделювання, щоб переконатись, що ліпідна емульсія надає первинний кардіотонічний ефект на серце, а також викликає вторинне фізичне всмоктування місцевого анестетика (тобто теорія ліпідної раковини) [16 H]. Це дослідження доповнило попереднє модельне дослідження, в якому було викладено теорію поглинання ліпідів і встановлено, що теорія поглинання ліпідів не є єдиним впливом ліпідної емульсії на місцеві анестетики [17 H].
Отруєння серцево-судинними препаратами
Аарон Б. Сколник, доктор медичних наук, Сьюзен Р. Вілкокс, доктор медицини, у “Критичні секрети догляду” (п’яте видання), 2013
9 Як працює терапія внутрішньовенною ліпідною емульсією (ІЛП)?
Терапія ІЛЕ використовує внутрішньовенне введення 20% ліпідної емульсії як полівалентного антидоту при отруєнні ліпофільними препаратами. Емульсія, спочатку розроблена для парентерального харчування, може діяти як "раковина" в плазмі для ліпофільних препаратів. У різних моделях тварин та повідомленнях про випадки захворювань людей виявляється, що ліки секвеструються в межах цієї ліпідної фази і, таким чином, запобігають дії на потенційні органи-мішені, такі як мозок та серце. Інші теоретичні механізми дії включають забезпечення вільним жирним кислотним паливом голодуючих серцевих мітохондрій та збільшення припливу кальцію в серцеві міоцити. Велика кількість даних, що зростає, демонструє переваги ІЛЕ для декількох типів кардіотоксичних препаратів, включаючи блокатори натрієвих каналів, блокатори кальцієвих каналів та деякі β-блокатори. Подумайте про те, щоб надати ліпідну емульсію будь-якому отруєному пацієнту, який проковтнув високорозчинний у ліпідах препарат і має значну гемодинамічну нестабільність.
Гепатобіліарні ускладнення кишкової недостатності та домашнє парентеральне харчування
Анжеліка Хайберс, доктор медицини, магістр, Герт Дж. Вантен, доктор медичних наук, магістр, у галузі синдрому короткого кишечника для дорослих, 2019
Дефіцит вітаміну Е
ІЛВ служать насамперед як джерело енергії та ЕФК у пацієнтів з кишковою недостатністю. Однак ІЛЕ є також головним джерелом вітаміну Е (токоферолу) у пацієнтів із ПН. Вітамін Е є основним ліпід-розчинним антиоксидантом і зустрічається у кількох ізоформах, з яких α-токоферол виявляє найвищу біоактивність щодо зменшення перекисного окислення ліпідів (Xu et al., 2015). Беручи до уваги тенденцію до порушеного (анти) окислювального балансу при ПН-залежності та патогенного ефекту перекисного окислення ліпідів при розвитку та/або прогресуванні ІФАЛД, дефіцит вітаміну Е було запропоновано як потенційну причину ІФАЛД. Кількість і типи гомологів вітаміну Е в комерційно доступних ІЛЗ значно різняться, внаслідок випуску олій, що використовуються для виробництва емульсій, а також завдяки додаванню екзогенного α-токоферолу, який можна додавати до ІЛЕ для мінімізації окислення ФА (Vanek та ін., 2012; Xu та ін., 2015).
На сьогоднішній день навряд чи якесь дослідження оцінювало прямий вплив вітаміну Е в різних ІЛ на захворювання печінки. Одне дослідження досліджувало вплив вітаміну Е на частоту розвитку ІФАЛД у недоношених парентерально вигодованих поросят (Ng et al., 2016). Альфа-токоферол у ІЛ на основі FO та додавання α-токоферолу до ІЛ на основі SO запобігали збільшенню біліарних та ліпідемічних маркерів IFALD у сироватці та печінці, тоді як додавання фітостеролів до ІЛ на основі FO не дало доказів IFALD, надаючи деякі докази того, що низький рівень вітаміну Е бере участь у розвитку IFALD. Однак ці результати не були знайдені в дослідженні на тваринах, проведеному на доношених поросятах новонароджених (Muto et al., 2017).
Харчова підтримка у дитячого хірургічного пацієнта
Даніель Х. Тейтельбаум,. Арнольд Г. Коран, у дитячій хірургії (сьоме видання), 2012
Емульсії ліпідів
Внутрішньовенні ліпідні емульсії є конденсованим джерелом енергії та незамінних жирних кислот, забезпечуючи 9 ккал/г енергії. Калорійність ліпідних емульсій змінюється залежно від концентрації ліпідної емульсії. Емульсії ліпідів при концентраціях 10%, 20% та 30% дають 1,1 ккал/мл, 2 ккал/мл та 3 ккал/мл відповідно. На сьогоднішній день внутрішньовенні ліпідні емульсії, що продаються в США, виготовляються з довголанцюгових тригліцеридів (LCT). Ліпіди зазвичай забезпечують від 30% до 50% потреб у калоріях, що не містять азоту, або приблизно від 20% до 30% від загальної кількості калорій. Як правило, ліпідні емульсії у немовлят та дітей починають застосовувати у дозі 1 г/кг/добу та збільшують на 1 г/кг/день до максимум 3 г/кг/добу. Поступове збільшення добового споживання ліпідів (0,5 або 1 г/кг/день), схоже, не покращує кліренс ліпідів. Однак ліпідна емульсія очищається краще 128, 129, а використання ліпідів покращується 130, коли ліпіди вводять безперервно протягом 24 годин, а не періодично або протягом доби. Утримання швидкості внутрішньовенної інфузії ліпідів нижче 0,12 г/кг/годину покращує кліренс ліпідів.
Існують також відмінності між кліренсами ліпідних емульсій. 20% ліпідної емульсії віддають перевагу, а не 10% емульсії, через кращий кліренс внаслідок зниження вмісту фосфоліпідів. 131, 132 Оскільки ліпідні емульсії отримують з рослинних олій, вони також є природним джерелом змінної кількості ізомерів вітаміну К 133 та вітаміну Е. 134, 135
Щорічне всесвітнє опитування нових даних та тенденцій щодо побічних реакцій та взаємодій з лікарськими засобами
Жирові емульсії
Метаболічні ускладнення домашнього парентерального харчування та синдрому короткого кишечника
Manpreet S. Mundi MD,. Райан Т. Херт, доктор філософії, при синдромі короткого кишечника для дорослих, 2019
Аномалії ліпідного профілю
Передумови та фізіологія
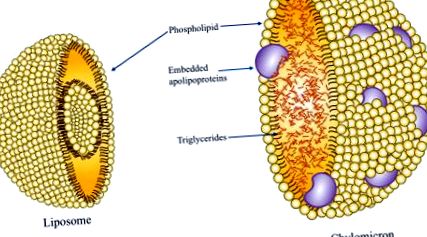
Внутрішньовенна ліпідна емульсія (ILE), особливо соєва олія (SO) на основі ILE, може бути пов'язана зі змінами ліпідного профілю, включаючи зменшення ліпопротеїдів високої щільності (HDL) та збільшення ліпопротеїдів низької щільності (LDL) та тригліцеридів (TG) рівні (Meguid et al., 1989; Mundi, Salonen and Bonnes, 2016). ILEs, як правило, складаються з TG, отриманих з джерела олії, такого як SO, оливкова олія (OO), риб'ячий жир (FO), тригліцерид із середнім ланцюгом (MCT) або комбінація різних масел. Емульгатор фосфоліпідів, отриманий з яєчного жовтка, служить для обволікання серцевини TG і дозволяє йому залишатися розчинним у водній суміші PN у вигляді хиломікроноподібної частинки (рис. 9.2) (Ferezou and Bach, 1999; Vinnars and Hammarqvist, 2004). Для того, щоб забезпечити, щоб середній діаметр хіломікрон-подібних частинок не перевищував 500 нм, додають надлишок емульгатора (Ferezou and Bach, 1999). Надлишок емульгатора існує у формі багатих фосфоліпідів частинок, які, по суті, є одношаровими ліпосомами (бішар фосфоліпідів, що уловлюють сліди ліпідів і водної фази).
Рисунок 9.2. Частиця хіломікрону, що містить фосфоліпідний прошарок із вбудованими аполіпопротеїнами, холестерином та внутрішнім ядром тригліцеридів. Ліпосома, що складається з фосфоліпідного бішару.
Ці ліпосоми відіграють значну роль у порушеннях ліпідного обміну. Вони отримують холестерин і аполіпопротеїни з ЛПВЩ в обмін на фосфоліпіди, що призводить до зменшення вимірюваних рівнів ЛПВЩ (Ferezou and Bach, 1999). Крім того, здатність ЛПВЩ поглинати фосфоліпіди є насичуваною, що призводить до накопичення ліпосом у плазмі з надмірною швидкістю інфузії (Breckenridge, 1985; Ferezou and Bach, 1999). Якщо ліпосоми плазми не метаболізуються ліпопротеїн-ліпазою (LPL) та печінковою ліпазою (HL), вони продовжують збагачуватися холестерином до досягнення співвідношення фосфоліпідів до холестерину 2: 1. На даний момент вони проявляють характеристики ліпопротеїну-X (LP-X) і з часом призводять до гіперхолестеринемії (Miyahara et al., 1979). Рівні LP-X також залежать від частки фосфоліпіду до TG у інфузії. Таширо та ін. (1992) продемонстрували, що 10% емульсія пов'язана з більш високим рівнем LP-X порівняно з 20% емульсіями, оскільки 10% (інтраліпідна) емульсія має більшу кількість вільних ліпосом і менший діаметр (Garcia-de-Lorenzo et al., 2003). Циркулюючі вільні ліпосоми також пригнічують дію LPL і HL на штучні хіломікрони, що призводить до поганого гідролізу TG, що спричиняє гіпертригліцеридемію (Lutz et al., 1990).
Стратегії управління
Основною стратегією лікування аномалій ліпідного профілю, пов’язаних з HPN, є забезпечення недопущення надмірної ІЛЕ та належного рівня, щоб забезпечити достатній кліренс, особливо у людей із ожирінням (Mundi et al., 2016). Крім того, використання 10% ІЛЕ різко скоротилося, оскільки 20% є найпоширенішим використанням концентрації в даний час. 20% ІЛП, як правило, мають більший розмір частинок і нижчий коефіцієнт фосфоліпідів до TG, що призводить до швидшого кліренсу (Lutz et al., 1989; Hailer et al., 1998).
Використання альтернативних джерел ТГ також можна дослідити, отримавши нещодавнє схвалення змішаної нафти (MO) ILE (Smoflipid Fresenius Kabi, Бад-Хомбург, Німеччина; 30% SO, 30% MCT, 25% OO та 15% FO) у Сполучені Штати. Хайлер та ін. (1998) порівняли використання 10% проти 20% концентрації SO ILE або комбінації MCT/SO ILE та повідомили, що найвищі рівні LDL разом із підвищеним рівнем холестерину в групі отримують 10% SO ILE та найменші рівні LP -X у групі отримують 20% MCT/SO. Ретроспективний аналіз 38 пацієнтів, які перейшли з OO ILE на MO ILE через гіпертригліцеридемію (≥250–400 мг/дл), показав, що рівень ТГ знизився у 94,7% пацієнтів із середнім зниженням 71 мг/дл (Mateu-de Антоніо та Флорит-Суреда, 2016). Три перспективні рандомізовані дослідження, що порівнювали MO ILE з SO та OO/SO ILE, показали нижчий рівень TG у групі MO ILE, тоді як три додаткових дослідження не виявили відмінностей (Schlotzer and Kanning, 2004; Mertes et al., 2006; Piper et al., 2009; Tomsits et al., 2010; Metry et al., 2014; Wu et al., 2014). Незважаючи на те, що більшість цих досліджень мають обмеження щодо невеликого обсягу вибірки, безпека з точки зору впливу на рівень ліпідів очевидна із застосуванням емульсій MO ILE у порівнянні зі звичайними формулами.
Мідазолам
Гематологічні
Емульсії жиру впливають на згортання та фібриноліз [63]. У 36 пацієнтів, які перенесли аортокоронарні шунтування з анестезією на основі мідазоламу/фентанілу або пропофолу/альфентанілу, концентрація фактора XIIa та калікреїноподібна активність були приблизно на 30% вищими у групі пропофолу. Автори припустили, що була сильніша активація контактної фази на початку рециркуляції та сильніший фібриноліз у групі пропофолу. Вони також виявили більше гіпотонії в групі пропофолу, яка, як вони вважали, зумовлена вивільненням калікреїну, що призводить до вивільнення брадикініну. Не доведено, що пропофол спричиняє посилення періопераційної кровотечі.
У 40-місячного хлопчика абстинентний синдром із неврологічними симптомами супроводжувався тромбоцитозом, який досяг максимуму 1230 × 10 9/л [64]. Одужання від абстинентного синдрому супроводжувалося нормалізацією кількості тромбоцитів. Значимість цієї зміни кількості тромбоцитів не була чіткою. Хлопчику також було призначено фентаніл, і автори припустили, що комбінацію мідазоламу з фентанілом слід застосовувати з обережністю.
Парентеральне харчування
Емульсії ліпідів
Внутрішньовенні ліпідні емульсії, які зазвичай отримують із сафлорової олії, соєвої олії або їх комбінації, доступні у 10% (1,1 ккал/мл), 20% (2,0 ккал/мл) і 30% (3 ккал/мл) концентрації. Більш високі концентрації мають ту перевагу, що надають вищу енергетичну цінність при меншому обсязі рідини. Їх можна змішувати з декстрозою та амінокислотами в 3-в-1 або ТНК у різних концентраціях, якщо дотримуються певних вказівок. 30% ліпідна емульсія дозволена лише для приготування суміші, а не для безпосереднього введення. Ліпіди знижують осмоляльність і, отже, їдкий характер високих концентрацій декстрози, що використовуються при парентеральному харчуванні.
У CPN ліпідні емульсії слід застосовувати принаймні один або два рази на тиждень для запобігання дефіциту незамінних жирних кислот (EFA). Безперервна інфузія концентрованої декстрози та послідовне постійне підвищення рівня інсуліну можуть запобігти мобілізації запасів жирової тканини ендогенних жирних речовин, що призводить до біохімічних ознак дефіциту EFA протягом 1 або 2 тижнів. Емульсії ліпідів запобігають цьому. Коли існує чітке протипоказання до використання ліпідних емульсій (що трапляється вкрай рідко), столова ложка рослинної олії, наприклад, сафлорової олії, щодня втирається на шкіру може запобігти дефіциту ОЖВ, але цього може бути недостатньо для виправлення існуючий дефіцит.
Щоденне споживання ліпідів є обов’язковим при використанні PPN, оскільки практично неможливо задовольнити потреби в енергії за допомогою більш розведених розчинів глюкози, необхідних для PPN. Без достатньої кількості небілкових калорій введені амінокислоти будуть окислюватися, щоб забезпечити енергією. Це перемагає одну з головних цілей парентерального харчування, яка полягає у задоволенні всіх метаболічних потреб. Крім того, парентеральне харчування є більш фізіологічним, якщо ліпіди забезпечуються щодня як джерело небілкової енергії, як показано у Вставці 14-2 .
У деяких пацієнтів включення ліпідів як щоденного джерела енергії є особливо корисним. Пацієнти з непереносимістю глюкози можуть досягти кращого контролю рівня глюкози і вимагати менше інсуліну, коли вводиться менше декстрози. Кахектичні пацієнти накопичують худу масу тіла ефективніше і мають менший ризик розвитку ускладнень перегодовування, викликаних глюкозою, таких як гіпофосфатемія (див. Розділ 11). Пацієнти з вентиляційною недостатністю та затримкою СО2 можуть отримати користь від того, що менша продукція СО2 пов'язана з окисленням ліпідів, ніж з окисленням глюкози (див. Розділ 24).
IV ліпідні емульсії мають дуже мало побічних ефектів, і документація про побічні ефекти часто складається лише з одного або двох повідомлень про окремі випадки. Хоча потенційно серйозна, гіперчутливість (повідомляється як задишка, гіперемія, біль у грудях, біль у спині та кропив'янка) є досить рідкісною, щоб не виправдовувати застосування невеликих тестових доз перед інфузією ліпідів. Гіпоксемія може посилитися швидкою інфузією ліпідів, якщо кліренс циркулюючих тригліцеридів затримується. Однак це ускладнення майже завжди можна запобігти, вводячи ліпіди протягом 12 - 24 годин. Рівень тригліцеридів у сироватці крові, що перевищує 500 мг/дл, може спричинити панкреатит, тому розумно задокументувати прийнятні рівні принаймні один раз під час інфузії ліпідів.
Поширене припущення, що стандартні дози ліпідних емульсій (наприклад, 500 мл 10% ліпідів на день) спричиняють або посилюють порушення функції печінкових ферментів або жирові відкладення в печінці, є недостатньо обгрунтованим. Пов’язані з TPN, ці аномалії, як правило, є результатом постійної, а іноді надмірної доставки глюкози, яку ліпідні емульсії можуть полегшити. (Див. “Ускладнення” далі в цьому розділі).
Ліпіди як джерело енергії для недоношених та доношених новонароджених
Жирне та загальне парентеральне харчування (TPN)
Внутрішньовенні жирові емульсії давали новонародженим немовлятам протягом декількох років. Немає сумнівів, що частина внутрішньовенно введених жирів використовується як джерело енергії, про що свідчать зміни в концентраціях вільних жирних кислот і кетонових тіл 35,36 та зміни коефіцієнта дихання. 36–38 Навіть коли активність ліпопротеїнової ліпази порушується протягом перших днів життя (особливо при низькій вазі при народженні та невеликій кількості для немовлят), збільшення кетонових тіл 35 свідчить про те, що окислення жиру відбувається під час загального парентерального харчування. В даний час рекомендується вводити внутрішньовенно жир у дозі від 1 до 3 г/кг/день, що дається постійно протягом 20 - 24 годин. 39 Однак невідомо, скільки влитого ліпіду окислюється.
Деякі дослідження показали, що окислення внутрішньовенного жиру може корелювати із загальним споживанням енергії. Як показано на малюнку 42-1, із збільшенням споживання калорій відсоток окислених калорій, одержуваних з жиру, зменшується. Ми досліджували це явище у двох груп немовлят, які внутрішньовенно вводили глюкозу, амінокислоти та ліпіди 40 (табл. 42-4); Дослідницька група I отримувала 102 + 12 ккал/кг/добу, а ІІ група - 73 + 4 ккал/кг/добу як небілкова енергія. Всіх немовлят досліджували за допомогою непрямої калориметрії за допомогою розімкнутої системи протягом декількох годин. Результати цього дослідження вказують на те, що зі збільшенням споживання енергії в раціоні (навіть із збільшенням жиру) зменшується частка енергетичних витрат, одержуваних в результаті окислення жиру, і чиста кількість окисленого жиру. Ця інформація корелює з експериментальними даними у дорослих, які демонструють, що підвищена швидкість окислення глюкози супроводжується зниженою швидкістю окислення одночасно введених ліпідів. 41 Коли важливу частину споживання енергії дають як глюкозу, ймовірно, що окислення глюкози погіршить використання ліпідів як палива під час TPN. Цікаво відзначити, що подібне спостереження було зроблено у немовлят, які харчуються перорально (див. Таблицю 42-1).
Спостереження, що збільшення споживання жиру не супроводжується більш високим ступенем окислення жиру, коли загальне споживання енергії означає, що може бути недоцільно збільшувати кількість внутрішньовенних ліпідів під час загального парентерального харчування (принаймні, коли споживання енергії не білками перевищує Від 80 до 90 ккал/кг/добу). Коли загальне споживання небілкової енергії буде нижчим, можливо, буде окислюватися більше жиру і, отже, буде забезпечуватися більше енергії. Дійсно, Рубеч та його колеги 38 продемонстрували вищу швидкість окислення жиру, коли внутрішньовенне введення жиру було єдиною енергією, і в цій експериментальній конструкції 85% влитого жиру окислювалось.
- Гіперінсулінемія - огляд тем ScienceDirect
- Легкий клапан - огляд тем ScienceDirect
- Лактитол - огляд тем ScienceDirect
- Лактитол - огляд тем ScienceDirect
- Низькокалорійні продукти - огляд тем ScienceDirect