Екстракт листя лотоса та L-карнітин впливають на різні процеси протягом життєвого циклу адипоцитів
Ральф Зігнер
1 Дослідження та розробка, Дослідження спеціального догляду за шкірою, Beiersdorf AG, Unnastrasse 48, Bf. 520, 20245, Гамбург, Німеччина
Стефан Хойзер
1 Дослідження та розробка, Дослідження спеціального догляду за шкірою, Beiersdorf AG, Unnastrasse 48, Bf. 520, 20245, Гамбург, Німеччина
Урсула Гольцман
1 Дослідження та розробка, Дослідження спеціального догляду за шкірою, Beiersdorf AG, Unnastrasse 48, Bf. 520, 20245, Гамбург, Німеччина
Йорн Шеле
1 Дослідження та розробка, Дослідження спеціального догляду за шкірою, Beiersdorf AG, Unnastrasse 48, Bf. 520, 20245, Гамбург, Німеччина
Андреас Щепки
1 Дослідження та розробка, Дослідження спеціального догляду за шкірою, Beiersdorf AG, Unnastrasse 48, Bf. 520, 20245, Гамбург, Німеччина
Томас Рашке
1 Дослідження та розробка, Дослідження спеціального догляду за шкірою, Beiersdorf AG, Unnastrasse 48, Bf. 520, 20245, Гамбург, Німеччина
Франц Штеб
1 Дослідження та розробка, Дослідження спеціального догляду за шкірою, Beiersdorf AG, Unnastrasse 48, Bf. 520, 20245, Гамбург, Німеччина
Горст Венк
1 Дослідження та розробка, Дослідження спеціального догляду за шкірою, Beiersdorf AG, Unnastrasse 48, Bf. 520, 20245, Гамбург, Німеччина
Марк Віннефельд
1 Дослідження та розробка, Дослідження спеціального догляду за шкірою, Beiersdorf AG, Unnastrasse 48, Bf. 520, 20245, Гамбург, Німеччина
Анотація
Передумови
Клітинні та молекулярні механізми біології жирової тканини широко вивчалися протягом останніх двох десятиліть. Ріст жирової тканини передбачає як збільшення розміру жирових клітин, так і утворення зрілих адипоцитів з клітин-попередників. Щоб дослідити, як природні речовини впливають на ці два процеси, ми дослідили вплив екстракту листя лотоса (розчину екстракту Nelumbo nucifera, отриманого від Silab, Франція) та L-карнітину на людські преадипоцити та адипоцити.
Методи
Для досліджень in vitro ми використовували розчин екстракту листя лотоса окремо або в поєднанні з L-карнітином. Використовуючи культивовані людські преадипоцити, ми дослідили індуковане інсультом введення екстракту листя лотоса тригліцеридів під час адипогенезу та можливі наслідки для життєздатності клітин. Були проведені дослідження на людських адипоцитах з метою з'ясування ефективності розчину екстракту листя лотоса для стимулювання ліполітичної активності. Для подальшої характеристики опосередкованих розчином екстракту листя лотоса ми визначили експресію визначення коефіцієнта транскрипції адипоцитів та фактора диференціації 1 (ADD1/SREBP-1c) на рівні РНК та білка за допомогою qRT-PCR та імунофлюоресцентного аналізу. Крім того, вплив L-карнітину на бета-окислення аналізували за допомогою людських преадипоцитів та зрілих адипоцитів. Нарешті, ми дослідили адитивні ефекти комбінації розчину екстракту листя лотоса та L-карнітину на накопичення тригліцеридів під час диференціації преадипоцитів/адипоцитів.
Результати
Наші дані показали, що інкубація преадипоцитів з розчином екстракту листя лотоса суттєво зменшила накопичення тригліцеридів під час адипогенезу, не впливаючи на життєздатність клітин. Порівняно з контролем, адипоцити, інкубовані з розчином екстракту листя лотоса, демонстрували значне збільшення активності ліполізу. Більше того, популяції клітин, культивовані в присутності розчину екстракту листя лотоса, продемонстрували зниження здатності диференціювати адипоцити, як свідчить зменшення сигналу ADD1/SREBP-1c. Важливо, що наші результати продемонстрували, що комбінація розчину екстракту листя лотоса та L-карнітину зменшує накопичення тригліцеридів більшою мірою порівняно з інкубацією з будь-якою з цих речовин.
Висновки
Загалом, наші дані демонструють, що комбінація екстракту листя лотоса та L-карнітину зменшує накопичення тригліцеридів в адипоцитах людини (перед), впливаючи на різні процеси протягом життєвого циклу адипоцитів. З цієї причини ця комбінація може представляти варіант лікування захворювань, пов’язаних із ожирінням.
Передумови
В усіх індустріальних країнах поширеність ожиріння різко зросла за останні десятиліття. Оскільки ожиріння тісно пов'язане з низкою розладів, включаючи цукровий діабет 2 типу, гіпертонію та атеросклероз, профілактика та лікування цієї хвороби викликають велике занепокоєння [1].
Ожиріння виникає, коли споживання енергії організмом перевищує споживання енергії організмом протягом тривалого періоду часу. Ступінь ожиріння характеризується обсягом і кількістю адипоцитів, що регулюється так званим життєвим циклом адипоцитів [2]. Таким чином, лікування, спрямоване на регулювання розміру і кількості адипоцитів, може забезпечити терапевтичний підхід [3,4].
Деякі рослинні екстракти та їх відповідні біоактивні компоненти добре відомі своєю здатністю надавати ефекти проти ожиріння [2]. У цьому контексті ми зосередились на екстракті листя лотоса, натуральному рослинному екстракті, отриманому з листя Nelumbo nucifera. Nelumbo nucifera також відомий як священний лотос, і всі частини цієї рослини використовувались як традиційні ліки в Китаї та Індії [5]. Екстракт листя лотоса містить безліч біоактивних компонентів, таких як флавоноїди [6], флавоноїдні глікозиди [7] та алкалоїди [8]. У мишей із ожирінням повідомлялося, що екстракт листя лотоса запобігав збільшенню маси тіла, пригнічував всмоктування ліпідів та вуглеводів, прискорював метаболізм ліпідів та регулював енергетичні витрати, що свідчить про сприятливі ефекти для придушення ожиріння [9]. Також на мишах було показано, що 50% -ний етаноловий екстракт, приготований із листя Nelumbo nucifera, стимулював ліполіз у білій жировій тканині [6]. Однак, наскільки нам відомо, переконливих досліджень, що вивчають вплив екстракту листя лотоса на накопичення тригліцеридів або активність ліполізу в клітинах людини, поки що бракує.
Виявлено різні природні фітохімікати, що впливають на життєвий цикл адипоцитів. За даними Rayalam та співавт. [2] селективна монотерапія, спрямована на профілактику або лікування ожиріння, ще не була успішно встановлена. Однак спільне вживання кількох натуральних продуктів, які стимулюють різні молекулярні та клітинні механізми, може представляти більш перспективний підхід до лікування ожиріння. Ліполіз жирової тканини призводить до розщеплення тригліцеридів, що зберігаються в жирових клітинах, і подальшого виділення жирних кислот і гліцерину. Ці виділені жирні кислоти транспортуються в систему кровообігу і переробляються печінкою. Окремі компоненти після повернення до жирової тканини можуть бути перетворені назад у тригліцериди адипоцитів. Щоб запобігти цьому процесу, стимуляція бета-окислення і, таким чином, видалення жирних кислот (шляхом створення енергії) може допомогти зменшити запаси жиру більш ефективно [10-12].
Щоб визначити, наскільки екстракт листя лотоса впливає на адипогенез та індукує активність ліполізу, ми досліджували вплив розчину екстракту листя лотоса на людські преадипоцити та адипоцити. Оскільки L-карнітин функціонує як стимулятор для окислення жирних кислот, ми додатково визначили можливість поєднаних ефектів екстракту листя лотоса та L-карнітину в людських (попередніх) адипоцитах.
Методи
Випробовувані речовини
Розчин екстракту листя лотоса
Для наших досліджень був використаний рідкий екстракт листя Nelumbo nucifera (Pro-Sveltyl OP ®; лоти 621021 та 621031; Silab, Brive, Франція), позначений як “розчин екстракту листя лотоса”. Цей розчин рідкого екстракту отримують із листя Nelumbo nucifera і містить вміст сухої речовини приблизно 6,4 мг/мл у 50% -ному водному розчині бутиленгліколю. Для контролю можливих ефектів, викликаних розчином бутиленгліколю, в якості контролю використовували водний 50% розчин бутиленгліколю у відповідній концентрації.
L-карнітин
Другою речовиною, яку використовували для наших експериментів, був L-карнітин (L-Carnipure кристалічний; Лот 00002; Lonza, Базель, Швейцарія). Для експериментів з бета-окислення L-карнітин розчиняли безпосередньо у відповідному середовищі культури клітин. В експериментах з накопиченням жиру L-карнітин розчиняли в середовищі для живлення клітин у присутності 0,25% бутиленгліколю. Цей експеримент дозволив порівняти ефекти, викликані L-карнітином, із діями, опосередкованими комбінацією L-карнітину та 0,5% розчину екстракту листя лотоса, що мав кінцеву концентрацію 0,25% бутиленгліколю. Відповідний контроль був розглянутий відповідно.
Диференціація преадипоцитів на адипоцити
Визначення життєздатності клітин
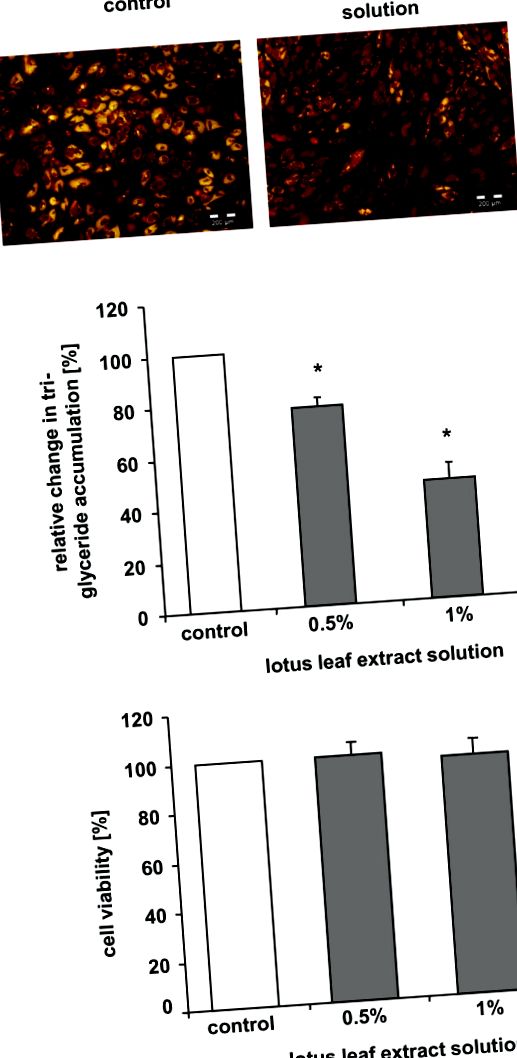
Аналіз життєздатності, що визначає активність ендогенної естерази, використовували, як описано раніше [14], для оцінки можливих цитотоксичних ефектів розчину екстракту листя лотоса. Коротко кажучи, преадипоцити культивували протягом 7 днів у «середовищі для диференціювання», що містить 0,5%, 1% розчину екстракту листя лотоса або відповідного контрольного розчину. Потім клітини промивали 1 × сольовим розчином, забуференним фосфатом Дульбекко (DPBS) (Cambrex, Verviers, Бельгія), та інкубували протягом 20 хв у 100 мкл розчину флуоресцеїну діацетату (FDA; Sigma, Taufkirchen, Німеччина) × DPBS). Потім визначали флуоресценцію (збудження при 491 нм/випромінювання при 517 нм) за допомогою 96-лункового зчитувача планшетів Safire 1 (Tecan, Крайльсхайм, Німеччина).
Визначення накопичення тригліцеридів
Для експериментів преадипоцити культивували протягом 7 днів у «середовищі для диференціювання», доповненому 0,5% або 1% розчином екстракту листя лотоса, 0,01% L-карнітином, комбінацією 0,01% L-карнітину та 0,5% розчину екстракту листя лотоса або відповідним контрольні рішення.
Накопичення тригліцеридів під час диференціації визначали на 7-й день за допомогою аналізу AdipoRed (Cambrex, Verviers, Бельгія) відповідно до інструкцій виробника. Виявлено флуоресценцію (збудження при 485 нм/випромінювання при 572 нм) та визначено кількісно в 96-лунковому зчитувачі планшетів Safire 1 (Tecan, Крайльсхайм, Німеччина).
Для додаткового мікроскопічного аналізу клітини інкубували з реагентом AdipoRed протягом 10 хв при кімнатній температурі. Зразки аналізували за допомогою флуоресцентної мікроскопії за допомогою мікроскопа Olympus IX71 (Гамбург, Німеччина).
Визначення вивільнення гліцерину
Підшкірні людські преадипоцити або hADSC висівали в колби з культурами клітин (9 × 10 3 клітин/см 2) і культивували в модифікованому Дульбекко середовищі Eagle Medium-F12 (Gibco/BRL, Еггенштейн, Німеччина), що містить 10% FCS, 0,5% гентаміцину (Gibco/BRL, Еггенштейн, Німеччина), 33 мкМ біотину та 17 мкМ D-пантотенату (Sigma, Тауфкірхен, Німеччина) при 37 ° C та 5% CO2. Через 7 днів клітини переносили в 96-лункові планшети (10 5 клітин на лунку). Через добу середовище замінили свіжим середовищем, що містить 10% FCS, 0,5% гентаміцину, 33 мкМ біотину, 17 мкМ D-пантотенату, 66 нМ інсуліну, 1 нМ Т3, 100 нМ гідрокортизолу, 0,1 мкг/мл апо-трансферину та 1 мкг/мл циглітазону (всі отримані від Sigma, Тауфкірхен, Німеччина). Через 3 дні середовище замінили середовищем такого ж складу, але без циглітазону. Через три дні це середовище замінили "середовищем диференціювання", і клітини культивували протягом 2 додаткових тижнів.
До інкубації з досліджуваними речовинами диференційовані клітини культивували протягом тижня в модифікованій Дульбекко модифікованій орлиною середовищі з низьким вмістом глюкози (Cambrex, Верв'є, Бельгія), доповненій 1% бичачим альбуміном фракції V, 100 од/мл пеніциліну, 100 мкг/мл стрептоміцину та 1 × Глютамакс (усі отримані від Gibco/BRL, Еггенштейн, Німеччина). Це культуральне середовище позначається як “середовище для обслуговування”. Вивільнення гліцерину аналізували через 28 днів після індукції диференціації.
Для експериментів клітини інкубували в 200 мкл «середовища для підтримки», що містить або 0,5%, або 1% розчину екстракту листя лотоса, або контрольного розчину, протягом 24 год при 37 ° C і 5% CO2. Реагент вільного гліцерину та стандартний розчин (Sigma, Тауфкірхен, Німеччина, стандартне розведення: 125-1,95 мкг/мл (кроки співвідношення 1: 1)) використовували відповідно до інструкцій виробника.
Для вимірювання з кожної лунки отримували 100 мкл супернатанту клітин і змішували із 100 мкл вільного реагенту гліцерину, використовуючи 96-лунковий планшет. Після 15 хв інкубації при кімнатній температурі в темряві поглинання вимірювали в 96-лунковому зчитувачі планшетів Spectra MAX (Molecular Devices, Union City, CA) при 540 нм.
Кількісна оцінка експресії гена ADD1/SREBP-1c
Підшкірні людські преадипоцити культивували, як описано вище. Для експериментів клітини культивували протягом 3, 6 та 9 днів у «середовищі диференціювання» з 1% розчином екстракту листя лотоса або без нього. Клітини збирали на 3, 6 і 9 день після індукції диференціювання та гомогенізували в TRIzol ® (Invitrogen, Карлсруе, Німеччина) відповідно до протоколу виробника. Після зворотної транскрипції зразки аналізували на визначення адипоцитів та фактор диференціації 1 (ADD1/SREBP-1c) за допомогою TaqMan ® -PCR у режимі реального часу, використовуючи ПЛР-систему швидкого реального часу 7900HT (Applied Biosystems, Дармштадт, Німеччина).
Помічені FAM праймери для qRT-PCR (Applied Biosystems, Forster City, CA) були такими: Інвентаризовані аналізи TaqMan для внутрішнього контролю гліцеральдегід-3-фосфатдегідрогенази (GAPDH; Hs99999905_m1) та для цільової РНК ADD1/SREBP1-S69 ). Використовували TaqMan ® Fast Universal PCR Master Mix (Applied Biosystems, Forster City, CA), і ПЛР проводили відповідно до рекомендацій постачальника. Дані ПЛР в реальному часі аналізували за допомогою програмного забезпечення детектора послідовностей версії 2.3, що постачається із ПЛР-системою швидкого реального часу 7900HT (Applied Biosystems, Дармштадт, Німеччина). Кількісна оцінка була досягнута за допомогою методу 2 -ΔΔCt, який обчислює відносні зміни експресії генів мішені, нормалізованої до ендогенного еталону (GAPDH).
Імунофлуоресцентний мікроскопічний аналіз
Для імунофлуоресцентного аналізу популяції преадипоцитів вирощували на покривних склянках та інкубували у «середовищі диференціювання» з 1% розчином екстракту листя лотоса або без нього протягом 9 днів, як описано вище. Потім клітини фіксували 4% розчином формальдегіду протягом 30 хв при кімнатній температурі, промивали забуференним фосфатом сольовим розчином (PBS) і просочували 0,2% Triton X-100. Після послідовного промивання PBS фіксовані клітини попередньо обробляли PBS, що містить 10% ослиної сироватки протягом 30 хв. Потім клітини інкубували протягом 1 години з первинними антитілами, спрямованими проти ADD1/SREBP-1c (sc 8984; Санта-Крус, Гейдельберг, Німеччина). Покривні стекла послідовно промивали три рази PBS, а потім інкубували протягом 1 години із вторинним антитілом, міченим Cy3. Клітинні ядра фарбували за допомогою Hoechst 33342 (1 мкг/мл; Invitrogen, Карлсруе, Німеччина). Результати визначали за допомогою флуоресцентного мікроскопа IX71 у поєднанні з програмною коміркою ^ F v. 2.4 (Olympus, Гамбург, Німеччина).
Визначення бета-окислення
Для визначення бета-окислення підшкірні людські преадипоцити культивували відповідно до інструкцій виробника, як описано вище. Преадипоцити (300 000 клітин/блюдо) висівали в стерильні 3,3 см чашки Петрі Nunclon (Nunc, Роскільде, Данія) в PGM. Наступного дня вимірювали бета-окислення, як описано нижче.
Щодо популяцій адипоцитів, диференціювання індукували шляхом додавання до середовища 10 мкг/мл інсуліну, 1 мкМ дексаметазону, 200 мкМ індометацину та 500 мкМ ізобутилметилксантину (Cambrex, Verviers, Бельгія). Клітини культивували протягом 2 тижнів з однією зміною середовища, що відбувалась після одного тижня культури. До визначення бета-окислення адипоцити інкубували протягом 7 днів у "середовищі, що підтримує".
Статистичний аналіз
Для статистичного аналізу на основі двостороннього тестування гіпотез було обрано рівень значущості 0,05 (альфа).
Проведено наступний аналіз:
Перевірка нормального розподілу за допомогою тесту Шапіро-Вілька.
Порівняння та контроль за допомогою повторних вимірювань ANOVA з лікуванням як класифікаційною змінною.
Порівняння експериментів за допомогою ANCOVA з лікуванням як класифікаційною змінною та контролем як коваріабельним.
За необхідності проводять попарне порівняння за допомогою узагальненого тесту Тукі.
Використовуване програмне забезпечення: Програмний пакет SAS для Windows V9.1.3.
Результати
Розчин екстракту листя лотоса зменшував накопичення тригліцеридів під час адипогенезу
Для вивчення впливу розчину екстракту листя лотоса на накопичення тригліцеридів під час диференціювання преадипоцитів/адипоцитів людини клітини культивували в «середовищі диференціювання» протягом 7 днів у відсутність або присутність розчину екстракту листя лотоса. Як показано на малюнку Рисунки 1А, 1А, більшість контрольних клітин демонстрували накопичення тригліцеридів у краплях ліпідів. На відміну від цього, більшість клітин, інкубованих з 1% розчином екстракту листя лотоса, не накопичували тригліцеридів, як свідчить відсутність жовтого фарбування.
Розчин екстракту листя лотоса стимулював активність ліполізу в диференційованих адипоцитах
Вплив розчину екстракту листя лотоса на експресію ADD1/SREBP-1c під час адипогенезу. (A) Експресія гена ADD1/SREBP-1c у диференціюванні преадипоцитів після інкубації з 1% розчином екстракту листя лотоса порівняно з контрольними клітинами, встановленими як 100%. Вираз ADD1/SREBP-1c нормується до GAPDH. Було підготовлено три незалежних експерименти для контролю та інкубації з розчином екстракту листя лотоса (n = 3). Результати зображуються як середнє значення ± SD. (B) Популяції людських преадипоцитів культивували у „середовищі диференціювання” без (a, c) або (b, d) 1% розчину екстракту листя лотоса протягом 9 днів. Проведено імунофлуоресцентне фарбування ADD1/SREBP-1c (червоний) та ДНК (Hoechst-33342 (синій)). a і b: шкала шкали: 200 мкм; c і d: Шкала шкали: 50 мкм.
Щоб дослідити, чи впливає розчин екстракту листя лотоса на експресію гена ADD1/SREBP-1c на рівень білка, ми інкубували клітини 1% розчином екстракту листя лотоса та визначали експресію ADD1/SREBP-1c за допомогою імунофлуоресцентного аналізу. Згідно з нашими попередніми висновками, клітини, інкубовані з розчином екстракту листя лотоса (Малюнок 3B b і 3B d), демонстрували лише слабкий сигнал ADD1/SREBP-1c порівняно з контрольними клітинами (Рисунок 3B a і 3B c). Примітно, що кількість ядер, забарвлених Hoechst 33342, була порівнянна у всіх досліджуваних районах.
Підсумовуючи, результати показали, що розчин екстракту листя лотоса впливає на адипогенез.
- Домашній рецепт обгортання з морських водоростей Наше повсякденне життя
- Усередині неспокійного життя самотньої спадкоємиці Версаче Аллегри Бек, яка боролася з виснажливим
- Всередині; Надприродне; зірка Джаред Падалекі; життя до його арешту
- Мікрохвильовий рецепт 2-хвилинний омлет The Leaf Nutrisystem Blog
- Втрата ваги та зміна її життя