Екстракт гарячої води з пшеничних висівок послаблює травму білої речовини в моделі судинної деменції щурів
Анотація
ВСТУП
Судинна деменція - друга за поширеністю форма деменції після хвороби Альцгеймера. Судинна деменція становить приблизно 30% випадків деменції в країнах Азії та 10% випадків деменції у західних країнах (1,2). Судинна деменція спричинена судинними ураженнями і може бути класифікована на три основні типи: підкіркова судинна деменція, багатоінфарктна деменція та стратегічна деменція. Субкортикальна судинна деменція є найбільш поширеним видом деменції, що становить приблизно 50% випадків судинної деменції (3). Визначними патологічними особливостями підкіркової судинної деменції є злиття уражень білої речовини, що характеризуються втратою олігодендроцитів, що призводить до демієлінізації, вакуолізації, астроцитарної активації (також відомої як астрогліальна) та мікрогліальної активації (4–6). Ці патологічні особливості спричинені неповним інфарктом білої речовини через зменшення кровопостачання регіону, наприклад, хронічна гіпоперфузія (4). Хоча було проведено різноманітні фармацевтичні клінічні дослідження, жоден лікарський засіб для профілактики або лікування судинної деменції не був схвалений жодним регулюючим органом (7). Таким чином, існує нагальна потреба у розробці нутрицевтиків для профілактики судинної деменції.
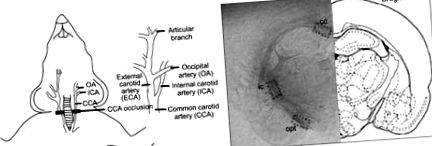
Модель двосторонньої загальної оклюзії сонної артерії щурів (BCCAO) широко застосовується для вивчення підкіркової судинної деменції, оскільки вона імітує патологічні події, що відбуваються при цьому захворюванні (рис. 1А) (8,9). Модель BCCAO добре відображає підкіркову судинну деменцію людини тим, що вона викликає пошкодження білої речовини демієлінізацією, вакуолізацією та астроцитарною та мікрогліальною активацією (10,11).
Принципові схеми моделі BCCAO та розташування білої речовини. (А) Двосторонні загальні сонні артерії (ВССА) закупорювали шляхом перев’язки шовковими швами 4-0. CCA, ICA та OA представляють загальну сонну артерію, внутрішню сонну артерію та потиличну артерію відповідно. (B) Три місця білої речовини, які були досліджені в цьому дослідженні: мозолисте тіло (cc), внутрішня капсула (ic) та зони зорового тракту (opt). Показаний переріз знаходиться на відстані -2,8 мм від брегми (23).
Зерно пшениці складається з ендосперму, шарів висівок та зародків (12). Кожна частина зерна складається з різного розподілу крохмалю, білка та клітинної стінки (13). Клітинні стінки складаються переважно з некрохмалевих полісахаридів (NSP), таких як арабіноксилан (AX) та β-глюкан, з незначною кількістю арабіногалактан-пептиду та глюкоманнанів (13,14). AX складається з лінійної основи ланцюга D-ксилози (ксилової) з бічними ланцюгами L-арабінози (ара) (13,14). У процесі подрібнення з ендосперму зерна пшениці виробляється пшеничне борошно, а решта зерна [тобто шари пшеничних висівок (ЗБ) із змінною кількістю решти ендосперму] залишаються пшеничними висівками (15). Зерна цільної пшениці складають приблизно 65% крохмалю, 15% білка та 10% NSP, тоді як пшеничні висівки становлять приблизно 25% крохмалю, 20% білка та 30% NSP (15). Незважаючи на те, що зерна цільної пшениці та пшеничні висівки містять дуже різні рівні загального AX (6% мас./Мас. Проти 17% мас./Мас.), Вони містять порівнянні рівні витяжної води AX (приблизно 0,5% мас./Мас.) (16).
У попередній спробі розробити нутрицевтик, який запобігає судинну деменцію, ми виявили, що супернатант лабораторного екстракту гарячої води меленої цільної пшениці (Triticum aestivum L.) (TALE) із періодичними центрифугами ослаблює пошкодження білої речовини та астроцитичність. активація в моделі BCCAO на щурах, що призводить до поліпшення пам’яті (17). Для визначення активних компонентів TALE ми використовували одну і ту ж модель на тваринах для тестування впливу декількох компонентів TALE на ураження білої речовини. Результати цих експериментів показали, що AX був активним компонентом (17). Результати попереднього експерименту спонукали нас розробити TALE як нутрицевтик, що містить АХ як активний компонент. Однак, коли ми намагалися виробляти TALE в промислових масштабах за допомогою центрифуг безперервного типу, ми зіткнулися з труднощами з видаленням желатинизованого крохмалю, який необхідний для підтримки високого рівня AX у TALE.
МАТЕРІАЛИ І МЕТОДИ
Підготовка WBE
Пшеничні висівки, побічний продукт подрібнення домашнього сорту пшениці, були придбані у культиватора в Кореї. Для отримання WBE, використовуваного в поточному дослідженні, використовували наступну процедуру (рис. 2): (1) пшеничні висівки просівали для видалення дрібних частинок, які в основному складалися з крохмалю; (2) Пшеничні висівки перемішували з 5 частинами (мас./Мас.) Холодної води в екстракторі об’ємом 500 л (BestKorea, Теджон, Корея) для видалення гранул крохмалю з пшеничних висівок; (3) Холодний екстракт просівали і промивали 5-частинним (мас./Мас.) Холодною водою вдруге, щоб відокремити фільтрат від залишків пшеничних висівок, фільтрат позначили як "холодний фільтрат"; (4) Холодний фільтрат центрифугували за допомогою декантерної центрифуги (PTM 300, TOMOE Engineering Co., Ltd., Токіо, Японія) для отримання супернатанту; (5) Супернатант змішували із залишками пшеничних висівок і перемішували в екстракторі приблизно при 95 ° C; (6) Отриманий гарячий екстракт просівали з отриманням «гарячого фільтрату»; (7) Гарячий фільтрат концентрували за допомогою вакуумної сушарки (HyoSung, Інчхон, Корея) і сушили розпилювальною сушаркою (YooJin Tech., Пхентаек, Корея) з отриманням кінцевого продукту, який отримав назву “екстракт пшеничних висівок” (WBE ). WBE люб'язно надала компанія DongA One Corp. (Сеул, Корея).
Принципова схема приготування екстракту пшеничних висівок (WBE). Пшеничні висівки перемішували в екстракторі з холодною водою, щоб відокремити гранули крохмалю від пшеничних висівок, отримуючи холодний фільтрат і залишки пшеничних висівок. Фракцію холодного фільтрату центрифугували графіном, щоб відокремити супернатант від обложених гранул крохмалю. Потім надосадову рідину та залишки пшеничних висівок об’єднували і екстрагували гарячою водою для отримання гарячого фільтрату. Гарячий фільтрат концентрували і сушили розпилювальною сушаркою для отримання WBE.
Аналіз хімічного складу WBE
Аналіз поживних речовин WBE проводили відповідно до Корейського стандартного харчового кодексу (20). Вміст вологи, жиру, білка та золи (мас.%) Вимірювали методом нагрівання сушінням, методом екстракції ефіру, методом Кельдаля та методом випробування золи відповідно. Вміст вуглеводів (мас.%) Розраховували за різницею. Крім того, загальний, нерозчинний і розчинний вміст харчових волокон вимірювали ферментативно-гравіметричним методом.
Аналіз нейтрального моносахаридного складу WBE
Склад нейтрального моносахариду WBE визначали, як описано раніше (21). WBE (5
Тварини
Вісім тижнів самців щурів Sprague-Dawley (SD) з масою тіла приблизно 300 г були придбані у Samtako Inc. (Осан, Корея). Експерименти проводились згідно з Посібником з догляду та використання лабораторних тварин. Протоколи були схвалені Інституційним дорадчим комітетом з догляду за тваринами та дослідженнями Католицького університету, Тегу, Корея. Тварин утримували з дієтою та водою в режимі ad libitum за добового освітлення та у контрольованій температурі середовищі до початку експерименту.
Введення дієти
Щурів випадковим чином розподіляли до однієї з трьох груп: (1) фіктивний (n = 6), (2) контрольний (n = 6) та (3) оброблений WBE (400 мг WBE/кг/день) (n = 6). Щурів у групі, яка отримувала WBE, годували 15 г дієти WBE на день протягом 5 днів до та протягом 4 тижнів після травми BCCAO. Дієта WBE готувалася змішуванням 8 г WBE з 992 г дієти. Як тільки щури споживали всю дієту WBE, більше дієти було надано ad libitum. Щурів у підставних та контрольних групах, щурів годували лише дієтою. Масу тіла, споживання дієти та споживання води кожної щури вимірювали щодня протягом експериментального періоду.
Генерація моделі BCCAO
BCCAO використовували, як було описано раніше (рис. 1А) (17), щоб викликати помірне зменшення мозкового кровотоку до переднього мозку щурів у контрольній та WBE групах. До BCCAO щурів у всіх групах знеболювали ізофлураном (Hana Pharmaceutical Inc., Сеул, Корея) під час хірургічних процедур у суміші кисню/закису азоту (20%/80%). У контрольній групі та групах, які отримували WBE, ліву та праву загальні сонні артерії оголювали через середній розріз та лігували шовковим швом 4-0. У фіктивній групі експериментальні процедури були однаковими, за винятком того, що загальні сонні артерії не перев'язували. Під час хірургічного втручання ректальна температура підтримувалася на рівні 37 ± 0,5 ° C за допомогою термостатично регульованої нагрівальної пластини (Гарвардський апарат, Холлістон, МА, США). Через 4 тижні BCCAO оцінювали зрачковий рефлекс усіх щурів. Згодом щурів евтаназували, а мозок збирали для подальшого дослідження.
Оцінка світлового рефлексу зіниць (PLR)
PLR оцінювали як показник дегенерації зорового нерва за допомогою дещо модифікованої адаптації раніше описаного методу (22). Зіничні рефлекси кожної щури досліджували перед операцією для підтвердження нормальної роботи. Коротко кажучи, кожного щура пристосовували до темряви принаймні 5 хв. Потім одне око піддавали дії променя світла від отоскопа і оцінювали рефлекторну реакцію. Щуру дозволяли пристосуватися до темряви приблизно протягом 1 хв, а рефлекторну реакцію іншого ока оцінювали так само, як і перше. Втрата PLR визначалася як нездатність зіниці стиснутись після 10-секундного впливу світла (рис. 3).
Зіниковий світловий рефлекс ока щура. Коли щур має нормальний світловий рефлекс зіниць, зіниця (А) стискається у присутності світла і (В) розширюється в темряві.
Фарбування Luxol Fast Blue
Травмування ділянки білої речовини мозку оцінювали за допомогою фарбування Luxol Fast Blue, як описано раніше (17). Коротко кажучи, мозок вирізали під наркозом і нарізали скибочками. Зрізи включали мозолисте тіло (куб.см), внутрішню капсулу (ic) та зони зорового тракту (opt), які, згідно з атласом Паксіноса та Ватсона (23), розташовані на відстані -2,64-3,14 мм від брегми (Рис. 1B). Зрізи мозку фіксували у формаліні, вкладали у парафін і розрізали на ділянки 5 мкм. Після депарафінізації було відібрано по три ділянки з кожного мозку щура та забарвлене Luxol Fast Blue (24). Ідентифіковані області cc, ic та opt кожної секції (25) (рис. 1B). Тяжкість пошкодження в трьох регіонах оцінював експерт, засліплений експериментальними умовами, оцінений як нормальний (ступінь 0), наявність невпорядкованих нервових волокон (1 ступінь), утворення помітних вакуолей (2 ступінь) або відсутність мієлінованих волокна (3 клас) (26).
Імуногістохімічне фарбування
Статистичний аналіз
Значення виражаються як середнє значення ± SEM. Статистичний аналіз для множинних порівнянь проводили з одностороннім ANOVA, після чого проводили пост-хок-тест Тукі. Для всіх статистичних аналізів використовувалось програмне забезпечення SPSS (IBM SPSS Statistics версія 19, IBM, Armonk, NY, США). P Рис. 2) (27). Приблизно половина (46%) твердих речовин у холодному фільтраті була видалена декантерним центрифугуванням, що збільшило вміст ара в надосадовій рідині з 1,1% до 2,0%. Тому використання декантерного центрифугування для видалення гранул крохмалю з пшеничних висівок було підходящим методом для збільшення концентрації AX WBE.
Характеристика WBE
Аналіз поживних речовин показав, що WBE складається з 3,3 мас.% Вологи, 0,9 мас.% Жиру, 15,2 мас.% Білка, 14,1 мас.% Золи та 66,5 мас.% Вуглеводів. Аналіз харчових волокон показав, що WBE також містить 11,8% вагових розчинних у воді харчових волокон, що становить 17,7% вагового значення, отриманого для вуглеводів.
Для оцінки композицій нейтральних моносахаридів, присутніх у WBE, використовували наступну послідовність етапів: (1) TFA використовували для гідролізу WBE до складових моносахаридів; (2) Вироблені моносахариди альдози були відновлені до відповідних альдитолів; (3) Альдитоли ацетилювали до відповідних ацетатів альдітолу; (4) Отримані ацетати альдитолу були ідентифіковані та кількісно визначені за допомогою газової хроматографії, алоза використовувалась як внутрішній стандарт (21). Склад нейтральних моносахаридів WBE представлений у таблиці 1. З виявлених моносахаридів арабіноза (2,42 мас.%), Ксилоза (3,78 мас.%) Та маноза (0,42 мас.%) Походять лише з полісахаридів клітинної стінки. Галактоза та глюкоза отримують із поживних речовин та полісахаридів клітинної стінки. Оскільки TFA використовували для гідролізу WBE, целюлоза не гідролізувалась; таким чином, глюкоза, що міститься в целюлозі, не була включена в аналіз моносахаридів. Загалом, 56% від загальної кількості харчових волокон, виявлених у WBE, було у формі арабінози та ксилози, які є компонентами AX, або маннози. Решта 44% від загальної кількості харчових волокон, що містяться в WBE, імовірно, складається з галактози, яка міститься в арабіногалактані, та глюкози, що міститься в β-глюкані.
- Здорові млинці з цільних пшеничних висівок Кендра; s Лікує
- Зниження продуктивності робочої пам’яті у підлітків із надмірною вагою та ожирінням зумовлене білою речовиною
- Тренер життя - це вівсяні висівки, такі ж здорові, як пшеничні
- Йосип; s Хлібобулочні лляні вівсяні висівки та цільнозернове борошно Лаваш
- Як вибрати правильну модель обслуговування ресторану - на лінійному тості POS