Експресія фактора-1α, що індукується гіпоксією, в мозку щурів під час хронічної гіпоксії
Кафедри анатомії та
Кафедри анатомії та
Кафедри анатомії та
Кафедри анатомії та
Неврологія, Університет Кейс Вестерн Резерв, Медичний факультет, Клівленд, Огайо 44106
Анотація
Індукований гіпоксією фактор-1 (HIF-1) - це фактор транскрипції, який регулює адаптаційні реакції на нестачу кисню в клітинах ссавців. HIF-1 складається з двох білків, HIF-1α та HIF-1β. HIF-1α накопичується в гіпоксичних умовах, тоді як HIF-1β конститутивно експресується. Експресію HIF-1α та HIF-1β вимірювали під час адаптації до гіпобаричної гіпоксії (0,5 атм) у корі головного мозку щурів. Вестерн-блот-аналізи показали, що HIF-1α швидко накопичувався під час настання гіпоксії і не падав протягом 14 днів, а впав до норми на 21 день, незважаючи на постійну низьку артеріальну напругу кисню. Імуноофарбовування показало, що нейрони, астроцити, епендимальні клітини та, можливо, ендотеліальні клітини є типами клітин, що експресують HIF-1α. Гени з елементами, що реагують на гіпоксію, активувались у цих умовах, про що свідчать підвищені фактори росту судинного ендотелію та рівні мРНК транспортера глюкози. Коли 21-денно пристосовані щури піддавалися більш серйозному гіпоксичному впливу (8% кисню), HIF-1α накопичувався знову. На підставі цих результатів ми припускаємо, що ремоделювання судин та метаболічні зміни, викликані тривалою гіпоксією, здатні відновити нормальний рівень кисню в тканинах.
Вплив навколишнього середовища з низьким вмістом кисню викликає кілька безпосередніх і довгострокових адаптаційних механізмів. На системному рівні вони включають гіпервентиляцію та поліцитемію, які покращують доставку кисню до таких важливих органів, як мозок (15, 20). Однак цих компенсаторних механізмів недостатньо для задоволення потреб центральної нервової системи в кисні, особливо під час тривалого впливу гіпоксії. Мозок виявляє неабияку здатність до структурної та метаболічної реакції на тривалу гіпоксію. Однією з найдраматичніших структурних реакцій є значне перероблення мозкової мікросудинної мережі. Попередні дослідження показали, що 3 тижні впливу гіпобаричної гіпоксії спричиняли значне збільшення щільності мікросудин у мозку (2, 9, 15,19). Ця структурна пластичність також супроводжується метаболічною адаптацією до низького напруги кисню. Наприклад, повідомлялося про збільшення транспорту глюкози (7), збільшення загального обміну метаболізму глюкози (10) та активність цитохромоксидази (4,14) у мозку щурів після 3 тижнів впливу гіпобаричної гіпоксії.
Під час тривалого впливу гіпоксії HIF-1α слід виражати до тих пір, поки не буде досягнутий баланс між надходженням та використанням кисню в тканині. Наші результати показали, що рівні HIF-1α повертаються до нормоксичних значень після 3 тижнів гіпоксії, припускаючи, що ремоделювання судин головного мозку та метаболічні зміни змогли компенсувати гіпоксію тканин мозку.
Вплив хронічної гіпоксії.
Самців щурів Wistar у віці 2–3 місяці утримували до 3 тижнів у гіпобаричних камерах, що підтримували тиск 380 Торр (0,5 атм, що еквівалентно 10% нормобаричному кисню). У групах, що утримувались більше 1 дня, камери відкривали 30 хв щодня для очищення клітини та поповнення їжі та води. Тривалість гіпоксії становила 6 год, 12 год або 1, 4, 7, 14 або 21 день. Кожна експериментальна група щурів мала свою власну контрольну групу для сміття, яку тримали поза гіпобаричними камерами, але в тому ж місці. Група щурів, що утримувалася 21 день у гіпобаричній камері, піддавалась дії 10% або 8% нормобаричного кисню протягом 4 год відразу після вилучення з гіпобаричної камери. Зразки венозної крові хвоста отримували для визначення гематокриту до того, як щурів вбили.
Вестерн-блот-аналіз.
Після гіпоксичного впливу експериментальних та контрольних щурів вбивали, а мозок швидко видаляли та заморожували у рідкому азоті. Коркові зразки розтинали та гомогенізували в крижаному буфері (20 мМ HEPES, рН 7,5, 1,5 мМ MgCl2, 0,2 мМ ЕДТА, 0,1 М NaCl), доповненому 0,2 мМ дитиотрейтолом, 0,5 мМ ванадатом натрію та інгібіторами протеази (0,4 мМ фенілметилсульфонілфториду і по 2 мкг/мл лейпептину, пепстатину та апротиніну). Згодом NaCl додавали до кінцевої концентрації 0,45 М і гомогенат центрифугували при 10000 g протягом 30 хв. Супернатанти збирали і змішували з рівним об'ємом буфера гомогенізації, що містив 40% (об./Об.) Гліцерину, перед тим як зберігати при -80 ° C. Зразки (загалом 200 мкг лізатів) піддавали електрофорезу в SDS-7% поліакриламідному гелі та переносили на нітроцелюлозні мембрани за стандартними процедурами.
Мембрани блокували 5% знежиреного сухого молока та інкубували протягом 2 годин при кімнатній температурі з наступними антитілами: моноклональний анти-HIF-1α (1: 500, Novus Biologicals, Littleton, CO), поліклональний анти-HIF-1β (1: 1000, Novus Biologicals) та поліклональний анти-VEGF (1: 400, Santa Cruz Biotech, Пало-Альто, Каліфорнія). Після цього відбулася інкубація з кон’югованими з пероксидазою хроном антитілами та посилене виявлення хемілюмінесценції (ECL, Amersham, Piscataway, NJ). Сирі ядерні екстракти клітин Hepa 1 (American Type Culture Collection, CRL-1830), що зазнали впливу 1% або 20% кисню, використовувались як позитивний контроль (30 мкг білка) при аналізі вестерн-блот. Концентрації білка визначали за допомогою протеїнового аналізу Бредфорда (Bio-Rad).
Вилучення РНК та аналіз нозерн-блот.
Загальну РНК виділяли з кори головного мозку за допомогою Системи ізоляції РНК-агентів (Promega, Madison, WI) відповідно до інструкцій виробника. Рівні зразки (10 мкг) загальної РНК електрофорезували в 1% агарозно-формальдегідних гелях, переносили на нейлонові мембрани (Millipore, Bedford, MA), ультрафіолетові зшиті і гібридизували із випадковими згаданими зондами. Плямки гібридизували з розчином Quickhyb (Stratagene, La Jolla, CA) і промивали 0,2 × сольовим розчином цитрату натрію, 0,1% SDS при 55 ° C. Зонди VEGF та GLUT-1 були придбані у Research Genetics (номери приєднання GenBank AA154722 та AA451073 відповідно), а олігонуклеотидний зонд для РНК 18S був отриманий від Life Technologies (Rockville, MD).
Імуногістохімія HIF-1α.
Нормоксичних та гіпоксичних щурів (4 та 21 день гіпоксії) глибоко знеболювали Нембуталом і перфузували внутрішньосерцево холодним фосфатно-забуференним фізіологічним розчином (pH 7,4), а потім 4% фосфатно-забуференним параформальдегідом. Мозок видаляли, постфіксували у 2% параформальдегіді протягом 24 годин і вкладали у парафін. Серійні зрізи (6 мкм) вирізали на мікротомі, встановили на предметних стеклах, покритих желатином, висушили на повітрі і зберігали при кімнатній температурі до обробки для імуногістохімії. Для ідентифікації деяких клітин, що експресують HIF-1α, проводили подвійне імуномаркірування за допомогою двох клітинних маркерів, нейронального ядерного антигену (NeuN) та гліального фібрилярного кислотного білка (GFAP). Коротко кажучи, зрізи депарафінізували, гідратували та піддавали вилученню антигену при 90 ° C протягом 25 хв з використанням розчину для отримання мішені (Dako, Carpinteria, CA), відповідно до інструкцій виробника. Моноклональне антитіло миші проти HIF-1α (1: 200, Novus Biologicals) було виявлено за допомогою системи стрептовідин-біотин-пероксидаза хрону (каталізована система посилення сигналу, Dako). Моноклональні анти-GFAP (1: 500, Sigma Chemical) та анти-NeuN (1: 500, Chemicon, Temecula, CA) були виявлені за допомогою вторинних антитіл, кон'югованих з техаським червоним та флуоресцеїном (Vector, Burlingame, CA).
Статистичний аналіз.
Дані подаються як середні значення ± SD. Для розрахунку відносної кількості РНК оптичні щільності VEGF та GLUT-1 нормалізували щодо сигналу РНК 18S. Потім нормалізовані значення були усереднені для двох відтворених блотів, приготованих з одного набору зразків РНК. Значення денситометрії, отримані для імуноблотів HIF-1α, HIF-1β та VEGF, використовувались для обчислення процентного збільшення відносно нормоксичних значень того самого гелю. Один зразок т-використовували тест, щоб визначити, чи відношення гіпоксичності до контролю щільності білка було значно більшим за 1. Порівняння співвідношень РНК та білків у різні моменти часу оцінювали за допомогою ANOVA з корекцією Тукі (процедура ONEWAY, SPSS v8.0). У всіх випадках,P 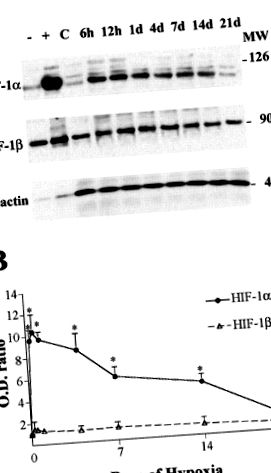
Рис. 1.A: Вестерн-блот-аналіз індукованого гіпоксією фактора (HIF) -1α, HIF-1β та β-актину (контроль навантаження) в корі головного мозку щурів, що зазнали дії нормоксичної (C) та гіпоксичної [6 год до 21 дня (d)] умови. Сирі ядерні екстракти клітин Hepa 1, що зазнали впливу 20% (-) та 1% (+) кисню, використовувались як негативний та позитивний контроль, відповідно, для імуноблотів HIF-1α. Вказується направильно - позиції стандартів молекулярної маси (МВ).B: співвідношення оптичної щільності (OD) HIF-1α (●) та HIF-1β (▵) щодо контрольних значень. Значення є середніми ± SD з 3 експериментів (n = 3 на момент часу; *P
Індукція HIF-1α у відповідь на додаткову гіпоксію після адаптації.
У попередньому експерименті ми показали, що HIF-1α більше не накопичується в мозку щурів, які протягом 21 дня зазнавали гіпобаричної гіпоксії. Повернення HIF-1α до вихідних рівнів може бути наслідком успішного відновлення напруги кисню в тканині. Щоб виключити можливість того, що порушення механізму, відповідального за накопичення HIF-1α, перешкоджало його появі, деякі щури в подальшому піддавалися дії або 10%, або 8% нормобаричного кисню (n = 3 у кожній групі) протягом 4 год відразу після утримання протягом 21 дня в гіпобаричній гіпоксії. Як і очікувалось, через 21 день впливу гіпоксії рівні HIF-1α були подібними до контрольних значень. Додаткова експозиція протягом 4 год до 10% нормобаричного кисню не спричинила жодних змін у експресії HIF-1α. Однак вплив 8% кисню супроводжувався шестикратним збільшенням щільності HIF-1α порівняно з 21-денними гіпоксичними кортикальними лізатами (рис.2). Ці результати вказують на те, що новий баланс між доставкою та споживанням кисню був досягнутий через 3 тижні впливу гіпоксії, але що подальший гіпоксичний стимул все ще був здатний викликати накопичення HIF-1α.
Рис.2.Відповідь HIF-1α в корі мозку на додаткову гіпоксію після адаптації. Щури, що зазнавали гіпобаричної гіпоксії протягом 21 дня (21г,n = 6) згодом зазнали впливу 10% (n = 3) або 8% (n = 3) нормобаричний кисень протягом 4 год (21d + 10%, 21d + 8%). Також показані зразки нормоксії (С) та 4-денної гіпоксії (4г). Ядерний екстракт клітин Hepa 1, підданих впливу 1% O2, використовували як позитивний контроль (+).
Гени-мішені HIF-1.
Ми також проаналізували активацію двох цільових генів HIF-1: VEGF та GLUT-1. За допомогою блотер-аналізу Northern, ми змогли виявити поодинокі розшифровки VEGF (4,5 кб) та GLUT-1 (4,8 кб). Обидві стенограми дотримувалися подібних зразків тимчасової регуляції за рахунок хронічної гіпоксії (рис.3A), що демонструє три-чотирикратне збільшення через 12 годин, 1 день та 4 дні впливу гіпоксії. Після цього обидві стенограми почали занепадати. Через 21 день гіпоксії обидві розшифровки були майже до нормоксичного рівня. Крім того, ми також оцінили рівень білка VEGF. Була виявлена одна смуга при 23 кДа, яка, ймовірно, відповідає мономеру VEGF164. Рівні білка VEGF також були тимчасово індуковані, але його регуляція затримувалася. Значне збільшення білка VEGF було виявлено лише через 24 години гіпоксії і воно залишалося підвищеним протягом 14 днів. Як і у випадку з його мРНК, рівень білка VEGF також знизився до контрольного рівня через 21 день (рис.3B).
Рис.3.A: Норт-блот-аналіз рівня судинного ендотеліального фактора росту (VEGF) та рівня мРНК транспортера-1 (GLUT-1) транспорту глюкози в зразках кортикального мозку щурів, що зазнали дії нормоксиї (С) та гіпобаричної гіпоксії (від 6 год до 21 доби). Блоти, що містять 10 мкг загальної РНК, гібридизували з 32 міченими Р-зондами кДНК, специфічними для VEGF та GLUT-1. Цю ж кляксу гібридизували з 18S РНК-зондом як контролем навантаження. B: імуноблот-аналіз рівнів VEGF та β-актину в корі головного мозку щурів, які зазнали нормоксичної (С) та гіпобаричної гіпоксії.
Імунолокалізація HIF-1α в мозку.
Рис.4.Імуногістохімічна локалізація HIF-1α в нормоксичному та гіпоксичному мозку щурів. A: HIF-1α негативне фарбування в нормоксичних відділах мозку. B: Імунореактивність HIF-1α в гіпоксичному відділі мозку, що демонструє інтенсивне ядерне фарбування (× 100). C.: більше збільшення (× 400) гіпоксичного відділу мозку на рівні IV шару в корі. Позитивне фарбування пов'язане з ядрами круглої форми, імовірно, відповідають нейрональним або гліальним ядрам.D: Імунореактивність HIF-1α, пов’язана з ядрами плоскої форми, що оточують капіляри та дрібні судини (наконечники стріл), які можуть відповідати ядрам ендотеліальних клітин. Також показано позитивне фарбування піалу (Е) та позитивний імунофарбування епітелію HIF-1α (F) клітини судинного сплетення та епендимальні клітини, що вистилають бічні шлуночки гіпоксичного мозку. Ваги, 50 мкм, A і B складають × 100,C.-F складають × 400.
Рис.5.Подвійне імунофарбування HIF-1α та нейронального ядерного антигену NeuN (A і B) та HIF-1α та гліальний фібрилярний кислий білок (GFAP; C. і D) на рівні шарів IV та V соматосенсорної кори щурів, що зазнали гіпобаричної гіпоксії протягом 4 днів. Наконечники стріл у A іB вказують на великі, округлі ядра, позитивні на HIF-1α, які колокалізуються NeuN. Менш рясні, дрібні ядра, імуновані анти-HIF-1α, колокалізовані GFAP (наконечники стрілок у C. іD). Шкала шкали, 50 мкм.
Фактор транскрипції HIF-1 був визначений як найважливіший компонент клітинної та системної відповіді на гіпоксію у ссавців (22). Він опосередковує киснезалежну експресію цільових генів, що кодують еритропоетин, транспортери глюкози, гліколітичні ферменти та VEGF, серед інших (3). Продукти цих генів беруть участь у регуляції гіпоксичних адаптаційних реакцій, таких як еритропоез, зміни енергетичного обміну та ангіогенез.
Ми вивчали експресію HIF-1α в мозку щурів під час адаптації до хронічної гіпоксії. За нормоксичних умов ми виявили низький рівень білка HIF-1α за допомогою Вестерн-блот-аналізу, рівні, які не були виявлені менш чутливою імуногістохімією. Наші спостереження узгоджуються з попередніми дослідженнями, які повідомляли про базальну експресію HIF-1α та транскрипційну активність HIF-1 у мозку гризунів (1, 26), клітинних лініях нейробластоми людини (6) та очищених нейронах кори миші (6).
Це дослідження показало, що білок HIF-1α значно накопичується в мозку щурів під час гіпобаричної гіпоксії. Імуноофарбовування показало, що різні типи клітин мозку, включаючи нейрони, астроцити, ендотеліальні клітини та епендимальні клітини, експресують HIF-1α, припускаючи генералізовану тканинну гіпоксію (принаймні через 4 дні гіпоксії) без клітинної або регіональної неоднорідності.
Рівні HIF-1α поступово знижувались під час тривалої гіпоксії, але залишалися суттєво підвищеними протягом принаймні 14 днів і поверталися до рівня вихідного рівня на 21 день. Гостре вплив 8%, але не 10% нормобаричного кисню тварин, пристосованих до гіпобаричної гіпоксії, протягом 3 тижнів призводило до нового накопичення HIF-1α. Відповідно до сценарію, що накопичення HIF-1α під час гіпоксії призводить до транскрипційної активації генів-мішеней HIF-1, ми виявили підвищення регуляції транскриптів GLUT-1 та VEGF, яке паралельно реагує на HIF-1α. Це спостереження узгоджується з попередніми дослідженнями, що показують оборотну регуляцію експресії VEGF та GLUT-1 у мозку мишей та щурів, які зазнали гіпобаричної гіпоксії (8, 13, 27).
Однак не виключено, що транскрипція та трансляція мРНК HIF-1α через 21 день були якимось чином зменшені, що призвело до відсутності накопичення HIF-1α. Ця можливість була виключена висновком, що коли додатковий гіпоксичний стимул був поміщений на адаптовану до гіпоксії тканину, HIF-1α справді накопичувався, що свідчить про триваючу здатність тканини реагувати на наявність низького напруження кисню в тканинах. Більше того, це показало, що рівні HIF-1α в мозку регулюються сигналами, що повідомляють тканини, а не системним або навколишнім дефіцитом кисню.
Цю роботу частково підтримали гранти Національних інститутів охорони здоров’я NS-37111, NS-38632 та HL-56470.
СНОПКИ
Адреса для запитів на передрук та іншої кореспонденції: JC LaManna, департамент неврології (BRB), Університет Case Western Reserve, Медична школа, 10900 Euclid Ave., Клівленд, OH 44106–4938 (E-mail: [email protected] cwru. edu).
- Роздрібний продавець спортивних товарів зі знижками Decathlon повертається до Америки, але чи вітається він - The Outdoor Journal
- Глікемічна реакція та підсумок здоров’я семінару «Американський журнал клінічного харчування»
- Електрична стимуляція спинного мозку при хронічних болях у спині
- Структура оптимізації топології пілону двигуна на основі критеріїв продуктивності та напруги AIAA Journal
- Заздрість Naturals Keto Китайський магазин дієтичних таблеток Керівництво кращих відгуків - ARK JOURNAL