Екран високої пропускної здатності для потенційних клієнтів наступного покоління, орієнтованих на передачу паразитів малярії
Предмети
Анотація
Поширення стійкості паразитів до артемізиніну загрожує сучасним передовим антималярійним методам лікування, підкреслюючи потребу в нових препаратах з альтернативними способами дії. Оскільки лише 0,2–1% безстатевих паразитів диференціюються на статеві, компетентні до передачі форми, орієнтація на це природне вузьке місце забезпечує відчутний шлях для переривання передачі захворювання та пом’якшення відбору стійкості. Тут ми представляємо високопродуктивний екран гаметогенезу проти
70 000 бібліотеки різноманітності сполук, що визначає сімнадцять молекул, подібних до наркотиків, які націлені на передачу. Хіт-молекули мають різноманітні профілі активності, включаючи специфічну для чоловіка подвійну дію чоловіки-жінки та подвійну безстатеву сексуальність, причому одна перспективна N-Встановлено, що ((4-гідроксихроман-4-іл) метил) -сульфонамідний каркас має субмікромолярну активність in vitro та in vivo. Розвиток потенційних клієнтів із способами дії, орієнтованими на статеві стадії розвитку паразитів малярії, забезпечує раніше невивчену базу, з якої можна розробляти майбутні терапевтичні засоби, здатні запобігти передачі паразитів через популяцію.
Вступ
Успіх у зменшенні тягаря захворювань на малярію з початку тисячоліть бачив зміну парадигми від контролю до регіональної ліквідації та остаточного глобального викорінення 1,2. Злагоджене впровадження встановлених заходів призвело до значного зменшення смертності та захворюваності та допомогло досягти ліквідації малярії в 10 країнах 3. Однак, щоб забезпечити підтримку та прискорення цих здобутків, а також у світлі тривожної появи мультирезистентної малярії в Південно-Східній Азії 4, необхідні нові та інноваційні терапевтичні засоби, щоб запобігти потенційному звороту чисельності в найближчі роки.
2–5 ооцист (порівняно з 10 11 нестатевими паразитами в зараженому господарі) 10 .
Концепція конкретного націлювання на статеві стадії як стратегія зменшення рівня захворюваності на малярію останнім часом викликає підвищений інтерес 11. Це випливає з нового (пере) розуміння того, що націлювання на паразита малярії на гостре вузьке місце передачі популяції має потенційні переваги перед терапіями без статі, як засіб для розриву циклу зараження, але критично також як бар'єр для поширення алелей стійкості до наркотиків 11,12. Концептуально еволюція стійкості до ліків, спеціально націлених на стадії передачі, займе набагато більше часу, ніж для звичайних антималярійних препаратів, оскільки селективний тиск застосовується лише до відносно невеликої (невідтворюваної) популяції гаметоцитів порівняно з препаратами, націленими на
Тут ми здійснили HTS великої неупередженої бібліотеки хімічного різноманіття, де основним фільтром для ідентифікації потрапляння є саме здатність націлювати саму передачу, використовуючи Pf DGFA. Профілювання вибраних хітів виявило різноманітний спектр видів діяльності, як залежних, так і незалежних від нестатевої активності, а деякі з них демонструють специфічну для сексу статеву активність гаметоцитів. Ми показуємо, що зразкові молекули кожного класу активності інгібують передачу за різними механізмами, і це безпосередньо перетворюється на блокаду передачі комарів. Зокрема, ми ідентифікуємо роман N-Ліс ((4-гідроксихроман-4-іл) метил) сульфонаміду (N-4HCS), який швидко пригнічує процес утворення чоловічих статевих клітин in vitro і блокує передачу in vivo на мишачій моделі малярії. Платформа N-4HCS демонструє відмінні хімічні властивості, сприятливі фізико-хімічні властивості та обіцяє подальший розвиток як специфічний для передачі препарат, який може бути використаний у нових комбінованих антималярійних терапіях.
Результати
Гаметоцити та сполуки, націлені на нестатеву приналежність, всередині GHCDL
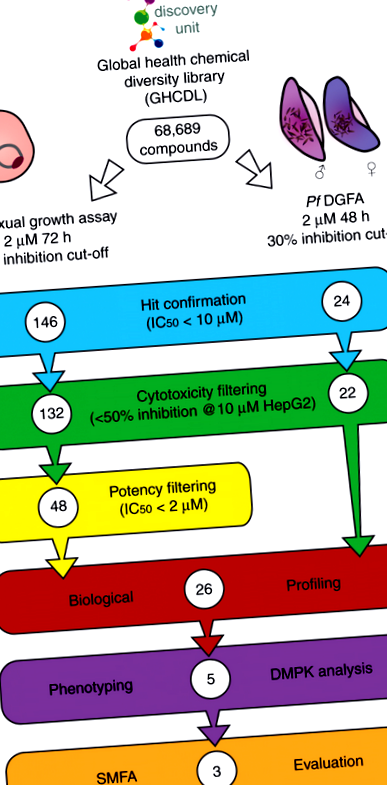
Глобальна бібліотека хімічного різноманіття охорони здоров’я (GHCDL) містить 68 689 сполук, відмінних від молекул, про які вже відомо, що вони мають протималярійні властивості. Усі молекули мають свинцеподібні фізико-хімічні властивості і розташовані в структурно подібних кластерах між 3 і 14 сполуками. Pf DGFA вимірює функціональну життєздатність чоловічих та жіночих гаметоцитів стадії V, як повідомляється за їх здатністю утворювати чоловічі та жіночі гамети 23. GHCDL проглядали в Pf DGFA при 2 мкМ з 48-годинною інкубацією перед активацією формування гамет, даючи 24 попадання за допомогою IC50 Рис. 1
Каскад прогресування скринінгу. Глобальну бібліотеку хімічного різноманіття охорони здоров'я (GHCDL) паралельно перевіряли проти Плазмодій фальціпарум нестатева стадія та чоловічі та жіночі гаметоцити. Активи були знову підтверджені, а цитотоксичні сполуки видалені. Безстатеві випадки додатково фільтрували на основі потенції та 26 сполук, відібраних для подальшого профілювання на основі потенції та комерційної доступності. П'ять сполук з різними властивостями, що блокують передачу, були додатково досліджені щодо фенотипу активності проти чоловічого гаметогенезу та їх фізіохімічних властивостей (DMPK). Активність трьох молекул підтверджена стандартним аналізом живлення мембраною (SMFA)
Паралельно GHCDL проводили скринінг проти нестатевих стадій крові при 2 мкМ протягом 72 годин інкубації з використанням активності лактатдегідрогенази як сурогатного зчитування для росту паразитів. Скринінг дав 146 звернень за допомогою IC50 Рис. 2
Ми досліджували, чи можуть сполучені сполуки пригнічувати інвазію та ріст печінки у встановленому стані P. berghei Аналіз інвазії люциферази спорозоїту HepG2 24. Лише одне з'єднання, DDD01243506, виявляло субмікромолярну активність проти P. berghei інвазія стадії печінки на рівні, подібному до її активності щодо асексуалів (Pb печінки IC50 = 0,52 мкМ; HepG2 TOX50 ≥ 50 мкМ; рекомбінантна люцифераза IC50 ≥ 50 мкМ; Pf безстатевої IC50 = 0,66 мкМ, додаткові дані 3). Дійсно, жодні Pf DGFA-активні сполуки не виявляли специфічної активності щодо стадій печінки, мабуть, або через принципові відмінності в біології клітин між різними стадіями паразитів, або видові специфічні відмінності між P. falciparum і P. berghei.
Для повної оцінки потужності скринінгового трубопроводу та розуміння того, як категорії профілювання можуть перетворитися на терапевтичні засоби, що блокують передачу, було обрано п'ять сполук для подальшого дослідження на основі потенції та профілю (рис. 3): DDD01027599 (DDD599/BPCA) та DDD01245291 (DDD291), що представляє безстатеві та двоступеневі акти Pf DGFA відповідно; DDD01249504 (DDD504) та DDD01255968 (DDD968), що представляють специфічні для чоловіка та гаметоцити активні речовини відповідно; і нарешті, DDD01035881 (DDD881), один із кластера N-4HCS, що представляє активні речовини, характерні для чоловічих статевих клітин. Підводячи підсумок, наші зусилля щодо виявлення виявили 17 підтверджених блокуючих передач та 9 несексуальних орієнтацій для подальшого розвитку.
Хімічна структура сполук GHCDL, відібраних для подальшого вивчення. Для детального вивчення було обрано п’ять сполук, що демонструють діапазон активності, що блокує передачу, на стадії профілювання. DDD01027599 (виявлено, що насправді є BPCA - див. Додаткову рис. 1-2) та DDD01245291 активні щодо гаметоцитів та асексуалів; DDD01255968 та DDD01249504 активно діють проти чоловічих гаметоцитів; і DDD01035881 спеціально націлений на утворення чоловічих статевих клітин
Фенотиповий вплив сполук на чоловічий гаметогенез
Еволюція in vitro з подальшим аналізом цілого геному є основним підходом, який в даний час використовується для розуміння того, як сполуки діють на паразитів малярії 25. Оскільки в даний час неможливо генерувати стійкі мутанти до сполук, які активні лише на стадії гаметоцитів (генерація стійкості вимагає великих циклів реплікації у присутності сполуки), для оцінки активності сполуки на утворенні чоловічих статевих клітин були проведені фенотипові аналізи імунофлуоресценції. Гаметоцити, оброблені 10 мкМ кожної сполуки, відбирали через 0, 2, 3, 4, 6, 8, 10 та 20 хв після індукції утворення гамет перед візуалізацією (рис. 4). Потім окремі чоловічі клітини витягували із зображень та аналізували на форму та кількість гаплоїдної хромосоми/вміст ДНК для кількісного вимірювання прогресування реплікації ДНК (n = 198–668 клітин) (рис. 5а).
Попереднє хімічне профілювання, аналіз SAR та DMPK
- 3D-надрукований універсальний випарник для високоефективного генерування сонячної пари під 1 сонцем
- Довгострокове дослідження результатів для оцінки зменшення залишкового ризику статину за допомогою EpaNova в HiGh
- 32 пари Підказки на високих підборах Змінні черевики для ремонту взуття, Набори інструментів для ремонту на високих підборах для жінок, Дюбелі
- Брітні Спірс для схуднення, тренування високих повторень, ізольовані рухи
- Будівництво жука, як личинка призводить до продуктивності дорослих у рогатого жука