Ефективність екстракту листя кінського каштана ALH-L1005 як матричного інгібітора металопротеїнази при індукованому лігатурою пародонтиті на собачій моделі
Се Юн Кім
1 кафедра ветеринарної хірургії, Коледж ветеринарної медицини, Сеульський національний університет, Сеул 08826, Корея.
Тае Хён Кім
1 кафедра ветеринарної хірургії, Коледж ветеринарної медицини, Сеульський національний університет, Сеул 08826, Корея.
Парк Шін Ае
1 кафедра ветеринарної хірургії, Коледж ветеринарної медицини, Сеульський національний університет, Сеул 08826, Корея.
Виграв Тае Кім
1 кафедра ветеринарної хірургії, Коледж ветеринарної медицини, Сеульський національний університет, Сеул 08826, Корея.
Молодий Ву Парк
1 кафедра ветеринарної хірургії, Коледж ветеринарної медицини, Сеульський національний університет, Сеул 08826, Корея.
Дже Санг Ан
1 кафедра ветеринарної хірургії, Коледж ветеринарної медицини, Сеульський національний університет, Сеул 08826, Корея.
Манбок Чонг
1 кафедра ветеринарної хірургії, Коледж ветеринарної медицини, Сеульський національний університет, Сеул 08826, Корея.
Мін-Янг Кім
2 AngioLab, Inc. Теджон 34016, Корея.
Kangmoon Seo
1 кафедра ветеринарної хірургії, Коледж ветеринарної медицини, Сеульський національний університет, Сеул 08826, Корея.
Анотація
Вступ
Захворювання пародонту зумовлені бактеріальною колонізацією пародонта (бляшками) та стимуляцією імунних реакцій господаря через побічні бактеріальні продукти [1]. Кілька дослідників продемонстрували, що фармакологічна модуляція перебільшених запальних та імунних реакцій господаря на додаток до елімінації мікробів є корисною при лікуванні пародонтозу [9,23]. Повідомлялося, що матричні металопротеїнази (ММП) відіграють важливу роль у протеолізі компонентів позаклітинного матриксу [4]. Під час прогресування захворювання пародонту протеолітичні ферменти господаря та похідні з мікробів опосередковують деструкцію позаклітинного матриксу [23]. Недавні дослідження показали, що MMP-2 (желатиназа A) та MMP-9 (желатиназа B) можуть спричинити руйнування тканин пародонту; крім того, повідомляється, що основні протеїнази, що беруть участь у руйнуванні та реконструкції тканин пародонта [5,11,18], були отримані поліморфноядерні лейкоцити (ПМН) (MMP-8, MMP-9). Інші дослідження показали, що зразки кревікулярної рідини ясен від пародонтозу містять MMP-13, якого не було виявлено у зразках здорової ясен [10]. Таким чином, інгібування ММП, що походять від господаря, може мати ключову роль у профілактиці та зменшенні прогресування пародонтозу.
У народній медицині продукти кінського каштана (Aesculus hippocastanum L.) та їх екстракти використовувались як ліки від кашлю, застійних явищ, артриту та ревматизму. Зокрема, екстракт насіння кінського каштана містить есцин, кислотний тритерпеновий глікозид, який має протизапальну, протинабрякову, антисекреторну та загальнозміцнюючу дію [19]. Екстракти насіння кінського каштана комерційно доступні у всьому світі для лікування хронічної венозної недостатності. Екстракти листя кінського каштана містять лише сліди есцину, але багаті флавоноїдами, включаючи кверцетин і кемпферол, а також глікозидами флавонолу, такими як кверцитрин. Такі екстракти комерційно доступні для ін’єкцій і використовуються для лікування набряків та венозної недостатності [2].
Метою цього дослідження була оцінка клінічного ефекту екстракту листя кінського каштана ALH-L1005 як інгібітора MMP на прогресування пародонтиту у собак бігль з експериментально індукованим пародонтитом.
Матеріали і методи
Протокол цього дослідження був схвалений Інституційним комітетом з догляду та використання тварин (SNU-080118-2; Сеульський національний університет, Корея). Всі експериментальні операції та обстеження проводились під загальним наркозом з комерційною комбінацією золазепаму та пілетаміну (5 мг/кг, внутрішньом’язово [ІМ]; Вірбак, Франція).
Хімічний препарат
Лист кінського каштана (Aesculus hippocastanum L; артикул № 38135000) був придбаний у Kräuter Mix (Німеччина), а екстракт ALH-L1005 приготований наступним чином: Десять кілограмів висушеного листя кінського каштана екстрагували 200 л 25% водного етанолу на 2 ч і фільтрується. Фільтрати концентрували під вакуумом і сушили з отриманням 1,73 кг ALH-L1005. Отриманий ALH-L1005 стандартизували з еталонним з'єднанням за допомогою високоефективної рідинної хроматографії (ВЕРХ). Для перорального прийому сформували капсули екстракту 150 мг ALH-L1005.
Аналіз MMP на ALH-L1005
Для встановлення найбільш ефективної формули експериментально оцінювали інгібуючу активність ММП доксициклін, комерційний екстракт насіння (Фінцельберг, Німеччина), комерційний екстракт листя (доктор Вілмар Швабе, Німеччина) та ALH-L1005. Перед аналізом MMP рекомбінантні людські MMP-2 та MMP-9 (R&D Systems, США) активували за допомогою 1 мМ APMA. Активність MMP вимірювали на спектрофлуорометрі (Perkin-Elmer, USA) з використанням 2,4-динітрофеніл-Pro-Leu-Gly-Met-Trp-Ser-Arg (Calbiochem, США) як субстрату. ММР (10 нМ) і субстрат (1 мкМ) змішували в 2 мл реакційного буфера (50 мМ трицину, рН 7,5, 10 мМ CaCl2, 200 мМ NaCl) разом з кожним досліджуваним матеріалом. Інтенсивність флуоресценції вимірювали при кімнатній температурі з використанням довжини хвилі збудження 280 нм та довжини хвилі випромінювання 360 нм.
Препарат для здорової ясен
Для дослідження було використано шістнадцять, приблизно 1,5-річних собак-біглів. Всі зуби кожного бігля були масштабовані та відполіровані. У наступні 2-тижневий період чищення зубів проводили двічі на день без анестезії для отримання оптимального статусу пародонту. Протягом цих 2 тижнів біглів годували твердою дієтою пелетного типу, щоб підтримувати здоров'я ясен за рахунок зменшення потенціалу утворення нальоту [20].
Експериментально індукований пародонтит
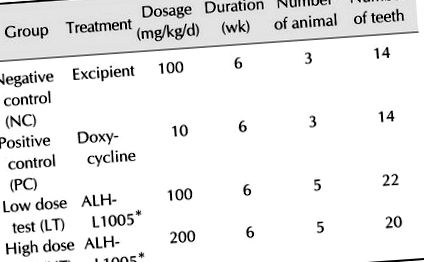
Після підготовки здорової ясен експериментальний пародонтит був індукований наступним чином: Шви з використанням 2-0 шовку (Ейлі, Корея) з допомогою зубного лігатурного дроту (ClassOne Orthontics, США) зав'язували навколо шийки матки правої верхньої частини PM2, PM3 та PM4, а праворуч нижні зуби PM3, PM4 та M1. Чищення зубів припиняли після перев'язки і давали м'яку зволожену їжу протягом 8 тижнів. Зуби, відкріплені протягом 8 тижнів, були виключені з дослідження. Лігатури видаляли після періоду індукції пародонтиту, і собак випадковим чином розподіляли на 4 групи: негативний контроль (NC; лише допоміжна речовина), позитивний контроль (ПК; доксициклін; DongKoo Bio & Pharma, Корея), ALH-L1005 низька доза тест (LT) та тест ALH-L1005 у високих дозах (HT) (таблиця 1). Всі ліки вводили перорально, двічі на день, наступні 6 тижнів. Після видалення лігатури досліджували показники стану пародонта, включаючи індекс нальоту (PI), індекс ясен (GI), глибину пародонтальної кишені (PPD), рівень клінічної прив’язаності (CAL) та кровотечу при тиску (BoP). Стандарти були модифіковані, як узагальнено в Таблиці 2 [17,26,31]. Всі вимірювання проводив один досвідчений клініцист (SE Kim) із використанням стерильного кольорового пародонтального зонда (Helmut Zepf Medizintechnik, Німеччина).
Таблиця 1
* 25% водний спиртовий екстракт листя кінського каштана (Aesculus hippocastanum L.).
Таблиця 2
* Деякі індекси оцінки були змінені з оригінальних посилань. ПІ, індекс нальоту; ШКТ, ясенний індекс; PPD, глибина пародонтальної кишені; КАЛ, рівень клінічної прихильності; BoP, кровотеча під тиском.
Збір і обробка зразків ясен
Через 6 тижнів після початку прийому ліків зразки тканини ясен отримували з щічного краю ясен правого верхнього РМ4 за допомогою біопсійного пуансона (Miltex, Німеччина). Зібрані тканини негайно промивали звичайним сольовим розчином (0,9% NaCl) для видалення сміття, включаючи наліт і кров, і зберігали замороженим при -80 ℃ у закодованих пробірках для мікроцентрифугування до аналізу. Згодом тканини ясен розморожували, зважували та екстрагували при 4 ℃ 5 М сечовинним буфером (20 мг мокрої тканини ясен на 1 мл буфера). Вміст білка в екстрактах ясен визначали кількісно за допомогою методу аналізу біцинхонінової кислоти [29].
Зимографія
Желатинолітичну та казеїнолітичну активність екстрактів ясен визначали за допомогою зомографії. Екстрати ясен змішували з 2-кратним буфером зимографії, що містив 63 мМ трис-HCl (pH 6,8), 10% гліцерину, 2% додецилсульфату натрію (SDS) і 0,0025% бромофенолового синього без денатурації теплом. Електрофорез проводили на 10% гелях SDS-поліакриламіду, що містять 0,1% желатину, і на 12% гелях SDS-поліакриламіду, що містять 0,25% казеїну при 125 В. Після електрофорезу гелі інкубували в 2,5% ренатурирующем буфері (Sigma-Aldrich, США). 30 хв при кімнатній температурі з легким перемішуванням, а потім урівноважений у проявляючий буфер, що містить 50 мМ трис-основи, 40 мМ HCL, 200 мМ NaCl, 5 мМ CaCl2 і 0,2% Brij 35 протягом 30 хв при кімнатній температурі з легким перемішуванням. Згодом гелі інкубували у розбудовувальному буфері протягом ночі при 37 ℃. Гелі фарбували 0,1% Coomassie blue R250 (Sigma-Aldrich, США) і знебарвлювали 10% оцтовою кислотою в 40% метанолі. Людські стандарти MMP-2 та -9 використовували на гелі для желатинової зимографії та на MMP-13 - для казеїнової зимографії як позитивні контролі.
Статистичний аналіз
Всі дані були статистично проаналізовані за допомогою програмного забезпечення SPSS (версія 21.0; SPSS, США). Зміни всіх параметрів пародонта з 0 по 6 тиждень у кожній групі оцінювали за допомогою парного t-тесту Стьюдента. Для міжгрупового порівняння значення на 0 та 6 тижнях аналізували одностороннім дисперсійним аналізом (ANOVA). Тест Даннета був використаний як пост hoc тест. Значення Р менше 0,05 вважали статистично значущими.
Результати
MMP Гальмівна діяльність ALH-L1005
Інгібуючу активність MMP ALH-L1005 порівнювали з активністю інших екстрактів кінського каштана та доксицикліну (табл. 3). При тих же концентраціях ALH-L1005 демонстрував більший рівень інгібування ММР-2 (88,50%), ніж 18,51% інгібування комерційного екстракту насіння кінського каштана (Фінцельберг, Німеччина) та 49,98% інгібування комерційного екстракту листя кінського каштана для ін’єкцій (Dr. Віллмар Швабе). Крім того, ALH-L1005 продемонстрував відмінне інгібування ММР-9 (91,84%) порівняно з 27,48% та 55,73% інгібування комерційного екстракту насіння та комерційного екстракту листя для ін’єкцій відповідно. Порівняно з доксицикліном, ALH-L1005 мав подібні рівні інгібуючої активності щодо MMP-2 та MMP-9.
Таблиця 3
* 25% водний спиртовий екстракт листя кінського каштана (Aesculus hippocastanum L.). † Порошкоподібний екстракт кінського каштана (Фінзельберг). ‡ Веноплант (доктор Вілмар Швабе).
Статус пародонту
Після 8-тижневого періоду індукції періодонтит був помітно індукований на експериментальних зубах порівняно з необробленими зубами. Лігатури, розміщені на шийному відділі, призводили до прогресування запалення ясен, спричиненого накопиченням нальоту з залишками їжі. З 96 зубів, перев’язаних шовковою та дротяною лігатурою, 70 продовжували перев’язку в кінці періоду індукції та були включені в статистичний аналіз. Кількість включених зубів у кожній групі була такою: NC (n = 14), PC (n = 14), LT (n = 22) та HT група (n = 20).
Таблиця 4
* Статистично значуща різниця порівняно з базовим показником (p Рис. 1 показує міжгрупове порівняння клінічних параметрів до та після 6-тижневого періоду дослідження. Базові значення всіх клінічних параметрів у групах ПК, LT та HT не суттєво відрізнялися від тих, що у групі NC (p> 0,05; рис. 1). На 6 тижні показники PI та BoP у групах LT і HT були значно нижчими в порівнянні з групами NC (p рис. 1). Аналогічно, оцінки GI груп ПК, LT та HT також були суттєво низькими порівняно з групами NC на 6 тижні (p Рис. 1).
Інгібуюча активність MMP у тканині ясен
Зимограми желатину показали, що група NC містила желатинолітичну активність в смугах при 92 кДа, що є тією ж площею молекулярної маси, що і в стандартах MMP-9 людини. Група NC демонструвала смуги при 82 кДа, як показано про-MMP-9. Однак подібні смуги не були виявлені у зразках з груп ПК та HT, а лише незначно виявлені в групі LT (панель A на рис. 2). Жодна з груп не показала желатинолітичних смуг у зоні, що вказує на ММР-2.
Подібно до результатів желатину, казеїнові зимограми показали, що зразки групи NC виражали казеїнолітичну активність у смугах при 48 кДа, що відповідає площі смуг для стандартів MMP-13, тоді як смуги в групах PC та LT виявлялися лише слабко . У зразках групи НТ смуга була ледь помітна.
Обговорення
Це дослідження було розроблене для виявлення клінічної ефективності ALH-L1005 при пародонтозі. У цьому дослідженні клінічні ознаки пародонтозу були суттєво вирішені в групах, які отримували медикаменти ALH-L1005. Групи LT та HT продемонстрували значне зменшення показників PI, GI, CAL та BoP порівняно з показниками групи NC на 6 тижні, хоча варіація CAL групи HT не досягла статистичної значущості. Крім того, група NC продемонструвала зменшення PPD одночасно із збільшенням CAL, тоді як інші групи показали зниження балів CAL протягом експериментального періоду. Ці результати вказують на те, що зменшення PPD у групі NC може розглядатися як рецесія ясен після запалення пародонту без поліпшення періодонтиту. Це дослідження показало, що лікування ALH-L1005 клінічно покращило загальний статус пародонту порівняно з таким у контрольній групі.
Численні дослідження досліджували модуляцію відповіді господаря для лікування захворювань пародонту, включаючи дослідження інгібіторів ММР, таких як аналоги тетрацикліну та нестероїдні протизапальні препарати [23]. Зокрема, субантимікробна доза доксицикліну була визнана ефективним засобом лікування пародонтиту, який може застосовуватися клінічно для фармакологічної модуляції ММР. Однак доксициклін мав побічні ефекти, такі як порушення роботи шлунково-кишкового тракту, реакції світлочутливості та, рідко, гепатотоксичність. Крім того, він протипоказаний під час вагітності або дитинства через можливість уповільнення розвитку скелета плода та знебарвлення зубів [16,22]. Нестероїдні протизапальні засоби також мали побічні ефекти, такі як крововиливи в шлунково-кишковий тракт та гепатопатія [22].
З моменту аналізу їх фармакодинаміки в сучасних клініках застосовується все більша кількість протизапальних засобів, отриманих з натуральних екстрактів. Попередні трав'яні дослідження показали, що екстракт Zea mays L., екстракт кори магнолії обонтової кори тунберга та екстракти немиленого авокадо/сої є ефективними засобами лікування пародонтозу [3,14,27]. Екстракт насіння кінського каштана містить протизапальні агенти, такі як есцин та флавоноїди, але також містить глікозид ескулін, який може мати токсичну дію [6]. Листя кінського каштана містять меншу кількість есцину та ескуліну, ніж насіння, але більшу кількість багатих флавоноїдів, включаючи кверцетин та кемпферол, а також глікозиди флавонолу, такі як кверцитрин, що мають додатковий ефект зменшення остеокластичної диференціації [2,19, 30].
Послідовність запальної реакції господаря на захворювання пародонту була добре описана в попередніх дослідженнях [8,21,23,24]. І існує декілька видів ММР, таких як ММР-1, 2, 3, 8, 9 та 13, які беруть участь у запальних реакціях, виявлених у зразках тканин та ясенно-ключичної рідини із запальної ясна [7,10,12, 18,23,25,28]. У цьому дослідженні in vitro ALH-L1005 продемонстрував помітно кращі ефекти інгібування MMP-2 та MMP-9, ніж комерційні екстракти насіння та листя кінського каштана. Крім того, порівняно з доксицикліном, який інгібує MMP-2 та MMP-9, ALH-L1005 виробляє подібний рівень інгібуючої активності.
На основі результатів припускають, що екстракт листя кінського каштана ALH-L1005 буде ефективним у клінічному лікуванні пародонтозу та забезпечить подібну або кращу ефективність, як лікування доксицикліном у собак. Крім того, вважається, що протизапальний ефект ALH-L1005 діє через механізм, пов'язаний з інгібуванням MMP-9 та MMP-13 у тканинах пародонту. Таким чином, ALH-L1005 може бути ефективним засобом лікування пародонтиту у собак, і його можна застосовувати до періодонтиту людини після подальшого дослідження його безпеки та ефективності.
Подяка
Це дослідження було фінансово підтримане AngioLab, Inc. та підтримано програмою Brain Korea 21 для ветеринарних наук та Науково-дослідним інститутом ветеринарних наук (RIVS) Коледжу ветеринарної медицини Сеульського національного університету, Корея.
- Вплив запатентованого стандартизованого етанолового екстракту листя ортосифона стамінеуса на посилення
- Клінічне застосування екстракту листя артишоку American Journal of Health-System Pharmacy Oxford Academic
- Склад та застосування гелю листя алое вера
- Утримання надтонкого MoO2 у вуглецевій матриці дає змогу застосовувати гібридні Li Ion та Li Metal Storage ACS
- Elite Nutrition and Performance Extract Coffee Bean Extract - Elite Nutrition and Performance