Ефективність, безпека та рецидив нових прогестинів та селективного модулятора рецепторів прогестерону для лікування ендометріозу: порівняльне дослідження на мишах
Анотація
Передумови
Сучасні методи лікування ендометріозу дуже обмежені. Розроблені прогестинові та селективні модулятори рецепторів прогестерону (SPRM), але їх ефективність, безпека, механізм та рецидив при ендометріозі не вивчені до кінця.
Методи
Для порівняння терапевтичних, побічних ефектів та терапевтичної дії Есмії, Дюфастона та Дієногеста при ендометріозі. Експериментальний ендометріоз був викликаний або внутрішньоочеревинною, або підшкірною трансплантацією ендометрія миші. Порівняли розмір ураження, вагу та гістологію наприкінці втручання. Вивчали експресію суміжних маркерів в ендометріотичних ураженнях. Вимірювали вагу тіла, матки та яєчників, залози та товщину ендометрія (ETI) та кількість фолікулів. Для періодичного дослідження відстежували ріст уражень до та після втручання.
Результати
Після лікування Есмією, Дюфастоном, Дієногестом розмір ураження та вага значно зменшились. Експресія проліферації Pcna суттєво знизилась у всіх групах, але клітини проліферації значно зменшилась лише у групі Дюфастона. Експресія апоптозу Mapk1 та TUNEL-позитивні клітини значно збільшились у групі Дюфастона. Експресія адгезії Mmp2 та Itgavβ3 була значно підвищена в групі Esmya. Експресія Plau, Hif1α та Vegfa, рівні PGE2 в очеревинній рідині, а також експресія ERα та ERβ; тоді як експресія PR була значно нижчою у всіх групах. Кількість залоз ендометрія в матці суттєво збільшилася в групі Дієногест, ЕТІ значно знизилася в групі Дюфастон, а АФК значно збільшилася в групі Есмія. Після припинення лікування ріст уражень швидко відскакував у групах Дієногеста та Дюфастона, але повільно - у групі Есмія.
Висновок
Есмія, Дюфастон та Дієногест - ефективні антиендометріозні препарати, спрямовані на проліферацію, апоптоз та адгезію. Есмія, Дюфастон і Дієногест добре переносимі, хоча у Дієногеста була виявлена залозиста гіперплазія ендометрія, атрофія ендометрія в Дюфастоні, скупчення фолікулів в Есмія.
Передумови
Ендометріоз - це загальний та хронічний доброякісний гінекологічний розлад, що характеризується наявністю тканин, схожих на ендометрій, поза порожниною матки. Це вражає близько 10% репродуктивних жінок та до 24-50% безплідних жінок [1, 2]. Хоча ендометріоз є естрогензалежним захворюванням, етіологічні дослідження показали, що патогенез ендометріозу є складним і багатофакторним [3,4,5,6]. Найбільш загальновизнаною та науково підтвердженою теорією виникнення ендометріозу є ретроградна менструація з огляду на анатомічне розташування та гістохімічні характеристики ендометріотичних уражень [4, 7]. Клінічні симптоми ендометріозу включають, але не обмежуючись, тазові болі, дисменорею, диспареунію та безпліддя [8], які мають суттєвий вплив як на загальне, так і на психічне здоров'я людей, що страждають [9, 10]. Наявне лікування ендометріозу, включаючи операцію з видалення та гормональні препарати [11], все ще не є ідеальним для репродуктивних жінок, які хотіли б зберегти свою плодючість без побічних ефектів та рецидивів.
У цьому дослідженні ми мали на меті порівняти антиендометріотичні ефекти, репродуктивні побічні ефекти, терапевтичний механізм та рецидив Esmya, Duphaston та Dienogest в експериментальній моделі миші на ендометріозі.
Методи
Хімічні речовини та реактиви
17-β-естрадіол був придбаний у Sigma Chemical Co. (Сент-Луїс, США). Кетамін, ксилазин та ацепромазин були придбані у Alfasan (Нідерланди, Голландія); Кроляче моноклональне антитіло до Ki67 було придбано за технологією Cell signaling technology (D3B5, Danvers, USA). Набір для виявлення апоптозу in situ був придбаний у Merck Millipore (США). Реагенти для RT-PCR та кількісної PCR були придбані у TaKaRa (TaKaRa Bio, Shiga, Японія). Набори естрадіолу та прогестерону ELISA були отримані від Cayman Chemical, США. Комплект ELISA для простагландину E2 був придбаний у Abcam (Abcam, Англія).
Модель тварин та ендометріозу
Шість-сім тижнів самок мишей C57BL/6 утримували у вільних від патогенів приміщеннях для тварин із фіксованим циклом 12 годин світла та 12 годин темряви. Забезпечували стандартні лабораторні чау та чисту воду, а всім мишам давали змогу акліматизуватися принаймні за 1 тиждень до експериментів. Суміш кетаміну при 100 мг/кг, ксилазину при 10 мг/кг та ацепромазину по 3 мг/кг вводили внутрішньочеревно для знеболення мишей перед інвазивною операцією. На основі різних цілей експериментів у цьому дослідженні було встановлено дві різні моделі ендометріозу мишей, як показано нижче. Еструальний цикл тварин синхронізували, передаючи змочену сечею чоловічу підстилку кожні 5 днів як для моделі миші з ІР, так і для ендометріозу. [27]. Усі експерименти на тваринах були схвалені Комітетом з етики експериментів на тваринах, Китайський університет Гонконгу.
Внутрішньочеревна (ІП) ендометріозна модель миші для терапевтичної безпеки та механістичного дослідження
Модель ендометріозу ІР була встановлена з незначними модифікаціями, як описано раніше [27, 28]. Коротко кажучи, мишей випадковим чином поділяли на дві групи - донорів або реципієнтів. На 0-й день матку видаляли від кожної донорської миші після умерщвлення і промивали в PBS 3 рази. Тканини ендометрію готували з кожного рогу матки 2-мм біопсійним пуншем. Після того, як тканини ендометрію були підготовлені, миші-реципієнта знеболювали і робили розріз 0,5-1 см на середній лінії стінки живота мишки та очеревини. Колон витягували обережно і підтримували гідратацію стерильним PBS. Три шматочки тканин ендометрію зашивали на судини брижі за допомогою 6–0 хірургічних ниток у кожної реципієнтної миші. Товсту кишку акуратно повернули в порожнину очеревини; стінку живота та шкіру закривали по 5–0 хірургічних ниток окремо. Потім мишей клали на теплу подушечку до повного відновлення наркозу після операції.
Модель миші для підшкірного (SC) ендометріозу для дослідження рецидивів
Ми встановили іншу модель ендометріозу миші шляхом трансплантації SC, щоб відстежувати динамічні зміни зростання ураження під час та після медичних втручань. Повідомлялося, що як модель ІР, так і СК демонструє подібний розвиток ендометріозу щодо цистоподібного росту, а також залозистої та епітеліальної структур уражень [27, 29]. Той самий штам C57BL/6 мишей використовували для встановлення моделі миші SC ендометріозу миші, як описано раніше [30, 31]. Коротко кажучи, матку видаляли з мишей-донорів, а тканини ендометрію готували як модель ІР, згадану вище. Під наркозом шкіру живота голили, а потім робили 3-міліметровий розріз шкіри на середній лінії живота кожної миші-реципієнта, а двосторонні кишені СК створювали обережно, не пошкоджуючи стінку живота. По одному шматочку тканини ендометрію поміщали в кожну кишеню, а потім розріз шкіри закривали 5–0 хірургічними нитками.
Вивчення ліків
Через тиждень після операції мишей випадковим чином розподілили на чотири групи. Будь-який носій (мишей обробляли подвійною дистильованою водою), аліцетат уліпрісталу (Esmya ™, 1 мг/кг, перорально, PregLem, Англія), дидрогестерон (Duphaston ™, 5 мг/кг, перорально, Abbott, США) або прогестин ( Dienogest ™, 0,3 мг/кг, перорально, Bayer, Німеччина) вводили перорально щодня. Рекомендована добова доза для перорального вживання для людини за інструкцією виробника Esmya, Duphaston та Dienogest становила 5 мг, 20-30 мг та 2 мг відповідно. Дозування кожного препарату для мишей базувалася на затвердженій FDA клінічній дозі для людини, а потім перетворювалася на дозу для тварин згідно з рекомендаціями калькулятора FDA на основі площі поверхні людей та експериментальних тварин [32]. Всі ліки розчиняли у відповідному обсязі подвійної дистильованої води в 100 мкл.
Для моделі ІР лікування тривало 28 днів. Для моделі СК ліки тривали 21 день. Зростання ендометріотичного ураження визначали шляхом вимірювання найбільшої довжини та перпендикулярної ширини уражень кожні 3 дні в моделі SC та наприкінці втручання в модель IP із застосуванням штангенциркуля, як описано раніше [31]. Потім усіх мишей забивали, а ураження видаляли і промивали в стерилізованому PBS, потім зважували на вазі. Для всіх уражень кожної миші одне ураження фіксували 10% формаліном (Sigma) і вносили у парафіновий віск для гістологічного аналізу; інші ураження або занурювали в пізній розчин РНК (Ambion ™) для аналізу qPCR, або заморожували в рідкому азоті для аналізу білка.
Розмір матки оцінювали шляхом вимірювання та усереднення найбільшого діаметра за допомогою штангенциркуля в середині кожного рогу матки. Яєчники розглядали як еліпсоїд, і розмір яєчників вимірювали та обчислювали за формулою [33]: 1/6 π × довжина × ширина × товщина (мм 3). Матку розсікали і зважували перед тим, як її розділили на 3 частини і зберігали так само, як і вогнища ураження. Яєчники розсікали, а потім або фіксували в 10% формаліні для гістологічного аналізу, або зберігали в РНК-пізньому розчині для аналізу qPCR.
Фарбування гематоксиліном та еозином
Після вбудовування серійні парафінові зрізи вогнищ ураження, матки та яєчників готували на слайдах з покриттям. Фарбування гематоксиліном та еозином проводитиметься у кожному 10-му відділі для підтвердження мікроскопічних структур уражень, матки та яєчників [34]. Вимірювали поверхню зрізів під мікроскопом.
Імуногістохімія та аналіз TUNEL
Проліферацію ураження оцінювали шляхом імуногістохімічного фарбування з використанням кролячих анти-мишачих антитіл Ki-67 (D3B5, технологія клітинної сигналізації). Після депарафінування та повторної гідратації антигени отримували цитратним буфером натрію в мікрохвильовій печі протягом 20 хв. Зрізи інкубували з 1% BSA у PBS при кімнатній температурі протягом 1 години, після чого інкубували з антитілом Ki-67 при 4 ° C протягом 15 годин. Після інкубації з первинним антитілом зрізи інкубували з вторинним антитілом Осличий анти-Кролячий IgG-HRP (sc2313, Santa Cruz) протягом 1 години при кімнатній температурі, а потім з кольором розробляли за допомогою набору DAB (k3468, Dako). Нарешті, зрізи були фарбовані гематоксиліном і зневоднені в етанолі серійної концентрації і змонтовані покривними стеклами. Всі зрізи досліджували під мікроскопом. Були підраховані клітини з сильним або помірним коричневим забарвленням в ядерних речовинах.
Апоптотичні клітини ураження досліджували за допомогою набору для виявлення апоптозу in situ (ApopTAG®, S7100, Мілліпоре, США) відповідно до інструкцій виробника.
Кількісний аналіз ПЛР
Кількість маткових залоз та індекс товщини ендометрію
Після фарбування гематоксиліном та еозином та дослідження під мікроскопом 6 серійних зрізів матки сканували за допомогою мікроскопа Leica зі збільшенням 100 ×. Для підрахунку маткових залоз підраховували всі залози в шарі ендометрію і усереднювали для статистичного аналізу. Індекс товщини ендометрія (ETI) оцінювали як метод, описаний раніше, з деякими модифікаціями [43]. Коротко, площу ендометрія (Ae) та порожнини матки (Auc) вимірювали за допомогою зображення J [44]. Потім ETI обчислювали за формулою \ (ETI = \ sqrt _ >>> - \ sqrt >> \)
Кількість фолікулів
Після фарбування гематоксиліном та еозином та дослідження під мікроскопом 3 послідовні зрізи яєчників сканували за допомогою мікроскопа Leica у збільшенні 40 ×. Класифікація фолікулів базувалася на морфологічних критеріях: первинні фолікули визначали як фолікули, які містять ооцит, оточений одношаровим клітиною гранульози; вторинні фолікули визначали як фолікули, які містять ооцити з 2 і більше шарами гранульозних клітин, а антральні фолікули визначали як фолікули, що містять ооцити, які оточені декількома шарами гранульозних клітин і містять видимий антральний отвір [45, 46]. Кількість фолікулів у кожній класифікації у кожній пробі вимірювали та порівнювали.
Імуноферментний аналіз
Сироватку та перитонеальну рідину збирали для імуноферментних аналізів. Цільну кров відбирали шприцом об'ємом 1 мл із голкою 25G із серця миші, а потім центрифугували при 4 ° C з 1000 × g протягом 10 хв. Сироватку збирали після центрифугування і зберігали при -80 ° C. Перитонеальну рідину збирали, як описано раніше, з деякими модифікаціями [47]. Мишей жертвували передозуванням анестетика; шкіру відкрили, щоб оголити живіт. 3 мл стерилізованого PBS та 2 мл повітря вводили в очеревину за допомогою шприца 5 мл та голки 21G. Потім залишки очеревини видаляли і центрифугували при 4 ° C, 1000 × g протягом 10 хв, супернатант витримували при -80 ° C перед аналізом. Рівні естрадіолу (E2) та прогестерону (P4) у сироватці крові та концентрації простагландину E2 (PGE2) у очеревинній рідині вимірювали за допомогою наборів ELISA (Abcam, Англія) згідно з інструкцією виробника.
Статистичний аналіз
Статистичний аналіз проводили за допомогою програмного забезпечення Graphpad Prism 5, відмінності між групами лікування та контрольною групою оцінювали за допомогою One Way ANOVA, якщо розподіл даних нормальний, або тестом Крускала – Уолліса, якщо розподіл даних перекосився з подальшими порівняннями Даннетт. Дані були виражені як середнє значення ± SEM. стор
Результати
Зростання позаматкових ендометріотичних уражень
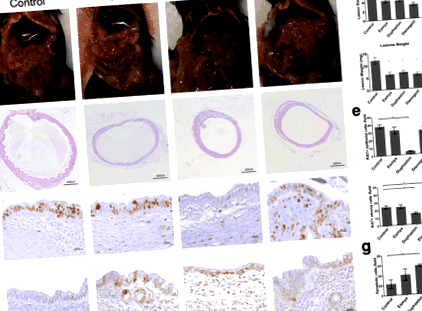
Після трансплантації ІР в брижі розвинулися ендометріотичні ураження (рис. 1а). Порівняно з контролем транспортного засобу (розмір: 6,744 ± 0,444 мм 2; вага: 12,1 ± 1,383 мг, n = 9), розмір ураження та вага значно зменшились після лікування препаратом Есмія (розмір: 4,171 ± 0,442 мм 2, стор 2, стор 2, стор Рис. 1
Лікувальні дії
Профілі безпеки
Знятий рецидив
Після трансплантації SC Дюфастон значно зменшив розмір ураження з 9-го дня (3,609 ± 0,176 мм 2, n = 10, стор = 0,0418) лікування, потім Дієногест з 12-го дня (3,397 ± 0,157 мм 2), n = 10, стор = 0,0024) та Esmya з 15-го дня (3,585 ± 0,160 мм 2, n = 10, стор = 0,0223) у порівнянні з контрольною групою (4,689 ± 0,328 мм 2 або 4,843 ± 0,199 мм 2 або 4,844 ± 0,0200 мм 2, 9 день, 12 день, 15 день відповідно) (рис. 4). Коли лікування було скасовано на 21 день, розмір ураження групи Дієногеста залишався значно меншим лише до 36 дня (4,686 ± 0,377 мм 2 проти 6,028 ± 0,394 мм 2, n = 10, стор = 0,0168), через 14 днів після відміни. Розмір уражень груп Дюфастон та Есмія залишався значно меншим до 39-го дня (Дюфастон проти контролю: 4,588 ± 0,324 мм 2 проти 6,001 ± 0,233 мм 2, n = 10, стор = 0,0255) і день 48 (Esmya проти контролю: 4,962 ± 0,556 мм 2 проти 6,577 ± 0,379 мм 2, n = 10, стор = 0,0352), 18 днів та 27 днів після відміни відповідно.
Обговорення
Це перше дослідження, яке порівнювало антиендометріоз, терапевтичний механізм, профіль безпеки та вилучений рецидив Есмії, Дюфастона та Дієногеста в експериментальній моделі ендометріозу на мишах. Результати показали, що Esmya, Duphaston та Dienogest можуть ефективно обмежувати ріст та розвиток ендометріотичних уражень (табл. 1). Терапевтичні ефекти в основному здійснюються за рахунок інгібування проліферації прогестерону та клітинної проліферації та активації механізмів апоптозу. Зокрема, Дюфастон суттєво пригнічував проліферацію як епітеліальних клітин, так і клітин строми та активував апоптоз при ендометріотичних ураженнях. Незважаючи на широкий запас міцності, Дюфастон викликав атрофію ендометрію, Дієногест посилив гіперплазію залози ендометрія, Есмія збільшив адгезію ураження та накопичення антрального фолікула та рецидив незабаром після виведення Дієногеста та Дюфастона.
Висновок
Усі препарати Есмія, Дюфастон та Дієногест можуть пригнічувати ендометріотичний ріст на моделі миші, і Діеногест має найкращий пригнічуючий ефект. Esmya має значний пригнічуючий ефект овуляції, а Дюфастон може пригнічувати ріст ендометрія, в той час як значного побічного ефекту Дієногест на яєчники та ендометрій не виявлено. Детальний супресивний ефект ендометріотичного ураження та побічний ефект на яєчник або ендометрій досі не ясні, і необхідно провести подальші дослідження.
- Інститут FSPCA Preventive Controls for Food Food Safety Food Preventive Controls Controls (FSPCA)
- Профіль серцево-судинної безпеки та клінічний досвід застосування високих доз домперидонової терапії при нудоті
- Визначення вмісту вологи - якість їжі; Безпека
- КБР для дослідження вугрів, ефективності, застережень та іншого
- Ефективність та безпека прямих пероральних антикоагулянтів проти варфарину у пацієнтів із ожирінням із гострою ожирінням