Дієта з високим вмістом солі диференціально модулює механічну активність аферентної та еферентної лімфатичної системи збору в мишачих клубових лімфатичних вузлах
Рісуке Мізуно
1 кафедра ветеринарної фармакології, Вища школа сільського господарства та наук про життя Токійського університету, Токіо, Японія.
2 Кафедра молекулярно-судинної ендокринології, Вища медична школа Токійського університету, Токіо, Японія.
Масасі Іссікі
3 Кафедра ендокринології та діабету Медичного факультету Медичного університету Сайтама, Сайтама, Японія.
Нобуюкі Оно
4 Кафедра електроніки та керування, Національний технологічний коледж Нагано, Нагано, Японія.
Міцухіро Нісімото
5 Відділ клінічної епігенетики, Науково-дослідний центр перспективних наук і технологій, Токійський університет, Токіо, Японія.
Тошіро Фуджіта
4 Кафедра електроніки та керування, Національний технологічний коледж Нагано, Нагано, Японія.
Анотація
Передумови: Лімфатична система сприяє рідинному гомеостазу в різних тканинах. Останні дані свідчать про те, що лімфангіогенез, спричинений дієтою з високим вмістом солі (HSD), пов'язаний з регуляцією артеріального тиску. Лімфатичні вузли, розташовані вздовж лімфатичних шляхів, є не тільки важливими вторинними лімфоїдними тканинами для метастазування раку, запалення та імунної відповіді, але також важливі для рідинного гомеостазу. Аферентні лімфатики збирають лімфу з передвузлової області, а еферентні лімфатики відводять лімфу з лімфатичних вузлів. Однак різниця в механічній активності між аферентною та еферентною лімфатикою та ефектом HSD на ці судини не була показана.
Методи та результати: Зміни механічної активності ізольованих аферентних та еферентних лімфатичних речовин у звичайній сольовій дієті (NSD) та 4-тижневих мишах HSD у відповідь на підвищення внутрішньосвітлового тиску з 3 до 7 смH2O вимірювали за допомогою відеомікроскопії. Більш високий внутрішньомуральний тиск еквівалентно знижував насосну активність аферентної та еферентної лімфатичної системи у мишей NSD. HSD пригнічував амплітуду, фракцію викиду та ударний об’єм аферентної лімфатичної системи, що призводило до помітного зменшення насосної активності. Навпаки, накачувальна дія еферентної лімфатичної системи була стійкою до HSD і зберігалася шляхом підвищення частоти скорочень.
Висновки: HSD диференційовано модулював механічну активність аферентної та еферентної збірної лімфатичної системи в мишачих клубових лімфатичних вузлах.
Вступ
Лімфатична система відіграє важливу роль у регуляції транспорту позаклітинних рідин та високомолекулярних речовин, таких як альбумін та гіалуронова кислота, у фізіологічних та патофізіологічних умовах. 1,2 Ця мікроциркуляторна система, яка включає лімфатичні вузли, також діє як шлях для торгівлі лімфоцитами та макрофагами під час імунологічних реакцій та для клітин карциноми в лімфатичних метастазах. 1,3 Лімфатичні вузли відіграють ключову роль в імунітеті. Наприклад, породжені тимусом Т і отримані з кісткового мозку В-клітини розподіляються у вторинні лімфоїдні тканини, включаючи лімфатичні вузли, плями Пайєра, мигдалини, вилочкову залозу та апендикс. Клітини Т і В потрапляють у вторинні лімфоїдні тканини через високі ендотеліальні венули (HEV). Лімфоцити, які виходять з лімфатичних вузлів, повертаються до венозної системи через еферентні лімфатичні судини і грудну протоку.
Нещодавно були виявлені специфічні молекули адгезії, які беруть участь у взаємодії між HEV та лімфоцитами. 4 Повідомляється, що клітини, що плавають у інтерстиціальних просторах та лімфатичних капілярах, відомі як початкові місця метастазування раку, взаємодіють через цитокіни або хемокіни. 5 Крім того, клінічне обстеження сторожових лімфовузлів є вигідним для онкологічних хворих для поліпшення якості життя, запобігаючи вторинному набряку лімфи та зменшуючи хірургічну травму. 6–8 Таким чином, у патофізіології лімфатичної системи лімфатичний вузол є критичним фактором для динаміки лімфи.
Лімфатичні вузли мають унікальну структуру, що включає циркуляцію крові та лімфи. Взагалі, кілька аферентних лімфатичних судин з'єднуються з лімфатичними вузлами, а одна або кілька відносно великих еферентних лімфатичних судин відводять лімфу з вузлів. Ці аферентні та еферентні лімфатичні судини, які проникають в лімфатичні вузли, працюють як серія лімфатичних насосів, що рухають внутрішньовузлову лімфатичну рідину шляхом коливальних звужень та розширень, а також відводять лімфу з периферійних відділів. Клітини гладких м’язів у лімфатичних судинах людини та тварин проявляють внутрішню спонтанну активність і служать головним механізмом роботи насоса in vivo та ex vivo. 1 Внутрішньопросвітній тиск лімфатичної системи - один з найважливіших факторів регулювання спонтанного скорочення гладкої мускулатури лімфатичної системи. Підвищення внутрішньосвіткового тиску збільшує частоту і зменшує амплітуду коливальних змін діаметра лімфатичних судин. 9-11 Незважаючи на великі дослідження лімфатичної системи, функціональний аналіз аферентної та еферентної лімфатики не був повністю показаний.
Гіпертонія є основним фактором ризику таких захворювань, як інсульт, серцева недостатність та захворювання нирок. Високе споживання солі тісно пов’язане з патогенезом та розвитком чутливої до солі гіпертонії. 12 Завантаження солі через неефективну ниркову екскрецію натрію часто призводить до збільшення обсягу циркулюючої рідини в організмі. Як вплив навантаження солі на лімфатичну систему, Machnik et al. повідомив про судинний ендотеліальний фактор росту (VEGF) -C опосередковує гіперплазію лімфатичних капілярів у вухах гризунів та запропонував, щоб капіляри допомагали підтримувати рідинний гомеостаз та артеріальний тиск. 13 Однак індуковані солями функціональні зміни лімфотранспортної системи залишаються нехарактерними для збору лімфатичної системи, особливо в судинах, що проникають через лімфатичні вузли. Отже, у цьому дослідженні ми досліджували вплив внутрішньосвітлового тиску на механічну активність аферентної та еферентної лімфатичної системи в лімфатичних вузлах після нормальної сольової дієти (NSD) та дієти з високим вмістом солі (HSD).
Матеріали і методи
Тварини
Самців мишей ICR віком 5 тижнів (n = 34, Токіо Дзіккен Добцуцу, Токіо, Японія) поділяли на групи NSD (n = 17) та HSD (n = 17). Мишей NSD годували стандартною гранульованою дієтою та водою протягом 9 тижнів. Мишей HSD годували NSD протягом 5 тижнів, а потім отримували HSD (8% NaCl; w/v) та 1% (w/v) фізіологічний розчин протягом 4 тижнів. Комітет з етики тварин Токійського медичного факультету затвердив усі експериментальні протоколи відповідно до принципів та рекомендацій з догляду за тваринами Фізіологічного товариства Японії.
Дослідження in vivo: Вимірювання артеріального тиску та серцевого ритму
Артеріальний артеріальний тиск та частоту серцевих скорочень мишей NSD (n = 5) та HSD (n = 5) вимірювали методом хвостової манжети (BP-98A-L, Natsume).
Дослідження ex vivo: Препарати тканин
Мишей приносили в жертву сильним ударом по голові з подальшим обезголовленням. Після розрізу на черевній порожнині аферентну та еферентну лімфатику з клубовими лімфатичними вузлами вирізали і помістили в чашку Петрі, що містить холодний (4 ° C) розчин Кребса-бікарбонату (в мМ: 120,0 NaCl, 5,9 KCl, 2,5 CaCl2, 1,2 MgSO4, 1,2 NaH2PO4, 5 глюкози та 25,0 NaHCO3). 14,15
За допомогою мікрохірургічних інструментів та операційного мікроскопа лімфатичні судини виділяли, а потім переносили в 10-міліметрову органну камеру з двома скляними мікропіпетками, що містять розчин бікарбонату Кребса. Після того, як кожну лімфатичну посудину встановили на піпетку (проксимальну) і закріпили швами, перфузійний тиск підвищували до 4 смH2O для промивання та очищення судини. Згодом дистальний кінець посудини був встановлений на випускній мікропіпетці (дистально). Проксимальні та дистальні мікропіпетки з'єднували за допомогою трубки Tygon шприцом об'ємом 10 мл та краном, відповідно. Розчин Кребса-бікарбонату, який барботував з 5% СО2/10% O2/85% N2 (об/об), перфузували екстралюмінально над лімфатичною системою в органній камері. Протягом всього експерименту швидкість потоку суперсплавленого розчину підтримували на рівні 2,5 мл/хв. Після канюляції лімфатичної камери камеру перенесли на стадію мікроскопа (Olympus BH-2, Токіо, Японія). Потім лімфатичну систему повільно нагрівали до 37 ° C і давали рівновагу протягом ∼90 хв.
Вимірювання механічних характеристик лімфатичних судин
Для вимірювання механічної активності ізольованих лімфатичних судин ми використовували систему відеомікроскопії, як описано раніше. 14,15 Об'єктив (x10) та монохромна зарядна камера (KOCOM, KCB-270A, Корея) використовувались для отримання зображень лімфатичних процесів, які відображались на монохромному телевізійному моніторі (Hamamatsu Photonics, C1846, Hamamatsu, Японія). Діаметр лімфатичної системи вимірювали за допомогою пристрою для виявлення діаметра методом крайового виявлення. 16 Вони були записані на DVD-рекордер (Pioneer, DVR55, Токіо, Японія) та осцилограф прямого запису (Sanei-Sokki, Recti 8K, Токіо, Японія). Довжина ізольованих аферентних та еферентних зразків після канюляції становила 2–3 мм та 4–5 мм відповідно. Судини, використані в цьому дослідженні, містили один клапан, і ми вимірювали його діаметр перед клапаном. 14,15
У цьому дослідженні ми вимірювали пасивний діаметр (PD; мкм), активні діаметри (максимальний діаметр; Dmax мкм та мінімальний діаметр; Dmin мкм) та частоту (хв -1) лімфатичної активності у мишей NSD та HSD. Ми розрахували амплітуду (Dmax-Dmin), частку викиду (EF; (πDmax 2 -πDmin 2)/πDmax 2), індекс ударного об'єму (SVI; πDmax 2 -πDmin 2) та частоту SVI. 16
Вплив внутрішньосвіткового тиску на лімфатичну функцію в судинах NSD та HSD
Після періоду рівноваги при внутрішньосвітловому тиску 5 смH2O внутрішньосвітловий тиск підвищували з 3 до 7 смH2O за кроки 2 cmH2O шляхом підняття шприца 10 мл, підключеного до вхідного шлангу, тоді як випускний шланг був закритий краном протягом усього експерименту . Кожен рівень тиску підтримувався протягом ~ 15 хв, щоб судини могли демонструвати стабільні та спонтанні коливання діаметру. В кінці кожного експерименту розчин Кребс-бікарбонату змінювали на розчин Кребс-бікарбонату, що не містить Са 2+, який також містив етилендіамінтетраоцтову кислоту (ЕДТА; 1 мМ) і ніфедипін (блокатор каналів Са 2+, 10 мкМ). Лімфатичні судини інкубували з розчином без Ca 2+ протягом ~ 20 хв і етапи тиску повторювали. PD вимірювали при кожному значенні тиску. 9–11
Наркотики
Всі солі та ЕДТА були отримані від Wako (Осака, Японія); ніфедипін був від Sigma Aldrich (Сент-Луїс, Міссурі, США).
Статистика
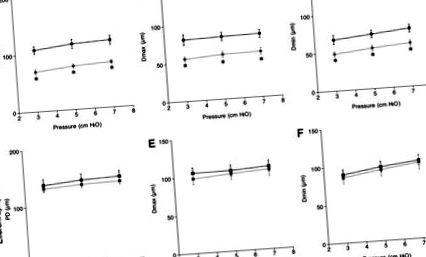
Зміни діаметрів судин після підвищення внутрішньосвіткового тиску виражали у відсотках до відповідної PD (діаметр 100 × у присутності позаклітинного Ca 2+/діаметр у відсутність позаклітинного Ca 2+). 9–11 Дані представлені як середнє значення ± стандартна похибка середнього значення, а n вказує кількість судин. Суттєві відмінності (p Рис. 1A – F). Три параметри (PD, Dmax та Dmin) як аферентних, так і еферентних лімфатичних судин збільшились у відповідь на підвищений внутрішньосвітловий тиск від 3 до 7 смH2O із навантаженням солі або без нього (рис. 1A-F). HSD суттєво знизив PD, Dmax і Dmin аферентних лімфатичних судин, але не таких еферентних лімфатичних судин у діапазоні внутрішньопросвітнього тиску, який ми тестували (рис. 1A-C).
Зміни пасивного діаметра (PD; мкм, (A) NSD та (D) HSD), максимальний діаметр (Dmax; мкм, (B) NSD та (E) HSD) та мінімальний діаметр (Dmin; мкм, (C) NSD та (F) HSD) лімфатичної системи у відповідь на підвищення внутрішньосвіткового тиску. Верхня та нижня панелі позначають аферентну (кола) та еферентну (квадрати) лімфатичну клітину відповідно. Сині та червоні символи позначають судини, ізольовані від мишей NSD (n = 6) та HSD (n = 6), відповідно. * р 2+ розчин Кребс-бікарбонату/діаметр у розчині Кребс-бікарбонату, вільний від Са 2+. 9,10
У відповідь на збільшення внутрішньосвітлового тиску з 3 до 7 смH2O,% Dmax аферентних лімфатичних судин при NSD (від 75 ± 2% до 71 ± 2%, n = 6) та HSD (від 80 ± 4% до 75 ± 4%, n = 6) миші лише незначно зменшились, демонструючи негативний зв’язок між тиском та% Dmax у мишей NSD (-1,0 ± 0,5, n = 6) та HSD (-1,3 ± 1, n = 6). Не було значних відмінностей у% Dmax та нахилах між мишами NSD та HSD (рис. 2А). Таким чином, HSD не впливав на міогенний тонус аферентної лімфатичної системи, який дещо підвищувався вищим тиском. % Dmin аферентних лімфатичних судин у мишей NSD та HSD був постійним під внутрішньосвітловим тиском від 3 до 7 смH2O. % Dmin аферентної лімфатичної системи у мишей HSD (70 ± 3%, n = 6) у 5 смH2O був значно більшим, ніж у мишей NSD (63 ± 2%, n = 6), що свідчить про зниження скоротливості після HSD (рис. 2B). Взаємозв'язок між тиском та% Dmin не суттєво відрізнявся між мишами NSD (0,7 ± 0,4, n = 6) та HSD (-0,5 ± 0,7, n = 6).
Зміни внутрішньопросвітнього тиску в% максимального діаметра (% Dmax, (A) NSD та (B) HSD) та% мінімального діаметра (% Dmin, (C) NSD та (D) HSD), виражене у відсотках від відповідного пасивного діаметра лімфатичної системи. Верхня та нижня панелі позначають аферентну (кола) та еферентну (квадрати) лімфатичну клітину відповідно. Сині та червоні кола позначають судини, виділені від NSD (n = 6) та HSD (n = 6) мишей, відповідно. * p Рис. 2C). Підвищення тиску збільшило% Dmin еферентної лімфатичної системи у мишей NSD та HSD без суттєвих відмінностей між мишами NSD та HSD при тиску від 3 до 7 смH2O. Позитивний зв’язок між тиском та% Dmin спостерігався у мишей NSD (1,4 ± 0,1, n = 6) та HSD (1,9 ± 0,6, n = 6), однак між групами не було суттєвої різниці (рис. 2D). Таким чином, міогенний тонус аферентних та еферентних лімфатичних судин був майже ідентичним, залишався незмінним у відповідь на підвищення внутрішньомурального тиску і не зазнавав впливу навантаження солі. Скорочуваність як аферентних, так і еферентних лімфатичних судин зменшилася аналогічним чином у відповідь на підвищення внутрішньомурального тиску. Однак скорочуваність лише аферентних лімфатичних судин зменшувалась HSD при тиску 5 смH2O.
Інотропізм та хронотропізм аферентних та еферентних лімфатичних судин у мишей NSD та HSD: відповіді на підвищений внутрішньосвітковий тиск
Для подальшого з'ясування впливу HSD на інотропізм та хронотропізм насосної активності вхідних і вихідних отворів в клубових лімфатичних вузлах, ми розрахували амплітуду, EF, частоту, SVI та частоту × SVI лімфатичних судин від мишей NSD та HSD у відповідь до підвищення внутрішньосвіткового тиску.
Підвищення внутрішньосвітлового тиску з 3 до 7 смH2O зменшило амплітуду та ЕФ, інотропні параметри насосної активності, аферентну та еферентну лімфатику, вказуючи на те, що збільшення внутрішньосвітлового тиску спричинило негативний інотропний ефект на спонтанне скорочення аферентної та еферентної лімфатики як при НСД Миші HSD (рис. 3A – D). Незважаючи на те, що амплітуда та ЕФ аферентної та еферентної лімфатичної системи після НСД були подібними, ГСД суттєво зменшив інотропні параметри в аферентних лімфатичних судинах (рис. 3А, В), але не в еферентних лімфатичних судинах (рис. 3С, D), що вказує що велике навантаження солі вибірково пригнічує активність інотропної помпи в аферентних лімфатичних судинах лімфатичних вузлів, не впливаючи на еферентні частини.
- Чи може дієта Ікігай допомогти деменції Частина 5 Розумові вправи Яку діяльність рекомендує ШІ для довголіття
- Зміна дієти, фізичної активності та маси тіла у першокурсниці - PubMed
- Діяльність, дієта та соціальна практика - вирішення повсякденного життя в скелетах людини залишається Сара
- Більш здорове майбутнє - дії та амбіції щодо дієти, активності та здорової ваги
- Методи зміни поведінки, орієнтовані як на дієту, так і на фізичну активність при цукровому діабеті типу 2