Дієта, мікробіом та кишковий епітелій: основний тріумвірат?
Хав'єр Рівера Гусман
1 Кафедра фармакології, Медичний факультет Університету Північної Кароліни, CB 7032, 103 Mason Farm Road, Chapel Hill, NC 27599, США
2 Центр шлунково-кишкової біології та хвороб, Університет Північної Кароліни, Медичний факультет, CB 7032, 103 Mason Farm Road, Chapel Hill, NC 27599, США
Вікторія Сьюзен Конлін
3 Департамент біології, Vertex Pharmaceuticals Inc., Лаваль, КК, Канада H7V 4A7
Крістіан Джобін
1 Кафедра фармакології, Медичний факультет Університету Північної Кароліни, CB 7032, 103 Mason Farm Road, Chapel Hill, NC 27599, США
2 Центр шлунково-кишкової біології та хвороб, Університет Північної Кароліни, Медичний факультет, CB 7032, 103 Mason Farm Road, Chapel Hill, NC 27599, США
4 Медичний факультет, Університет Північної Кароліни, Чапел-Гілл, штат Північна Кароліна 27599, США
5 Кафедра мікробіології та імунології, Університет Північної Кароліни, Чапел-Гілл, NC 27599, США
Анотація
Кишковий епітелій являє собою важливий бар’єр, що захищає господаря від різноманітних просвітницьких шкідливих агентів, а також запобігає безконтрольному засвоєнню бактерій, які можуть активувати імунну відповідь у сприйнятливого господаря. Епітеліальний моношар, що становить цей бар’єр, регулюється сіткою білків, що організовують складну біологічну функцію, таку як проникність, трансепітеліальний електричний опір і рух різних макромолекул. Завдяки своїй ключовій ролі у підтримці гомеостазу господаря, фактори, що регулюють бар’єрну функцію, привертали постійну увагу дослідницького співтовариства. У цій роботі буде розглянуто роль бактерій, метаболізм, отриманий від бактерій, та взаємодію дієтичних факторів у контролі функції кишкового бар'єру.
1. Вступ
Епітелій кишечника еволюціонував в унікальному середовищі, де дієтичні метаболіти, бактерії та метаболіти, похідні бактерій, є всюди. Це середовище, ймовірно, забезпечує синергетичну взаємодію між цим тристороннім процесом, яка потенційно впливає на кожен компонент. Наприклад, епітелій впливає на мікробні спільноти, виробляючи різні продукти муцину та антимікробні фактори, які обмежують колонізацію та приєднання бактерій. Крім того, бактерії забезпечують як побічні продукти свого метаболізму різні сполуки (необхідні вітаміни, антиоксиданти, коротколанцюгові жирні кислоти (SCFA) тощо), які впливають на гомеостаз господаря [1, 2]. Нарешті, склад дієтичного споживання також може мати значний вплив як на епітеліальний бар’єр кишечника, так і на бактеріальні спільноти [3–5].
У цій роботі ми зосереджуємося на огляді останніх нових досліджень, які намагаються об'єднати елементи цих трьох областей: кишковий епітеліальний бар'єр, мікробіом та дієтичне споживання, зокрема, як вони взаємодіють та модулюють один одного. Ми обговоримо нові дослідження молекулярних ефектів коротколанцюгових жирних кислот, їх вироблення бактеріями через вживання пребіотичних клітковин та стійких крохмалів, а також нові деталі пробіотиків та їх механізмів дії.
2. Кишковий бар’єр
З усіх трансмембранних білків (клаудини, окклюдин, MarvelD3, JAM-A, трицелюлін та стимульований ліполізом рецептор ліпопротеїнів, LSR) [11–13], клаудини визначають селективну проникність бар’єру. Це досягається різними моделями заряджених амінокислот у позаклітинних петлях окремих білків клаудину, які взаємодіють, утворюючи пори різного розміру, через які відбувається перенесення розчиненої речовини [14–17].
Хоча стабільність TJ необхідна для підтримання цілісності бар’єру, формування TJ має бути динамічним, щоб забезпечити оборот клітин епітеліальних клітин, що відбувається кожні 4-5 днів [18]. З цією метою білки TJ постійно інтерналізуються та рециркулюють назад до плазматичної мембрани через ендоцитоз. У нормальних фізіологічних умовах макроскопічне оновлення TJ включає безперервне руйнування і реформування ниток, що включає опосередкований клатрином ендоцитоз [19, 20]. На відміну від цього, клаудини переробляються за механізмом, подібним до механізму, який використовується для інтерналізації щілинних з’єднань, де мембрани TJ ендоцитуються разом в одну з суміжних клітин [21]. Під час інтерналізації клаудини відокремлюються від інших білків TJ і утворюють збагачені клаудином везикули, які мають потенціал регулювати склад клаудину TJ.
Оборот ТЖ та експресія клаудину також можуть модулюватися цитокінами як правдоподібний механізм міграції нейтрофілів через епітеліальні бар'єри [22]. Зокрема, ФНП підвищував парацелюлярну проникність in vitro за рахунок зниження регуляції клаудину [23]. Крім того, інтоксикація білками TJ цитокінами може бути блокована in vitro за допомогою інгібіторів опосередкованого клатрином ендоцитозу [20]. Рециркуляція TJ також може бути викрадена патогенними бактеріями (наприклад, ентеропатогенні кишкова паличка, H. pylori та C. difficile) [24]. Індуковане бактеріями запалення також збільшує інтерналізацію клаудину та збільшує проникність [25, 26]. Макропіноцитоз - це ще один шлях, за допомогою якого білки TJ можуть бути інтегровані [27] та колокалізовані маркерами ранніх та рециркулюючих ендосом. Ці дані вказують на правдоподібний механізм швидкого перерозподілу білка назад до TJ, ущільнюючи епітеліальний бар'єр після того, як запальна інсульт стихла [28].
Фізіологічна регуляція бар’єрного гомеостазу залежить від жорстко контрольованих шляхів передачі сигналу, які сходяться на цитоплазматичних білках TJ [29–36]. Цитоплазматичні білки TJ (ZO-1, -2 та -3; цингулін та афадин) пов'язують трансмембранні білки з актиновим цитоскелетом, а також виступають в якості опор для основних сигнальних комплексів [29, 30, 37–39]. Фосфорилюючі компоненти цитоскелета, а саме легкий ланцюг міозину (MLC) через міозинову кіназу легкого ланцюга (MLCK) або Rho-асоційовану кіназу (ROCK), призводять до його скорочення, що відокремлює TJ і підвищує парацелюлярну проникність [28, 40–42 ]. На додаток до фізичного поділу TJ, ROCK порушує цілісність бар’єру, посилюючи ендоцитоз білків TJ [28]. Сучасна думка припускає, що регулювання TJ є делікатним балансом між взаємодіючими мережами, що включають протеїнкіназу C (PKC), протеїнкіназу A (PKA), мітоген-активовані протеїнкінази (MAPK) та фосфоїнозитид 3-кіназу (PI3-K) [42– 45].
Зрозуміло, що зміни в нормальних шляхах трансдукції сигналу, що впливають на бар'єрний гомеостаз (проліферація/апоптоз/некроптоз), призводять до нерегульованого проходження просвітніх бактерій через епітелій і подальшої аномальної активації імунної системи слизової, що призводить до запалення [40, 56, 57 ]. Все більше доказів також вказує на те, що бар’єрна функція та її складна регуляторна мережа знаходяться під впливом мікробіоти та дієтичних компонентів, як безпосередньо через ендогенно продуковані мікробні продукти, так і опосередковано через метаболіти в дієті господаря.
3. Мікробні продукти та кишковий епітеліальний бар’єр
Широкий спектр рецепторів розпізнавання образів (PRR) бере участь у зондуванні/виявленні різних мікробних структур, таких як мембранні компоненти, нуклеїнові кислоти та апарати рухливості [58].
Толлоподібні рецептори (TLR) та Nod-подібні рецептори (NLR) є, мабуть, найбільш вивченими PRR у кишечнику, і їх внесок у бар’єрну функцію досліджували за допомогою різних моделей пошкодження кишечника [59–61]. Наприклад, передача сигналів TLR2 через PKC є суттєвою для посилення бар’єрної функції, пов’язаної з ZO-1, у клітинах епітелію кишечника після впливу декстран-сульфат-натрію (DSS) [62]. Крім того, було показано, що TLR4 та сигнальний білок MyD88 відіграють благотворну роль у загоєнні ран та відновленні цілісності бар’єру при гострій травмі, спричиненій DSS [63]. Крім того, делеція сигнальних молекул за TLR, таких як основний модулятор ядерного фактора kappa B (NF-κB) (NEMO), транскрипційна субодиниця NF-κB RelA, TGF-β-активована кіназа та інші кінази IκB в кишковому епітелії призводить до підвищеної сприйнятливості до коліту [64–67].
Хоча ці висновки підкреслюють важливу роль мікробних структур у регуляції бар’єрної функції, ще один рівень складності полягає у взаємозв’язку між біологічно активним потенціалом мікробіоти та кишковим бар’єром. Дійсно, ідентифікація специфічних мікроорганізмів, що продукують сполуки, що беруть участь у модуляції кишкової бар’єрної функції, привернула надзвичайну увагу.
Мікроорганізми та пов'язаний з ними геном (
Ще однією лактобактерією з терапевтичним потенціалом є L. brevis SBC8803, яка, на відміну від LGG, має сприятливі ефекти, якщо вводити її як теплозабиту, ліофілізовану очистку монокультур. У недавньому звіті вбита від нагрівання L. brevis змогла залежно від дози індукувати білки теплового шоку (Hsp) 25, 27 та 70 in vitro, використовуючи клітинні лінії товстої кишки Caco-2, Hsps, які є важливими білками, спричиненими стресом. бере участь у захисті епітелію товстої кишки від бактеріального ураження [90–92]. Щоденне трансанальне введення 0,1% ліофілізованої культури L. brevis у фізіологічному розчині зменшувало індуковане DSS запалення кишечника, покращувало виживання та зменшувало експресію TNF-α, IL-12 та IL-1β [72], підкреслюючи важливість виявлення різні механізми дії різних лактобактерій.
4. SCFA, що продукується бактеріями, та кишковий епітеліальний бар’єр
Анаеробне середовище кишечника дозволяє певним мікробам кишечника використовувати поживні речовини шляхом бродіння поживних речовин, що проходять через просвіт, що призводить до утворення великої кількості метаболітів. Серед метаболітів, що виробляються цим процесом, є такі важливі вітаміни, як вітамін К та більшість водорозчинних вітамінів групи В, такі як біотин, кобаламін та рибофлавін [101], які потім поглинаються господарем [102]. Також серед цих метаболітів є SCFA, такі як пропіонат, ацетат та бутират, отримані з харчових волокон, ферментовані вуглеводи та стійкі крохмалі, які не розщеплюються у верхніх відділах травного тракту [103]. Ферментація харчових волокон є важливою для гомеостазу кишечника, оскільки цей процес індукує моторику верхніх відділів шлунково-кишкового тракту [104] та гормони ситості глюкагоноподібний пептид-1 (GLP-1) та пептид YY (PYY) [105–108]. Крім того, не тільки ці SCFA демонструють терапевтичний потенціал у лікуванні пацієнтів із ВЗК [109, 110], але ці похідні бактерій також, як видається, додатково покращують здоров’я товстої кишки [111]. Цікаво, що у пацієнтів з виразковим колітом (УК) порушується метаболізм бутиратів [112]. Таким чином, молекулярні механізми дії цих SCFA стали предметом все більших досліджень.
Наявність SCFA в кишечнику безпосередньо впливає на бар’єрну проникність. Наприклад, було показано, що бутират захищає моношари клітин Caco-2 від вторгнення та транслокації Campylobacter jejuni залежно від концентрації шляхом збільшення трансепітеліального електричного опору (TEER) [113]. Подібним чином було показано, що бутират, але не суміш бутирату, ацетату та пропіонату, значно зменшує збільшення проникності кишечника, транслокацію бактерій та гістологічну шкоду, спричинену впливом хіміотерапевтичного агента 5-фторурацилу на мишах [114]. На відміну від першого дослідження, при використанні моношарів T-84 та Caco-2 було показано, що TEER збільшується за допомогою всіх трьох окремих SCFA або їх суміші [115]. Здатність бутирату збільшувати TEER може бути пов’язана з його здатністю збільшувати білки цингуліну, ZO-1 та ZO-2 та рівні мРНК, як показано у фібробластах Щура-1 [116]. В тому ж дослідженні було показано, що бутират підвищує рівень білка цингуліну в клітинах COS-7 та як цингулін, так і оклюдин у клітинах HeLa [116]. Ці висновки свідчать про те, що SCFA посилює бар’єр за рахунок збільшення виробництва білка як TEER, так і TJ.
Окрім дослідження молекулярних шляхів, що беруть участь у передачі сигналів SCFA, привертають увагу ідентифікація бактерій та груп бактерій, що продукують SCFA, а також дієтичний компонент, що впливає на них.
Характеристика складної мікробної екологічної системи, присутньої в кишечнику, з використанням методів секвенування рибосомних 16S показала, що в мікробіомі людини переважають два типи - Firmicutes (
75%) та Бактероїдети (
5. Молоко, бактерії та епітеліальний бар’єр кишечника
Ці дослідження представляють цікавий момент, який показує, як на перший погляд нешкідливий харчовий продукт, такий як молоко, може мати далекосяжні наслідки для мікробіоти кишечника людини. Хоча безпосередній вплив на бар'єрну функцію в цих дослідженнях не вивчався, використання колітних моделей забезпечує щонайменше орієнтир для потенційних сприятливих ефектів і допоможе визначити молекулярні механізми дії.
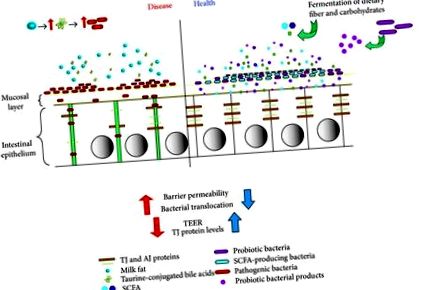
Незважаючи на те, що ландшафт кишкових бар'єрів - це дуже складне середовище, разом узяті, тепер ми можемо уявити його як такий, при якому вживання дієти впливає на кишечник одним із двох способів. З одного боку, це може впливати на кишечник, сприяючи збільшенню патогенних або умовно-патогенних бактерій і тим самим пошкоджуючи бар’єр через збільшення проникності та транслокації бактерій, а також зменшення білків TJ та TEER, що призводить до такої патології, як запалення. З іншого боку, дієта, що включає пробіотичні види бактерій або пребіотичні волокна, що призводять до SCFA, зміцнить епітеліальний бар’єр за рахунок збільшення білків TJ і TEER, а також зменшення проникності та транслокації бактерій, допомагаючи уникнути або покращити патологію (рис. 1).
Реакція епітелію кишечника на дієту та мікроби. Дієти, що містять ферментовані волокна, стійкі крохмалі тощо, призводять до посиленого бродіння в кишечнику та виробництва SCFA. Постійна дієта, що містить ці елементи, зміщувала б мікробіом кишечника хазяїна, збільшуючи частку бактерій, що продукують SCFA. У свою чергу, збільшення виробництва SCFA також збільшить захист епітелію за рахунок посилення бар'єру, що опосередковується збільшенням виробництва білка TJ та TEER, а також зниженням проникності та транслокації бактерій. Так само дієта, що містить пробіотичні бактерії, з часом підвищила б бар’єрну функцію та цілісність. І навпаки, дієта, яка сприяє збільшенню популяцій патогенних або умовно-патогенних бактерій (як при вживанні молочного жиру) в ландшафті, мала б протилежні наслідки, зменшуючи вироблення білка TJ та змінюючи їх розподіл, а також зменшуючи TEER і тим самим погіршуючи цілісність бар’єру . Потім це призведе до збільшення проникності бар’єру, що призведе до збільшення транслокації бактерій і, таким чином, посилення такої патології, як збільшення запалення кишечника.
6. Перспектива
Вплив бактерій на кишкову бар’єрну функцію наочно ілюструється дією специфічних патогенних кишкових бактерій, які створили чудові засоби для проникнення та обходу цього важливого механізму захисту господаря. Патогенні кишкові бактерії, такі як сальмонели, шигели та ієрсінії, використовували специфічні ефекторні білки для зміни білків кишкового зв’язку та послаблення бар’єрної функції. З іншого боку, мільйони років еволюції призвели до придбання складної мікробіоти кишечника, яка була обрана за здатністю підтримувати симбіотичні стосунки з господарем. Ця біота сформувалася через складний набір факторів навколишнього середовища, включаючи дієтичні звички. Факти свідчать, що ця біота не тільки перешкоджає доступу патогенних бактерій до епітеліального бар’єру, але й активно сприяє стану здорового бар’єру завдяки дії їх метаболізму.
Деякі бактерії, такі як Lactobacillus plantarum, модулюють епітеліальний бар'єр завдяки дії секретируемого білка (LGG p40), тоді як інші, такі як Clostridium, ймовірно, впливають на бар'єр шляхом вироблення метаболітів (SCFA). З огляду на багатство та різноманітність мікробіоти, було б важливо “видобути” цю біоти і визначити мікроорганізми з “бар’єрною захисною функцією”. Через взаємодію дієти та мікробного складу, визначення харчових компонентів, що сприяють бар'єрній функції, також повинно бути головним пріоритетом. Інтеграція мікробної геномної, метаболомічної та транскриптомічної технологій була б важливою для просування цієї місії вперед. Розуміння складних взаємозв’язків між епітеліальним бар’єром, мікробами та дієтою, безперечно, сприяло б ключовим знанням, які можуть бути використані з терапевтичною метою.
Подяка
Ця робота підтримується Національними інститутами охорони здоров’я R01DK047700 та R01DK073338 К. Джобіну, а також Відділом підготовки, розвитку робочої сили та різноманітності Національного інституту загальних медичних наук (NIGMS) грантом K12GM000678 Дж. Р. Гусману.
- Споживання середземноморської та західної дієти призводить до відмінного мікробіому молочної залози
- Дієта та кишкові дисахаридази1 Основний медичний ключ
- Дієта, мікробіом кишечника та епігенетика Нові зв’язки із запальними захворюваннями кишечника та перспективами
- Дисбіоз мікробіома кишечника та підвищена проникність кишечника у дітей з аутоімунітетом на острівцях
- Прикордонний вплив дієти на кишковий мікробіом сома, що харчується деревом, Panaque nigrolineatus