Діагностичні та терапевтичні рекомендації щодо лікування гіперфенілаланінемії у пацієнтів віком 0–4 роки
Анотація
Передумови
Лікування фенілкетонурії (ФКУ) сапроптерином дигідрохлоридом у хворих з раннього віку може мати багато переваг для пацієнта над обмеженням харчування. Відповідно, схвалення сапроптерину в Європейському Союзі було продовжено в 2015 р., Включаючи пацієнтів у віці 0–4 років, приводячи віковий діапазон лікування у відповідність із показником у США та надаючи додатковий варіант лікування для тих пацієнтів із ФКУ, які реагують або частково реагують реагує на лікування сапроптерином. Згодом були опубліковані європейські настанови щодо діагностики та ведення пацієнтів із ФКУ. Проте тестування на ФКУ може бути складним та вимагатиме особливого досвіду. Ми зібрали реальні рекомендації на основі досвіду в алгоритмічному форматі, що доповнюють опубліковані рекомендації, із загальною метою досягти оптимізованого та індивідуалізованого догляду за пацієнтами з ФКУ.
Результати
Наші вказівки охоплюють такі аспекти, як проведення, моніторинг та інтерпретація відповідних біохімічних заходів для досягнення ефективного ведення пацієнта та бажаних результатів, як провести тест навантаження на тетрагідробіоптерин (BH4) для оцінки чутливості у новонароджених та як розпочати лікування сапроптерином у пацієнтів з народження. Ми також надаємо свій експертний висновок щодо початку фармакотерапії у пацієнтів, які раніше лікувались лише дієтою.
Висновки
Настанови на основі реального світу особливо важливі для управління терапевтичними стратегіями новонароджених з ФКУ для досягнення оптимальних довгострокових результатів і слугуватимуть доповненням до інших опублікованих рекомендацій.
Вступ
Фенілкетонурія (ФКУ) - рідкісне аутосомно-рецесивне метаболічне розлад, при якому дефіцит печінкового ферменту фенілаланінгідроксилази (ПАУ) призводить до повної або часткової нездатності метаболізувати фенілаланін (Phe) у тирозин [1]. Це може призвести до підвищених концентрацій Phe в крові, які, якщо їх не лікувати, можуть перетнути гематоенцефалічний бар'єр і спричинити багато шкідливих наслідків, включаючи глибоку розумову відсталість, судоми та аутичну поведінку [2]. Загальна захворюваність на ФКУ різниться у різних країнах світу: від 1 на 2600 народжених в Туреччині [3] до менш ніж 1 на 100 000 народжених в Японії [4, 5]; інші випадки захворюваності - 1 на 4500 народжень в Ірландії [6, 7], 1 на 10 000 народжень у Сполученому Королівстві [7, 8], 1 на 11 000 народжень у Китаї [9, 10] та 1 на 15 000 народжень в Сполучених Штатах [11].
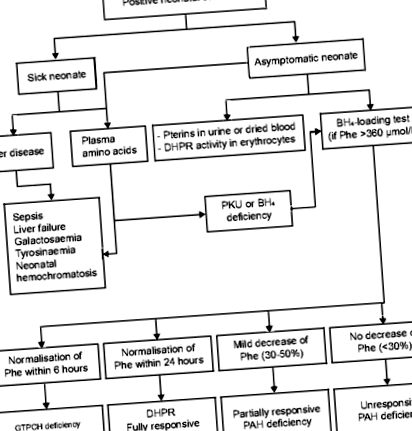
Побічні явища, про які повідомляли у дітей, які отримували сапроптерин, були по суті такими ж, як і у дорослих. У клінічних випробуваннях у дітей віком від 4 років небажаними явищами із частотою ≥10% були головний біль та ринорея; ті, що трапляються із частотою від ≥1% до 120 мкмоль/л) та підвищеним співвідношенням Phe/тирозин (> 3, якщо використовується тандемна мас-спектрометрія), слід підтвердити за допомогою другого зразка крові [29]. Повинні бути виключені всі причини HPA у новонароджених, включаючи захворювання печінки, дефіцит ПАУ, генетичні дефекти синтезу або регенерації BH4 або DNAJC12. Подальші дослідження та генотипування також слід проводити в період новонародженості, щоб оцінити ймовірність реагування на BH4 і, отже, направити варіанти лікування (рис. 1) [28]. Як зазначалося раніше, пацієнти з двома нульовими мутаціями в переклад позиція не реагує на лікування BH4.
Алгоритм діагностики різних типів ФКУ. BH4: тетрагідробіоптерин; DHPR: дигідроптеридин редуктаза; GTPCH: гуанозинтрифосфатциклогідролаза; ПАУ: фенілаланінгідроксилаза; Phe: фенілаланін; ФКУ: фенілкетонурія; PTPS: 6-пірувоїл-тетрагідроптеринсинтаза. Ми рекомендуємо провести повну групу досліджень, навіть у пацієнтів з невідомим генотипом, які не відповідають на навантажувальний тест BH4. Це забезпечить ідентифікацію підтипу ФКУ, що може бути корисним для постійного ведення пацієнта
Виконання тесту навантаження BH4 у новонароджених
Виконання тесту навантаження BH4 у новонароджених має кілька переваг (табл. 1). Тест необхідно проводити якомога раніше після позитивного тесту на ГПА. В ідеалі це повинно бути, як тільки буде встановлено, що у новонародженого немає захворювань печінки або загальної хвороби і якщо концентрація Phe у крові досягає або перевищує рівень 360 мкмоль/л. Під час тесту новонароджена дитина повинна дотримуватися звичайної дієти.
Під час тесту беруть вихідну пробу капілярної крові для вимірювання рівня Phe з подальшим введенням сапроптерину 20 мг/кг (одна доза), розчиненого в грудному молоці або суміші для немовлят (додатковий файл 1). Після введення сапроптерину та протягом усього тесту на вимогу повинен бути наданий нормальний режим годування (наприклад, грудним молоком або звичайною сумішшю для немовлят), а також не слід надавати медичну суміш, що не містить Phe. Зразки капілярної крові для вимірювання рівня Phe беруть через 4, 6, 8, 12, 16 та 24 год після введення сапроптерину (додатковий файл 2). Тест необхідно робити протягом 24 годин, оскільки не можна відкладати лікування у новонароджених із класичною ФКУ, які не реагують на ВН4, довше ніж на 24 години. Результати повинні бути доступні протягом 24 годин після закінчення тесту, після чого може бути проведено лікування; це може бути лише сапроптерин, якщо рівень Phe знижується до цільового діапазону (пацієнти, що повністю реагують) або дієта з обмеженим вмістом Phe (із сапроптерином або без нього), якщо концентрація Phe у крові залишається вище цільового діапазону.
Є деякі дані, які дозволяють припустити, що негативний тест на BH4 може не виключити довготривалої реакції на BH4; тому, за винятком пацієнтів з двома нульовими мутаціями, може бути випадок повторного тестування на реакцію BH4, коли дитина старша [30].
Інтерпретація результатів тесту навантаження BH4
Наочні приклади результатів тестування навантаження BH4 для новонароджених. BH4: тетрагідробіоптерин; ПАУ: фенілаланінгідроксилаза; Phe: фенілаланін; PTPS: 6-пірувоїл-тетрагідроптеринсинтаза
Тематичні дослідження, щоб продемонструвати відповідь на етапі тесту у восьми пацієнтів, що реагують на BH4. BH4: тетрагідробіоптерин; Phe: фенілаланін. Р1–8, пацієнти 1–8
Варто зазначити, що поріг ≥30% є довільним; тому пацієнти з меншим зниженням концентрації Phe все ще можуть продемонструвати клінічно значуще підвищення толерантності до Phe під час довготривалого терапевтичного випробування, головним чином, якщо було проведено тест навантаження BH4, коли концентрація Phe у крові низька. І навпаки, пацієнти, що демонструють зниження концентрації Phe у крові на ≥30%, можуть не задовільно реагувати на сапроптерин під час довготривалого терапевтичного дослідження. Це часто трапляється, якщо скорочення лише трохи перевищує 30% або спостерігається лише в один момент часу тесту. Отже, позитивний результат навантажувального тесту BH4 повинен бути критично перевірений та підтверджений довготривалим терапевтичним випробуванням із значною перевагою, визначеною з точки зору толерантності до Phe. У пацієнтів, у яких спостерігається зниження рівня Phe у крові більше ніж на 30%, можна провести 1-місячне дослідження. Це можна зробити лише за допомогою сапроптерину, якщо рівень Phe впав до цільового діапазону (пацієнти, що повністю реагують), або сапроптерину в поєднанні з дієтою з обмеженим вмістом Phe, якщо рівень Phe в крові залишається вище цільового діапазону. Пацієнтам, які не реагують, слід розпочати дієту з обмеженим вмістом Phe.
Лікування сапроптерином для новонароджених із дефіцитом ПАГ, що реагує на BH4
Після завершення тесту навантаження BH4 можуть виникнути два потенційні сценарії. Якщо можливо отримати результати на наступний день після проведення навантажувального тесту, лікування ВН4 може бути здійснено негайно (у разі повної відповіді). Якщо неможливо отримати результати за цей проміжок часу, слід розпочати дієтологічне лікування, або лише з медичного харчування, що не містить Phe, якщо вихідне значення Phe> 600 мкмоль/л, або можна вводити змішане харчування з грудним молоком/повноцінною сумішшю для немовлят якщо базове значення Phe 360 мкмоль/л: зменшіть споживання Phe на 10–30%, залежно від ступеня підвищення рівня крові [21, 22, 34].
Може знадобитися кілька тижнів, щоб визначити максимальне споживання Phe, яке можна переносити, зберігаючи концентрацію Phe у крові в цільовому діапазоні. Отже, вищезазначений алгоритм слід застосовувати принаймні 4 тижні. Якщо була обрана початкова доза 10 мг/кг/день, а вплив на дієтичну толерантність до Phe був задовільним, слід розглянути можливість збільшення дози до 20 мг/кг/день. Після досягнення пацієнтом максимального нормального споживання Phe з концентрацією Phe у крові нижче 360 мкмоль/л слід провести критичну оцінку переваг лікування сапроптерином. Розгляд відповідей на певні питання може бути корисним у цій оцінці (Таблиця 2).
Курс успішного терапевтичного випробування сапроптерину у новонародженого з дефіцитом, що реагує на BH4, показаний на рис.
Схематичне зображення курсу успішного терапевтичного дослідження із сапроптерином у новонародженого з дефіцитом ПАГ, що реагує на BH4. BH4: тетрагідробіоптерин; ПАУ: фенілаланінгідроксилаза; Phe: фенілаланін; ФКУ: фенілкетонурія
Лікування сапроптерином для дитини молодше 4 років з попереднім харчуванням
Розглядаючи питання фармакотерапії для дитини віком до 4 років з попереднім вживанням дієти, корисним є алгоритм лікування на рис. 5 разом із наступними питаннями (табл. 3).
Якщо відповіді на будь-яке із запитань є позитивними, слід провести подальші тести на відповідність BH4. Слід зазначити, що до затвердження сапроптерину у дітей у віці 0–4 років у більшості країн Європи можна було дозволити навантажувальний тест BH4, але не лікування; отже, можна було мати ситуацію відомого позитивного тесту, не лікуючи дитину. Якщо результати тесту на завантаження BH4 відсутні, генотипування може допомогти оцінити ймовірність реакції BH4 (Таблиця 4).
Слід зазначити, що виконати тест навантаження BH4 непросто у пацієнтів, які добре керуються дієтою і, отже, мають низькі концентрації Phe у крові (і це побічно підтримує проведення тесту в період новонародженості, коли рівень Phe природно підвищений) . У цих випадках замість цього рекомендується пробне лікування сапроптерином дигідрохлоридом. Якщо ви не можете провести пробне лікування, слід провести тест навантаження BH4. У цьому випадку концентрація Phe на початку тесту повинна бути стабільною> 360 мкмоль/л, що, як правило, вимагає збільшення споживання Phe. Це часто викликає труднощі, і це потрібно робити під пильним керівництвом.
Виконання випробування терапії сапроптерином у пацієнта молодше 4 років, який раніше керувався лише дієтою
Терапевтичні випробування поділяються на скринінговий та тестовий етапи (табл. 5), а алгоритм використовується для регулювання споживання дієтичного Phe в їжі.
Етап скринінгу
На початку тесту пацієнт не повинен мати інфекцій або хвороб. Спочатку дієту продовжують, як зазвичай, і харчовий щоденник ведуть протягом 1 тижня. На основі цього розраховується вихідна толерантність до Phe (PheTol0) та вихідна кількість білка з амінокислотної суміші (амінокислотна добавка [AAS0]). Щоденні зразки крові натще збирають протягом першого тижня та визначають середню концентрацію Phe у крові (Phe0). У деяких випадках тривалість цієї фази може перевищувати 1 тиждень.
Тестова фаза
Сапроптерин вводять вранці по 10 мг/кг/день у вигляді одноразової дози, розчиненої в молоці (додатковий файл 1). Харчовий щоденник знову ведеться протягом 1 тижня, і розраховується поточна толерантність до Phe (PheTol1) та кількість білка з амінокислотної суміші (AAS1). Добові зразки крові натще приймають протягом тижня та визначають середню концентрацію Phe у крові (Phe1).
Підтвердження реакції BH4 алгоритмом прийому Phe
Наведений нижче алгоритм визначає, як регулювати споживання Phe на основі концентрації Phe у крові.
Середня концентрація Phe в крові
360 мкмоль/л: не змінювати споживання Phe.
Середня концентрація Phe у крові 360 мкмоль/л: зменшити споживання Phe на 10–30%, залежно від ступеня підвищення значення крові [21, 22, 34].
Після цього продовжують брати добові зразки крові натще і визначають добові концентрації Phe у крові (Phe2 до Phex). Ми хотіли б підкреслити, що велика кількість добових проб крові корисна для оцінки метаболічного контролю; однак, якщо цього неможливо досягти, частоту забору крові можна зменшити.
Тривалість фази випробування
Через місяць після початку дослідження регулюється кількість введеної амінокислотної суміші (AAS1). Якщо спостерігається подальше збільшення споживання Phe, а отже, і споживання природного білка, інші коригування проводяться пізніше (AASx). Цикл алгоритму повторюється до досягнення стійкого стану (при будь-якому подальшому збільшенні споживання Phe концентрація Phe у крові перевищує 360 мкмоль/л у двох послідовних зразках). Потім споживання Phe спочатку зменшується на 10%. Якщо концентрація Phe у крові протягом наступного тижня залишається за межі цільового діапазону, споживання Phe зменшується ще на 10% (проілюстровано на рис. 4). Якщо вплив на дієтичну толерантність до Phe не був задовільним при дозі 10 мг/кг/добу, слід розглянути можливість збільшення дози до 20 мг/кг/добу. Наприкінці етапу тестування задокументовуються такі значення: різниця між Phe0 та Phex; різниця між PheTol0 та PheTolx; і різниця між AAS0 та AASX.
Пацієнтам під час тривалого лікування сапроптерином рекомендується регулярний моніторинг крові та оцінка дієти та поживності [29].
Оцінка
Після того, як були розраховані значення концентрації Phe у крові, толерантності до Phe та потреби в синтетичних амінокислотах, виконується критичний аналіз користі спочатку в групі, яка лікує пацієнта, а потім разом із родиною пацієнта. Однозначною перевагою з медичної точки зору вважається підвищення толерантності до Phe на ≥100% та зменшення споживання амінокислотної суміші на 50%. Незначні зміни повинні оцінюватися індивідуально в загальному клінічному контексті. Для пацієнтів із значеннями Phe, що виходять за межі цільового діапазону, терапевтичний ефект може також полягати у суттєвому зниженні середньої концентрації Phe.
Висновки
Скорочення
Американський коледж медичної генетики та геноміки
кількість білка з амінокислотної суміші
- Вплив дієтичного втручання та гіполіпідемічного лікування на вазореактивність плечей у пацієнтів
- Ефективність оксибутиніну для лікування гіпергідрозу у пацієнтів із надмірною вагою та ожирінням -
- Рекомендації щодо дієти та способу життя для лікування хронічного кашлю та хронічних захворювань - PubMed
- Якість дієти може стати ключовою метою лікування пацієнтів з депресією - радник психіатрії
- Ефективність таурину при лікуванні стресової стенокардії у пацієнтів з постінфарктним станом