Личинки діабету та ожиріння мух - нові дослідження метаболізму у дрозофіли
Пов’язані дані
Резюме
За останні кілька років спостерігається зрушення у застосуванні дрозофіли - від досліджень росту та розвитку до генетичної характеристики метаболізму вуглеводів, стеринів та ліпідів. Це дослідження, розглянуте нижче, створює нову основу для використання цієї простої системи генетичної моделі для визначення основних механізмів регулювання, що лежать в основі метаболічного гомеостазу, і дає обіцянку надати нове розуміння причин та методів лікування таких критичних розладів людини, як діабет та ожиріння.
Дрозофіла як система для вивчення метаболізму
Відносна легкість вирощування великої кількості личинок дрозофіли або дорослих особин долає недолік їх невеликого розміру, що дозволяє дослідникам використовувати багато однакових основних аналізів для оцінки метаболічної функції. Сюди входять вимірювання активності мітохондрій, аналізи АТФ, метаболізм ліпідів, тести на толерантність до інсуліну, аналізи основної форми ліпідів, що зберігається, триацилгліцерину (ТАГ), а також рівні цукру цілих тварин і циркулюючих циркулюючих речовин. Елегантні аналізи специфічних метаболічних реакцій також можливі у дрозофіли, які неможливо проводити в більш складних хребетних системах, таких як аналіз GFP на мембранно-асоційований PIP3 в інтактних тканинах, ознака активованої фосфоінозитид-3-кінази (PI3K) (Бріттон) та ін., 2002), або репортера GFP, який може бути використаний у дослідженнях на цілих тваринах для дотримання часових та просторових закономірностей активації SREBP (Kunte et al., 2006).
У цьому огляді ми оглядаємо основні метаболічні реакції, які зберігаються між мухами та людьми, наголошуючи на тому, як дослідження дрозофіли дали нові уявлення про те, як регулюються ці шляхи. Щоб обмежити наше опитування, ми зосереджуємось на роботах, які використовують прямі аналізи метаболічної функції для характеристики мутантних фенотипів, і виключаємо статті, що охоплюють регуляцію росту за допомогою інсулінової сигналізації або генетичних досліджень старіння, обидва з яких були розглянуті в інших місцях (наприклад, Едгар, 2006; Helfand and Rogina, 2003; Partridge and Gems, 2002). Картина, яка випливає з описуваних нижче робіт, - це світанок нової ери в біології дрозофіли - де ця проста генетична система все частіше використовується для визначення центральних шляхів, що контролюють метаболізм і фізіологію, з наслідками для поліпшення нашого розуміння того, як гомеостаз зберігається у всіх вищих організмах і викликає порушення обміну речовин у людини.
Дрозофіла як нова генетична модель діабету
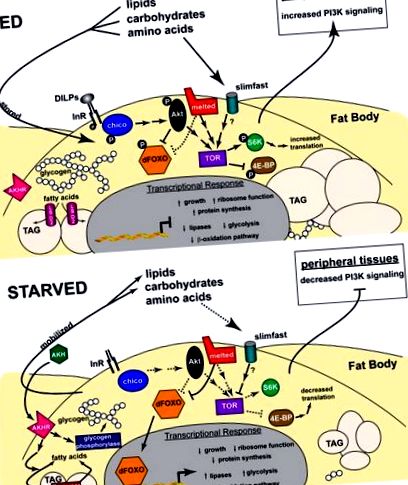
Консервовані шляхи інсуліну/IGF відіграють центральну роль у зростанні та метаболізмі у вищих організмів. У ссавців IGF в основному регулюють ріст, тоді як інсулін функціонує головним чином в гомеостазі глюкози. Ці дві дії об'єднуються на льоту в єдиний шлях інсуліну/IGF. Сім інсуліноподібних пептидів (DILP1-7), функції яких до кінця не з'ясовані (Brogiolo et al., 2001; Ikeya et al., 2002), діють через інсуліноподібний рецептор дрозофіли (InR), ініціюючи каскад внутрішньоклітинних подій, опосередкованих консервативними компонентами шляху інсулін/IGF. Сюди входять субстрат інсулінових рецепторів (IRS) Chico, антагоніст інсулінового сигналу PTEN, PI3K, PKB/Akt-кіназа та одиночний ортолог FOXO dFOXO (огляд Oldham and Hafen, 2003) (Рисунок 1).
Схематичне зображення сигнальних шляхів, що регулюють метаболізм дрозофіли. Функціональні взаємодії, описані в тексті, зображені для жирової клітини тіла як в режимах годування, так і в голоді. Суцільні лінії та стрілки представляють сигнальну взаємодію, тоді як пунктирні лінії та стрілки - регулюючі ефекти, що виникають за відсутності цього сигнального шляху. У згодованому стані (зверху) DILP та поживні речовини подають сигнал через інсуліновий та TOR-шляхи відповідно, що призводить до затримки FOXO у цитоплазмі та збільшення трансляції, що стимулює ріст. Цукри та жирні кислоти зберігаються у вигляді глікогену і TAG, тоді як метаболічні шляхи, що виробляють енергію, регулюються вниз. У голодуючих тварин (знизу) сигналізація про інсулін та TOR послаблюється, спрямовуючи транслокацію ядер FOXO та зменшуючи синтез білка, обмежуючи ріст. Глікоген і TAG мобілізуються за допомогою АКГ та ліпаз, таких як Бруммер, тоді як метаболічні шляхи, що виробляють енергію, регулюються вгору. Докладніше див. У тексті.
Новаторські дослідження кількох лабораторій дали нові захоплюючі уявлення про те, як DILP регулюють вуглеводний обмін у дрозофіли. За нормальних умов годування три гени dilp (dilp2,3,5) експресуються в невеликих скупченнях серединних нейросекреторних клітин мозку (Brogiolo et al., 2001; Broughton et al., 2005; Ikeya et al., 2002). Експресія dilp3 та dilp5 знижується у цих клітинах, що виробляють інсулін (МПК), у відповідь на зниження рівня вуглеводів у їжі, але не на голодування амінокислот, що вказує на те, що рівень розрідження може відповідати на специфічні харчові ознаки, подібно до інсуліну у людей (Colombani et al., 2003; Ікея та ін., 2002). Більше того, абляція МПК призводить до діабетичних фенотипів, у тварин спостерігається значне збільшення циркулюючої глюкози та трегалози (дисахарид, який є первинним цукром крові у комах), а також помірне збільшення збережених ліпідів (Broughton et al., 2005; Rulifson та ін., 2002). МПК, схоже, функціонують як β-клітини підшлункової залози, оскільки вони безпосередньо контактують із серцем і, таким чином, можуть викидати DILP у систему кровообігу для підтримання відповідного рівня циркулюючих цукрів, хоча регулювання секреції DILP за допомогою МПК залишається невідомим (Rulifson et al., 2002 ).
Метаболічні функції сигналізації TOR
Хоча відомо, що рівні амінокислот модулюють активність TOR, механізми, що лежать в основі цієї реакції, залишаються недостатньо вивченими. Генетична характеристика транспортера амінокислот Slimfast дала деякі початкові підказки щодо цього шляху, вказуючи на те, що він функціонує як датчик поживних речовин в жировому тілі личинки, контролюючи системну реакцію, яка пов'язує рівень амінокислот з ростом організму (Colombani et al., 2003 ). Спостереження, що специфічна для жиру інактивація або slimfast, або dTOR призводить до подібних фенотипів, підтверджує думку, що Slimfast може подавати сигнал через dTOR в жировому тілі для глобального регулювання росту та метаболізму у відповідь на рівень амінокислот. Цей шлях сенсору амінокислот жирового тіла може замінити передачу сигналів інсуліну в периферичних тканинах шляхом інгібування активності PI3K, очевидно, через один або кілька невстановлених факторів, що виходять із жирового тіла (рис. 1).
Генетичний скринінг для регуляторів росту у дрозофіли виявив нового члена сигнального шляху TOR, розплавленого (Teleman et al., 2005b). Цей ген кодує білок з доменом гомології плекстрину (РН), який є важливим для його функції. Розплавлений може зв’язувати TSC1 і завербувати комплекс TSC1/2 до клітинних мембран, припускаючи, що він може діяти вище за TOR. розплавлені мутанти знижують рівень ліпідів, але не виявляють явних дефектів рівня цукру в циркуляції. Хоча механізми залишаються незрозумілими, розплавлений може допомогти полегшити фосфорилювання dFOXO та TSC2 за допомогою Akt у відповідь на введення інсуліну. Відповідно до пропозиції про те, що розплав обмежує відповідь на dFOXO, ціль dFOXO 4E-BP сильно регулюється у виснажених розплавлених мутантів, а знижений рівень dFOXO може придушити дефекти метаболізму ліпідів у розплавлених мутантів. Ідентифікація розплавлених гомологів у C. elegans, мишей та людей створює основу для подальших досліджень, щоб зрозуміти його роль у передачі сигналів TOR та FOXO, а також у ліпідному обміні.
В основному, на основі досліджень у культивованих клітинах, вважається, що 4E-BP опосередковує ефекти зростання TOR шляхом прямого інгібування синтезу білка (Hay and Sonenberg, 2004; Oldham and Hafen, 2003). Однак останні генетичні дослідження дрозофіли оскаржили цю модель. Дослідження втрати функції та посилення функції продемонстрували, що 4E-BP не впливає на ріст (Teleman et al., 2005a). Навпаки, мутантні мухи 4E-BP чутливі до голоду і демонструють значне зменшення накопичених ліпідів при тривалому голодуванні. І навпаки, тварини, що експресують конститутивно активну форму 4E-BP, демонструють підвищений загальний рівень ліпідів. Ця роль 4E-BP узгоджується з дефектами метаболізму ліпідів, що спостерігаються у мишей-мутантів 4E-BP (Tsukiyama-Kohara et al., 2001). Крім того, мутанти дрозофіли Lk6 демонструють підвищений рівень ліпідів, що узгоджується з роллю Lk6 у протидії інгібуючому ефекту 4E-BP (Reiling et al., 2005). Ці дослідження підтверджують критичну важливість генетичних досліджень на тваринах для тестування моделей, отриманих із культивованих клітин, і дають основу для характеристики механізмів, за допомогою яких сигналізація FOXO та TOR регулює гомеостаз.
Регуляція метаболізму за допомогою SREBP та мікроРНК
Генетичні дослідження мутанта dSREBP дали уявлення про його роль у тварині (Kunte et al., 2006). Нульові мутанти dSREBP гинуть як низькорослі личинки другого віку та демонструють знижений рівень жирних кислот, хоча відносна частка основних довголанцюгових жирних кислот залишається незмінною. Відповідно до цього фенотипу, автори виявили знижену експресію трьох генів синтезу жирних кислот у мутантів dSREBP, і додавання соєвих ліпідів або специфічних довголанцюгових жирних кислот до середовища для росту було достатнім для порятунку летальності. Автори розробили систему репортерів dSREBP-GFP для моніторингу просторових та часових закономірностей транскрипційної активності dSREBP у тварини, показуючи, що вона зазвичай активна в жировому тілі, середній кишці та еноцитах годуючих личинок. Важливо, що цю активність можна придушити, додавши надлишок ліпідів до раціону, демонструючи, що репортер підлягає нормальному контролю за зворотним зв’язком. Буде цікаво вивчити інші метаболічні параметри мутантів dSREBP, такі як рівні глюкози та ліпідів, а також визначити прямі транскрипційні мішені, які забезпечують кращу механістичну основу для розуміння його ролі у фізіології ліпідів.
Нове розуміння регуляції ліполізу
Тіло личинки служить динамічним джерелом для підтримання енергетичного гомеостазу та необхідним резервуаром для зберігання ліпідів протягом тривалого періоду не годування під час метаморфозу. Відповідно, жирова маса ліпідів у тілі зростає до ~ 15% від загальної ваги тварини в третій період, з ~ 6%, як тільки що вилупився перший вік, більшість з яких можна віднести до TAG (Church and Robertson, 1966a; Church and Робертсон, 1966б). Тіло личинок у новонароджених дорослих протягом перших кількох днів замінюється дорослими жировими клітинами, причому дорослі особини підтримують ∼6,5% від маси тіла у вигляді ліпідів, подібно до того, що спостерігався в перший етап (Aguila et al., 2007; Rizki, 1978; Teague та ін., 1986). Цей зсув ліпідного навантаження вказує на зміну функції жиру в організмі, від спрямування росту організму та зберігання ТАГ на стадіях личинок до підтримання енергетичного гомеостазу у дорослої людини (Colombani et al., 2003; Rizki, 1978). Відповідно до цього, товсте тіло дорослого населення піддається дієтичному перевантаженню ліпідів, на відміну від личинкового жирового тіла, спостереження, яке визначає дорослу муху як ідеальний контекст для функціональних досліджень ожиріння, спричиненого дієтою, що є критичним фактором ризику для захворювання людини. (Bross et al., 2005; Sanchez-Blanco et al., 2006).
Одним із прикладів цього є природний жировий мутант 60, який демонструє підвищений рівень загального ліпіду в нормальних умовах годування у дорослої людини, без ефектів на більш ранніх стадіях, поряд із значною стійкістю до голоду (Hader et al., 2003; Teague et співавт., 1986). Адипозний ген кодує білок з повторами WD40, який широко експресується на всіх стадіях розвитку і який може зменшити TAG при надмірній експресії в жировому тілі личинки (Hader et al., 2003). У цьому дослідженні також зазначено, що ортологи адипозе кодуються як мишами, так і людськими геномами, і припущено, що його роль у ліпідному обміні може бути збережена шляхом еволюції. Що важливо, цей прогноз нещодавно був підтверджений Suh et al. (2007), який показав, що миші з однією мутантною копією жирової тканини страждають ожирінням та стійкістю до інсуліну, тоді як трансгенна надмірна експресія жиру в жирі призводить до мишей, які є худими та чутливими до інсуліну. Біохімічні дослідження та дослідження культури клітин вказують на те, що жировий білок може зв’язувати гістони та HDAC3 і може функціонувати як частина транскрипційного комплексу корепресорів. У сукупності ці дослідження демонструють потужну прогностичну функцію генетики дрозофіли, коли гени, виявлені в льоту, виявляють нові рівні метаболічного контролю, які мишам і людям зберігається в процесі еволюції.
У сукупності ці новаторські генетичні дослідження метаболізму ліпідів дрозофіли виявляють еволюційне збереження функції периліпіну та ATGL, а також чіткі механізми, за допомогою яких Браммер та AKHR контролюють мобілізацію ліпідів у дрозофіли. Відносно велика кількість передбачуваних ліпаз, кодованих муховим геномом (Додаток. Таблиця 1), регуляція багатьох з цих генів голодуванням (Grönke et al., 2005; Zinke et al., 2002), і подібний протеомічний склад краплі ліпідів мух і ссавців (Cermelli et al., 2006), встановлюють паралелі між фізіологією ліпідів мухи та людини і вказують на те, що майбутні дослідження дрозофіли дадуть нові уявлення про те, як підтримується ліпідний гомеостаз.
Дефекти поглинання стеролу та незаконного обігу при патології Німана-Піка типу C.
Окрім своєї суттєвої ролі в клітинних мембранах, холестерин діє як попередник стероїдних гормонів, таких як комаха стероїд екдизон, який ініціює основні перехідні процеси в життєвому циклі (Thummel, 2001). Незважаючи на те, що останні дослідження визначили багато біохімічних етапів, за допомогою яких холестерин перетворюється в екдизон (Rewitz et al., 2006), механізми, що контролюють зондування, всмоктування, внутрішньоклітинний обіг та гомеостаз холестерину, залишаються незрозумілими. Нещодавня робота над білками Niemann-Pick типу C (NPC) запропонувала розуміння цих процесів на льоту, що має наслідки для розуміння гомеостазу стеринів у людей.
Навіщо вивчати метаболізм у дрозофіли?
Можливість маніпулювати геномом мух практично будь-яким способом, у поєднанні з низкою нових доступних геномних ресурсів, дозволяють досліднику визначити молекулярні механізми функціонування генів на рівні роздільної здатності, який неможливий у більш складних організмів. Крім того, жодні дослідження на сьогоднішній день не використовували одну з головних сильних сторін дрозофіли - здатність проводити широкомасштабні відкриті генетичні скринінги - підхід, який обіцяє розширити наше розуміння метаболічної регуляції в нових і несподіваних напрямках. Цілком ймовірно, що ми маємо на що чекати в найближчі кілька років, оскільки подальші дослідження використовують скромну плодову муху, щоб відкрити нові уявлення про регуляцію метаболізму та гомеостазу.
- Вплив ферментативно синтезованого глікогену на метаболізм ліпідів у мишей із ожирінням, індукованих дієтою
- Регуляція метаболізму глюкози у хворих із ожирінням та у пацієнтів після біліопанкреатичної
- Годуючи мишей з діабетом, що страждають ожирінням, дієта геністеїном викликає термогенні та метаболічні зміни - Роквуд -
- Метаболізм жирних кислот, центральна нервова система та годування - Роннет - 2006 - Ожиріння - Уайлі
- Прикордонні мікрочастинки, отримані від тромбоцитів від ожирілих особин Характеристика кількості, розміру,